A metformin potenciálja az étrend korlátozásának előnyeit: Metabolomikus tanulmány
Marta Riera-Borrull
2 Centro de Investigaciones Biológicas (CIB-CSIC), 28040 Madrid, Spanyolország
Anabel García-Heredia
Salvador Fernández-Arroyo
3 Molecular Oncology Group, Girona Biomedical Research Insitiute (IDIBGI), 17190 Girona, Spanyolország; gro.igbidi@sayuce (E.C.); gro.igbidi@zednenemj (J.A.M.)
Anna Hernández-Aguilera
Noemí Cabré
Elisabet Cuyàs
3 Molecular Oncology Group, Girona Biomedical Research Insitiute (IDIBGI), 17190 Girona, Spanyolország; gro.igbidi@sayuce (E.C.); gro.igbidi@zednenemj (J.A.M.)
4 ProCURE (a rák terápiás rezisztenciája elleni program), Metabolizmus és Rák Csoport, Katalán Onkológiai Intézet, 17190 Girona, Spanyolország
Fedra Luciano-Mateo
Jordi táborok
Javier A. Menendez
3 Molecular Oncology Group, Girona Biomedical Research Insitiute (IDIBGI), 17190 Girona, Spanyolország; gro.igbidi@sayuce (E.C.); gro.igbidi@zednenemj (J.A.M.)
4 ProCURE (a rák terápiás rezisztenciája elleni program), Metabolizmus és Rák Csoport, Katalán Onkológiai Intézet, 17190 Girona, Spanyolország
Jorge Joven
5 A Nemzetközi Kiválóság Campusja, Dél-Katalónia, 43003 Tarragona, Spanyolország
Társított adatok
Absztrakt
1. Bemutatkozás
A kortárs magas energiájú és magas zsírtartalmú étrend az ülő életmód hatásával párosulva szorosan összefügg az elhízás, az inzulinrezisztencia, a 2-es típusú cukorbetegség (T2D) és az alkoholmentes zsírmájbetegség (NAFLD) konvergens járványaival. Ezek az anyagcserével járó társbetegségek világszerte komolyan veszélyeztetik az egészségi állapotot és az életminőséget [1]. Az életmódmódosítási megközelítések hatékonysága alacsony, és a zsírbevitel csökkentésével kiváltott viszonylag ismeretlen sejtes anyagcsere-stratégiák és kompenzációs utak komolyan gátolják [2,3].
A metformin működését nem teljesen értik, de számos bizonyíték arra utal, hogy az energia homeosztázisban kritikus szerepet játszik egy komplex kép, amely magában foglalja a tápanyagok és az anyagcsere-szervek, különösen a máj, a bél és a zsírszövet közötti molekuláris áthallás hatását [20,21] . Itt elvégeztük az egerek kísérleti étrendjének metformin-kezeléssel vagy anélkül történő etetésénél előforduló metabolikus fenotípusok integrált elemzését, célzott metabolikus megközelítés alkalmazásával. Teszteltük azt a hipotézist, miszerint egyidejű metformin és egyszerű étrend-visszafordító kezelés javíthatja a HFD által kiváltott zavarokat.
2. Eredmények
2.1. Hatások a testtömeg és a táplálékfelvétel szabályozására
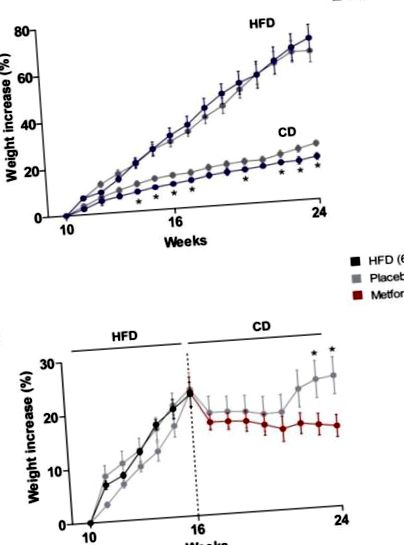
A HFD csoportba tartozó egerek gyorsabban híztak, mint a chow diet (CD) alomtársak. Bár a metformin-kezelés nem volt hatással a HFD-vel fertőzött egerek testtömeg-szabályozására, a kísérlet negyedik hetétől a követés végéig (24 hét) a CD-n lévő egereknél a testtömeg-növekedés jelentős csökkenéséhez vezetett (ábra). 1 A). A HFD-vel táplált egerek testtömeg-növekedése azonnal csökkent, miután átálltak a CD-re. Figyelemre méltó, hogy a metformin szignifikánsan hatékonyabb volt, mint a CD önmagában, a testtömeg-gyarapodás csökkentésében, különösen 6-7 hét étrend megfordítása után, amikor a csak CD-vel táplált egerek kezdték visszanyerni az elveszett testsúlyt (1. B ábra).
2.3. A hiperlipidémiára gyakorolt hatások
A koleszterin és a trigliceridek plazmaszintje szignifikánsan magasabb volt a HFD csoportban, mint a CD csoportban (3. A ábra). A metforminnal végzett kezelés az összes szérum koleszterin és a sűrű kis sűrűségű lipoprotein (LDL) koleszterin koncentrációjának csökkenését eredményezte a CD-vel etetett állatokban; a HFD-vel táplált állatoknál nem észlelt hatás (3. ábra A, B). A metformin által kiváltott LDL-szint változásokat a CD-vel táplált egerekben a szérum triglicerid koncentrációjának és a trigliceridek LDL frakciójának jelentős csökkenése kísérte (3. ábra A, B). Az étrend CD-re történő visszaváltása eltörölte a keringő koleszterinszint növekedését, amelyet a HFD-táplálás elősegített (3. C ábra). A lipoprotein eloszlás a metforminnal vagy anélkül diéta megfordításának alávetett egerekben nagymértékben hasonlított a vad típusú állatoknál általában megfigyeltekhez (vagyis a nagy sűrűségű lipoprotein (HDL) frakció szinte teljes koleszterinszintjéhez) (3.D ábra). A metformin beadása elősegítette a keringő koleszterinszint további csökkenését az étrenden váltott egerekben, valamint a szérum triglicerid koncentrációjának statisztikailag szignifikáns csökkenését (3. C ábra).
Az étrend által kiváltott változások és a metformin hatása a plazma lipidekre és a lipoprotein eloszlásra. (A) Plazma lipidek és (B) lipoprotein eloszlás, gyors teljesítőképességű folyadékkromatográfiával mérve egereken, 14 héten keresztül kísérleti táplálékkal etetve. CD, chow étrend; HFD, magas zsírtartalmú étrend; (C,D) ugyanazok a mérések egereken az étrend megfordítása után, metforminnal vagy anélkül. A csillagok szignifikánsak (* p 4 A, B ábra). A metformin beadása szignifikánsan csökkentette az adipocita méretét és az eWAT depó relatív súlyát is CD-vel táplált egerekben. Ezzel szemben a metforminnal végzett kezelés tovább növelte a zsírsejtek területét és a fehér zsírszövet (WAT) relatív súlyát a HFD-vel táplált állatokban (4. C ábra). Noha a metformin-kezelés növelte a WAT depó veszteségét az étrend megfordításának alávetett állatoknál, és az adipocita területének jelentős csökkenéséhez vezetett, az adipocyták átlagos mérete nagyobb maradt, mint a kizárólag étrend megfordításával kezelt állatoké (4. ábra D).
Az étrend által kiváltott változások és a metformin hatása a máj fenotípusára. Az étrend és a metformin hatása a táplálkozási változások során meghatározott időpontokban. A H&E-vel festett májrészek reprezentatív mikrofotói (100 ×)A,B) és az F4/80 immunokémia (C,D) bemutatja az étrend és a metformin hatását a steatosis pontszámában és a makrofágok arányában; (E) a metformin hatása a kiválasztott citokinek májkoncentrációjában CD-vel táplált egerekben. Az 1. ábra szerinti mondák és a csillagok szignifikánsak (* p 5. C ábra). Az étrend megfordítása enyhítette a májgyulladást a HFD csoportban, amit az F4/80 + gyulladásos sejtek számának jelentős csökkenése mutat (5. D ábra). Megjegyzendő, hogy a diétával megfordított állatok metforminnal végzett kezelése szinte teljesen megszüntette az F4/80 + makrofágok jelenlétét (5. D ábra), amelyek szintén megnövekedettnek tűntek; morfológia, amely utalhat a HFD-t követő aktivált állapotra. A metformin azon képessége, hogy csökkenti a HFD által kiváltott krónikus gyulladást, magában foglalhatja a prototípusos gyulladásgátló citokinek, köztük az interleukin (IL) -1β és a tumor nekrózis faktor-α (TNFα) csökkent termelését, mivel ezeknek a citokineknek a szintje jelentősen csökkent a metforminban. kezelt egerek. A változások hasonlóak voltak mind a CD, mind a HFD sémákban. Az érthetőség kedvéért csak a CD-vel táplált egerekben, metforminnal vagy anélkül kapott értékeket mutatjuk be az 5. E ábrán.
2.7. Hatás a máj- és zsírszövet energia-metabolitjainak szintjére
Az egerek HFD-nek való kitettsége hatással van az energia-metabolitok szintjére, amely WAT-ban és májban eltérő. A WAT-ban a HFD a glükóz-6-foszfáthoz közeli glikolitikus intermedierek szintjének csökkenéséhez vezetett, míg a citromsav-ciklus (CAC) növeli a citrát/izocitrát és az α-ketoglutarát közbenső termékeit. Ezzel szemben a HFD elősegítette a glükóz-6-foszfáthoz közeli glikolitikus köztitermékek felhalmozódását a májban, vagyis a glükóztranszportban és a foszforilációban részt vevő köztitermékeket, miközben jelentősen csökkentette az elágazó láncú aminosavakat (BCAA) (6. ábra).
Az étkezési zsír relatív hatása a zsírszövet és a máj energia-anyagcseréjéhez kapcsolódó metabolitok szintjére. A metabolitok zöld, piros vagy szürke színnel vannak jelölve, ha a HFD hatásának megfelelően jelentősen csökkentek, fokozódtak vagy nem észlelték őket.
Az étrend okozta változások és a metformin hatása a fehér zsírszövet (WAT) energia metabolitjaira. (A) Mindkét étrend hatása elkülönül, hogy kiemelje a metformin válasz specifikus változásait; a metabolitok zöld, piros vagy szürke színnel vannak jelölve, ha jelentősen csökkentek, fokozódtak vagy nem észlelték őket; (B) a részleges legkisebb négyzetes diszkrimináns elemzés vizuálisan megmutatja a mért metabolitok szerepét a különböző kísérleti csoportok közötti diszkriminációban; (C) véletlenszerű erdőket használtak a metabolitok fontosságának felügyelet nélküli rangsorolására, a metformin differenciális hatásának magyarázata érdekében; (D) standardizált metabolit-koncentrációk, amelyek hőtérképként vannak feltüntetve. A különböző étrenddel és metforminnal kezelt egérpopulációk színkódként szerepelnek a grafikon felső részében, míg a metabolit neveket sorokhoz rendelték.
Az étrend által kiváltott változások és a metformin hatása a máj energia metabolitjaira. A leíró részletek megőrződnek, mint a 7. ábra .
3. Megbeszélés
A HFD-nek való kitettség krónikus gyulladást okoz a májban, ami kritikus tényező az elhízással kapcsolatos glükóz-intolerancia, inzulinrezisztencia és a NAFLD progressziójának kialakulásában [25]. Az energia-túlterhelés hatására az anyagcsere-szövődmények kialakulásának egész életen át tartó kockázatának ezt a mechanizmusát a metformin befolyásolja. A metforminnal és az étrend megfordításával kezelt egerek jobb védelmet mutattak a HFD által kiváltott máj steatosis ellen, amelyet a májba beszűrődő gyulladáscsökkentő makrofágok, valamint a fő gyulladáscsökkentő citokinek alacsonyabb szintje kísért. A metformin képessége e sejtek polarizációjának vagy migrációjának modulálására a közelmúltban bebizonyosodott a tumorral társult makrofágokban [26]. A jövőbeli vizsgálatok során meg kell vizsgálni, hogy a metformin hozzájárul-e a máj és a zsírszövet gyulladásának csökkentéséhez azáltal, hogy megakadályozza a makrofágok (vagy mindkettő) toborzását vagy gyulladáscsökkentő aktivációját [27].
Az étrend megfordítása nem tudta helyreállítani a HFD által kiváltott májkárosodást, hacsak metforminnal nem kombinálták. A metformin csökkentette a glükóz- és glutamin eredetű CAC köztitermékek áramlását, és úgy tűnik, hogy legyőzi a máj szénhidrátok tárolására és metabolizálására való képességét, ezáltal jobban megelőzve a HFD által kiváltott májkárosodást, amikor átáll a normál étrendre. A mechanizmusokat továbbra sem kell teljes mértékben megérteni, de valószínűleg összefüggenek a mitokondriumoktól függő bioszintetikus aktivitásra és a de novo lipogenezisre gyakorolt ismert hatásokkal [28,29]. Ezért a megnövekedett mitokondriális CAC funkció és az anabolikus utakon átáramló áramlás döntő szerepet játszik az obesogén étrend által kiváltott zsírmáj- és inzulinrezisztencia patobiológiájában [30,31]. Ez a tanulmány nem nyújt egyértelmű bizonyítékot arra vonatkozóan, hogy a metformin és az étrend megfordítása miként oszthatja meg a mechanizmusokat, de azt sugallja, hogy a metformin enyhítheti a gyulladást, és hogy mitokondriális adaptációkat lehet feltárni a HFD által kiváltott máj szövődmények mechanizmusaként.
Bár még mindig viták vannak a metformin hatásmechanizmusaival kapcsolatban [35], egészségüket elősegítő hatásukat nagyrészt annak a következményének tekintik, hogy képes az alapvető inzulin/IGF-1 tápanyag-érzékelő hálózatokat egyidejűleg a nem sejtekhez irányítani. autonóm szint, AMPK/mTOR pedig sejt-autonóm szinten [7,36,37,38]. Alternatív megoldásként nem vetjük el az elsődleges downstream következményeket egyetlen fő mechanizmuson, amelyet még nem azonosítottak. Robusztus mintákat találtunk, amelyek jelzik a metformin azon képességét, hogy modellvegyületként szolgáljon a metabolikus szövődmények HFD-vezérelt progressziójának megakadályozására. A metformin-alapú farmakoterápia és az étrend módosításának klinikai kombinációja elősegítheti a szükséges táplálék-zsírbevitel anyagcsere-következményei elleni nagyon szükséges terápiás és megelőző stratégiák kidolgozását.
4. Anyagok és módszerek
4.1. Állatok, állatgondozás és étrendi részletek
4.2. Kísérleti tervezés és metformin biztosítás
Az állatokat számítógéppel generált randomizációs ütemtervek alapján kísérleti csoportokba soroltuk, és az eredmények értékeléséért felelős kutatók nem tudtak arról a kísérleti csoportról, amelyhez az állatok tartoztak. Egyetlen állatot sem zártak ki az elemzésből. Először az eredeti CD-vel vagy HFD-vel táplált egerekben vizsgáltuk a metformin választ 14 hétig. Az egereket két étrendi csoportba osztottuk (n = 16, mindegyik), és tovább osztottuk azokat egerekben, akik naponta metformint (Sigma, Madrid, Spanyolország) vagy placebót (Monteloeder, Elche, Spanyolország) kaptak (n = 8, mindegyik). Az egereket 24. héten feláldoztuk izoflurán inhalációval. Hasonló módon folytattuk párhuzamos kísérletek során a metformin választ olyan egerekben, amelyek káros gyulladásos és metabolikus állapotban voltak, és amelyeket HFD-vel etettek 6 héten keresztül. Összehasonlító elemzés céljából néhány állatot (n = 6) ekkor feláldoztunk, a többi almatársat pedig további 8 hétig HFD-vel vagy CD-vel etettük. A CD-vel etetett egereket felosztottuk metformin vagy placebo (n = 8, mindegyik) kezelésére annak felmérésére, hogy a metformin fokozza-e a CD-re való áttérés hatásait. Az egereket 24 héttel feláldoztuk hasonló éhezési idő után (4 óra, maximális különbség 15 perc).
Az ivóvízben oldott metformint (5 mg · ml – 1) 250 mg · kg –1 · nap –1 előállításához használtuk. Amint azt korábban leírtuk, az egerek átlagos plazmakoncentrációja hasonló volt az embernél mérthez, 1,25 g · nap –1 dózissal [36]. A metformin a kezelés folytatása után nem halmozódott fel a plazmában. Ennek az adagolási módnak a megválasztása a korábban publikált adatokon alapult [32,41]. Kezünkben a metformin hatása dózis- és időfüggő lehet, mert a metformin plazma koncentrációjának kiegyensúlyozatlansága figyelhető meg, amikor a metformint bolusos záporral vagy intra-peritonealis injekcióval adják be. Nem értünk el elegendő reprodukálhatóságot, amikor metformint adtunk az étrendhez a gyártási folyamat során, és a gyógyszert leginkább, de szabálytalanul fogyasztották az éjszaka folyamán.
4.3. Mintagyűjtés, analitikai módszerek és szövettani elemzés
4.4. Célzott anyagcsere
4.5. Statisztikai analízis
Az összes eredményt átlag ± SD-ként mutatjuk be, hacsak másképp nem jelöljük. A csoportok közötti különbségeket a Mann – Withney U teszttel (nem paraméteres) értékeltük, és statisztikailag szignifikánsnak tekintettük, amikor p (110K, pdf)
Szerző közreműködései
Jorge Joven és Javier A. Menendez tervezte és tervezte a tanulmányt. Marta Riera-Borrull, Anabel García-Heredia, Salvador Fernández-Arroyo, Anna Hernández-Aguilera és Noemí Cabré kísérleteket és molekuláris vizsgálatokat végzett. Anabel García-Heredia, Elisabet Cuyàs és Fedra Luciano-Mateo immunhisztokémiai vizsgálatokat végzett. Marta Riera-Borrull és Salvador Fernández-Arroyo metabolomikai vizsgálatokat végeztek. Jordi Camps és Javier A. Menendez fontos reagensekkel járult hozzá. Marta Riera-Borrull, Jordi Camps és Jorge Joven adatértelmezést végeztek. Jordi Camps, Javier A. Menendez és Jorge Joven készítették el a kéziratot, amelyet minden szerző átdolgozott és végül jóváhagyott.
Összeférhetetlenség
A szerzők nem jelentenek összeférhetetlenséget.
- A metformin megdönti a diétát, a testmozgás tartós fogyásért, a tanulmány megállapítja a mindennapi egészséget
- Az étrendi szálpótló gyógyszerek listája (6 összehasonlítva)
- Házi készítésű gluténmentes egészséges Tiramisù receptdesszertek előnyökkel
- Az étrend-kiegészítő gyógyszerek listája (207 összehasonlítva)
- Orvosi bizonyíték a Kuding Tea (Kuding Cha) Hello Tea Cup egészségügyi előnyeire