A pitvari septum hibái és a pulmonalis artériás hipertónia
Absztrakt
A pitvari septum defektusai (ASD) gyakori veleszületett szívhibák. Az ASD-ben szenvedő betegek többsége gyakran bonyolult eseményeket követ. Azonban az ASD-ben szenvedő betegek egy részének állapotát pulmonalis hipertónia (PH) bonyolíthatja, ami később jelentős hatást gyakorol a kezelésre, a morbiditásra és a mortalitásra. A PH jelenléte befolyásolja a hibák lezárására való alkalmasságot. Ebben az áttekintésben leírjuk az ASD különféle típusait, a veleszületett szívbetegséghez (CHD) kapcsolódó PH besorolását, amikor az ASD bezárása ellenjavallt, valamint a pulmonális artériás hipertónia (PAH) kialakulásában szenvedő betegek kezelését, beleértve a legszélsőségesebb formát, az Eisenmengert szindróma (ES).
Bevezetés
A pitvari septum defektusai (ASD) a leggyakoribb veleszületett szívbetegségek (CHD) a bicuspid aorta szelep után. A CHD-ben szenvedő betegek körülbelül 13% -át teszik ki (1). Van egy női túlsúly, a férfi-nő arány 1: 2. A legtöbb eset általában szórványos, bár egyes esetekben genetikai mutációk is szerepet játszanak, különösen más veleszületett hibák és/vagy szindrómák jelenlétében (2). Ezeknek a hibáknak a klinikai következménye összefügg az anatómiai elhelyezkedéssel, nagysággal és a kapcsolódó szív-rendellenességekkel, ha vannak ilyenek. A legegyszerűbb ASD anatómiával rendelkező betegek többsége számára a klinikai folyamat gyakran jóindulatú, nagy valószínűséggel társul a felnőttkorban való túléléssel (3). Manapság, a prenatális szűrés és a magzati echokardiográfia fejlődésével a korai élet diagnózisa lehetővé teszi az időben történő beavatkozást.
Ennek ellenére a felnőttek életében először jelentkező betegek aránya továbbra is fennáll. Felnőttkorban diagnosztizálva az ASD esetleges leletként mutatkozhatott be. A betegek egy részének azonban olyan tünetei vannak, mint a jobb kamra volumen-túlterheltsége miatt fellépő légszomj, jobb szívelégtelenség, aritmiák, paradox embólia és esetenként pulmonalis hipertónia (PH).
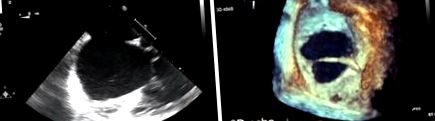
A leggyakoribb diagnosztikai eszköz a transthoraciás echokardiográfia (TTE), amely meghatározza a hiba típusát, méretét és a jobb kamrai funkció/térfogat túlterhelés állapotát. Az ASD kiértékelésekor az echokardiográfián a 3D rekonstrukció ajánlott, mivel a méretet alul lehet becsülni a 2D transthoracicus (TTE) vagy a transoesophagealis echokardiográfián (TOE) (1. ábra). Ezenkívül további nem invazív képalkotást, például kardiovaszkuláris mágneses rezonanciát (CMR) vagy számítógépes tomográfiát (CT) alkalmaznak az egyéb gyakran társuló szív-rendellenességek, például anomális tüdővénás elvezetés kizárására, a TTE-n nem látható váratlan sinus venosus-hiba értékelésére. vagy több ASD (4).
A pitvari septum defektusának értékelése. (A) A secundum ASD 2D transzoesophagealis echokardiográfiai képét mutatja. (B) 3D transzoesophagealis echokardiográfiai képet mutat ugyanarról a hibáról, amely nagyobb pontossággal mutatja a hiba méretét és a hibát keresztező szálat, amelyet a 2D kép nem jól lát.
A Sinus venosus ASD-t alkalmanként először diagnosztizálják a CMR jelenlétében a PH értékelésére (5,6). Azokban az esetekben, amelyek felvetik a PH gyanúját, akár az echokardiográfián, akár klinikailag, a jobb szív katéterezésére van szükség a további kezelés és a hiba lezárási szándékának irányításához, adott esetben (7,8). Ha a pulmonalis artériás hipertónia (PAH) megállapításra kerül, a betegek már nem lehetnek alkalmasak a defektus lezárására, ezért a megbeszélések során meghatározott alternatív kezelési vonalat kell követniük (9,10).
Az ASD típusai
Anatómiailag az „igazi” pitvari septum a fossa ovalis, amely a foramen ovale-t takarja, míg a pitvarokat elválasztó fennmaradó szövet a pitvarfal behajtásából áll. Bármely szinten fennálló tartós hiba, a fossa ovalisban vagy a fennmaradó pitvarfalak mentén, ASD néven ismert, és közvetlen kommunikációt eredményez a két pitvari kamra között, amely lehetővé teszi a vér tolását mindkét irányban, vagy akár kétirányban is körülmények (11).
Az élet embriológiai szakaszában a fossa ovalis és ezáltal a pitvari elválás körülbelül a terhesség ötödik hetében kezdődik. Két szeptum vesz részt a nyílás pitvari szinten történő lezárásában. Először is, a septum primum a közös pitvar felső részéből származik, és caudalisan növekszik, végül lezárja az pitvarok közötti „ostium primum” nyílást. Másodszor, a septum secundum, amely a septum primum jobb pitvari oldalából származik, kifejleszti és lefedi a második nyílást, az ostium secundumot. A fossa ovalis hibáit secundum típusú ASD-ként osztályozzák. Ezek a hibák az összes ASD több mint 70% -át teszik ki. Nagyobb secundum típusú ASD-k fordulhatnak elő, amelyek a fossa ovalis peremén túl, a pitvari falakig, az alsó vagy felső vena cava (SVC) felé nyúlnak. A secundum típusú ASD-k többsége izolált és ritkán társul rendellenes tüdővénás kapcsolatokkal (12).
Az intrauterin fejlődés során a septum secundum nem fedi le teljesen az pitvarokat, így a foramen ovale szabadalom marad, és csak a bal oldalon takarja el a septum primum. Születéskor, amikor a tüdő kitágul, csökkentve a pulmonalis vaszkuláris ellenállást (PVR), a szisztémás vaszkuláris ellenállás későbbi emelkedése következik be, ami pitvari szinten a gradiens megfordulását eredményezi, és így a septum primum a septum secundummal szemben tartva következetesen záródik a pitvari sönt. Ha ez a folyamat nem születéskor következik be, az eredmény egy szabadalmi foramen ovale (PFO), amelynek becsült előfordulási gyakorisága felnőtteknél 25-30%. A legtöbb beteg tünetmentes, bár a potenciálisan PFO-k különféle klinikai megnyilvánulásokban vehetnek részt, legfőképpen a kriptogén stroke-ok (13).
A maximális ASD-k akkor alakulnak ki, amikor a prual septum, amikor a farkában növekszik, nem tud összeolvadni a pitvarok és a kamrák között elhelyezkedő endokardiális párnákkal. Ennek eredménye a pitvari septum tövében fellépő hiba, amely általában nagy. Általánosan elfogadott tény, hogy ez a típusú elváltozás az atrioventrikuláris szeptálhiba (AVSD) része, szinte mindig az atrioventrikuláris szelepek rendellenességeivel társul, és hozzájárul vagy részleges (csak pitvari komponens), vagy teljes (pitvari és kamrai komponens) kialakulásához. AVSD. Ez a fajta hiba az ASD-k körülbelül 15-20% -át teszi ki, és kedvezőtlenebb hosszú távú kimenetelű, mint a secundum típusú ASD-k (11).
A pitvarfal mentén, de a fossa ovalis peremén kívüli hibák is előfordulhatnak. A sinus venosus típusú ASD, alsóbbrendű vagy felsőbbrendű, akkor fordul elő, ha a pitvarfal behelyezése meghiúsul közvetlenül az SVC vagy az alsó (IVC) vena cava nyílása alatt. Ezek a hibák a pitvari kommunikáció 5–10% -át teszik ki, és szinte mindig részleges anomális tüdővénás kapcsolattal társulnak. Az alacsonyabb sinus venosus hibák ritkábbak a felsőbbrendűeknél, és valószínűleg jobb-bal bal tolatással és cianózissal társulnak, mint az előbbi.
A sinus venosus hibái anomáliás pulmonalis vénás visszatéréssel vannak összefüggésben az SVC-vel felsőbb sinus venosus hiba esetén, és az IVC-vel alacsonyabb sinus venosus hiba esetén.
A koszorúér a szív vénás elvezetésének terminális edénye, amely a bal pitvar és a kamra között helyezkedik el hátul, a jobb pitvarba ereszkedik. A szívkoszorúér-hiba, más néven tető nélküli koszorúér-sinus akkor fordul elő, ha a koszorúér-sinus és a bal pitvar között nincs egy vagy több közös fal. Ez a hiba ritka, és az ASD-k kevesebb mint 1% -át teszi ki. Gyakran jár együtt tartósan baloldali felső vena cava-val vagy komplex veleszületett szívhibákkal (15).
A veleszületett szívbetegséghez (CHD) kapcsolódó PH
A PH egy klinikai rendellenesség, amelyet kiterjedt heterogén patofiziológiai kiváltó tényezők indítanak el, ami a pulmonalis artériás nyomás, a PVR, az ezt követő jobb szívelégtelenség és az idő előtti halál növekedését eredményezi (16.
A PH hemodinamikai meghatározása a pulmonális artériás nyomás (mPAP) értéke ≥25 Hgmm nyugalmi állapotban a jobb szív katéterezésével. Pontosabban, a PAH meghatározása, amely a betegek kis hányadát írja le, akiknél hemodinamikai bizonyíték van a pre-kapilláris PH-ról, és akiknek az ≥ 25 Hgmm mPAP mellett további követelmény a pulmonalis kapilláris éknyomás (PCWP) ≤15 Hgmm. és a PVR> 3 faegységből áll (8).
A CHD-hez kapcsolódó PAH előfordulása földrajzilag változó, de a nyilvántartások konszenzusa globálisan úgy becsüli, hogy a CHD-ben szenvedő felnőttek legfeljebb 10% -ánál alakul ki PAH (17–19).
A CHD patofiziológiája a progresszív vaszkuláris remodeláció eredményeként jön létre, számos mechanizmussal, a mögöttes elváltozás függvényében. A PAH-CHD-ben ez gyakran annak a hibának köszönhető, hogy a bal-jobb sönt elég nagy ahhoz, hogy lehetővé tegye a kellően megnövekedett pulmonális véráramlást egy olyan kóros mechanizmus kiváltásához, amelyben fokozott nyíróstressz, endotheliális diszfunkció, simaizom hipertrófia, proliferáció és a pulmonalis érrendszer progresszív torzulása, ezáltal hozzájárulva a PAH kialakulásához (2. ábra). A betegség előrehaladtával ennek következtében emelkedik a PVR, és ha a jobb szív katéterezésénél ez kielégíti a PAH hemodinamikai definícióját, akkor a betegség kialakul és visszafordíthatatlan, a legtöbb esetben (8).
Szemlélteti a simaizom hipertrófia és proliferáció mikrostrukturális változásait, amelyek a tüdő érbetegségének kialakulásában szerepet játszanak. (A) A tüdő artéria normális anatómiáját mutatja be a tüdő parenchymába ágyazva. (B) Ezzel szemben demonstrálja a hipertrófiát és a fibrózist, ami érszűkületet eredményez.
Ennek a szélsősége az, amikor egy jelentős balról jobbra tartó sönt tovább emeli a PVR-t, hogy elérje a szisztémás szinteket; a sönt ezután jobbról balra vagy kétirányú állapotba tér vissza, ami klinikai cianózishoz és az Eisenmenger-szindróma (ES) kialakulásához vezet. Jelenleg az ES előfordulása 25-50% között mozog a PAH-CHD kohorszon belül (18,20,21). Fontos, hogy az antenatális ellátás és a magzati szűrés előrehaladtával egyre több gyermek születik olyan felkészült környezetbe, amely lehetővé teszi a műtéti beavatkozás optimális időzítését, vagy diagnosztizálják őket az újszülöttek rutinszűrésén. Következésképpen a pulmonalis érrendszer védett az ES kialakulásától, és a prevalencia csökken (16).
A PAH-CHD osztályozása
A PH osztályozását először 1998-ban fejlesztették ki, és csoportosította azokat a csoportokat, amelyek hasonló kóros, hemodinamikai jellemzőkkel és az azt követő terápiás megközelítésekkel rendelkeznek. A jelenlegi osztályozási rendszert az Egészségügyi Világszervezet (WHO) ötödik, 2013-as ülésén véglegesítették, és öt csoportból áll. Az 1. csoportot egyértelműen PAH-nak nevezik. A PAH-CHD az 1. csoportba tartozik, megosztva az idiopátiás PAH-hoz, az öröklődő PAH-hoz, az egyéb patológiákkal, például a kötőszöveti megbetegedésekhez, a fertőzésekhez és a gyógyszerek által kiváltott PAH-hoz hasonló hemodinamikai jellemzőket (22). Ezenkívül a PAH-CHD-t további két osztályozási rendszer írja le, az egyik egy klinikai osztályozási rendszer, a másik az anatómiai-patofiziológiai rendszer (1. táblázat).
Asztal 1
| (I) Klinikai osztályozás |
| A csoport |
| Eisenmenger szindróma |
| B csoport |
| Szisztémás-tüdő sönt |
| C csoport |
| PAH kis hibával |
| ASD 1.5), akkor a PVR 2) a sönt bezárásának biztonságos határának tekinthető. Ha a PVR> 4,6 WU (PVRi> 8 WU/m 2), a zárás nem ajánlott. Azok azonban, akiknél a PVR 2,3–4,6 WU (PVRi 4–8 WU/m 2) között van, kevésbé egyértelműek. A mérlegelést eseti alapon kell elvégezni. Időnként figyelembe kell venni, hogy egyetlen beavatkozás sem jobb a beteg számára annak ellenére, hogy fokozza annak kockázatát, hogy a sönt időben jobbra-balra irányba fordítsa, és lehetővé teszi az ES kialakulását, bár jelentős morbiditással és szövődményekkel jár. krónikus cianotikus állapot, mivel ennek jobb a hosszú távú prognózisa, mint a sönt potenciálisan téves lezárása és az ASD „tehermentesítő szelep” funkciójának feláldozása (24). Egyes stratégiák részleges műtéti zárást, vagy fenestrált vagy szelepes perkután zárást javasolnak, amely lehetővé teszi a tehermentesítést/a jobb pitvari dekompressziót a PVR utáni javulás utáni túlzott emelkedése esetén (3. ábra) (28, 29). |
2D és 3D transzoesophagealis (A, B, C, D) echokardiográfiai képek és 2D transthoracikus négy kamrás képek (E, F) az előtti (A, C, E) és a poszt (B, D, F) ASD lezárásáról fenestrált eszközzel (B, D, F) pulmonalis magas vérnyomásban (A; Doppler szignál beillesztése) és bal kamrai betegségben szenvedő betegeknél. Az ASD záródása utáni jobb kamrai dilatáció javulása látható (F). ASD, pitvari septum hiba.
Megkísérelték a „kezelés és helyreállítás” stratégiát, amelynek során a betegeket pulmonalis értágítókkal kezelik, majd a kezelés után bizonyos időközönként shunt-lezárásnak vetik alá őket (30). A stratégiáról azonban viszonylag kevés adat áll rendelkezésre azokra a betegekre, akik határ menti PVR-ben szenvednek, vagy kedvező redukciókat értek a vazoreaktivitás vizsgálatával. Eddig az adatok esettanulmányokra vagy esetsorokra korlátozódnak, ezért nem áll rendelkezésre egyértelmű konszenzus az irányító orvosok számára (31).
Nem szívbetegségek és kezelése
A PAH-ban szenvedő ASD-ben szenvedő betegek klinikai lefolyása és komplikációinak sorozata változó, és függ a tartós hibák nagyságától, a javulás állapotától és a tolatás mértékétől. A legszélsőségesebb forma az ES, amelyet a többrendszeres részvétel jellemez, amelyet a krónikus hipoxémia vált ki (32). A betegek a tünetek széles spektrumát tapasztalják, különösen az ES-ben szenvedőket, amelyek közé tartozik a nehézlégzés, fáradtság, szédülés és fejfájás. ES-ben szenvedő betegek morbiditása magasabb az általános populációhoz és a nem cianotikus CHD-ben szenvedőkhöz képest, bár a túlélési arányuk hosszabb, mint a PAH-CHD egyéb formáiban (19,33).
Specifikus szövődmények és megfontolások sora jellemző az ES-ben szenvedő betegekre. Ezek mind a szívből, mind a nem szívből eredő szövődményekből állnak. Habár az ES-ben szenvedő betegek életük hatodik évtizedéig is túlélhetnek, krónikus hipoxémiájukhoz kapcsolódóan magas morbiditás és komplexitás terheli őket.
Következtetések
Az ASD-k ritkábban társulnak jelentős PH-val. Az ASD bezárására való alkalmasság, amikor a PVR 2,3 és 4,6 WU között van (PVRi 4–8 WU/m 2), nem egyértelmű, és a klinikai döntéshozatal egyénre szabott. A megfontolások magukban foglalják, hogy beavatkozunk-e a hiba teljes lezárásakor, a fenestrated bezárás vagy a „kezelés és javítás” stratégia vitatható-e. Ha a PH jelentős egy kis ASD ellenére, vagy az ASD időben történő javítását követően, véletlenszerűnek tekinthető. A kicsi/kijavított ASD-vel rendelkező PH prognózisa rosszabb, mint a javítatlan ASD. Az ES ritkán kapcsolódik ASD-hez, és ha jelen van, akkor a prognózis kedvezőtlenebbé válik a poszt-tricuspidás elváltozásokhoz képest. Összességében az ASD-vel társuló PAH magas morbiditással és mortalitással jár; a betegeket szorosan figyelemmel kell kísérni a speciális tercier központokban, egy multidiszciplináris csoportos megközelítéssel az optimális eredmények elérése érdekében.
Köszönetnyilvánítás
Finanszírozás: SV Babu-Narayant a British Heart Foundation támogatja (FS/11/38/28864).
- 5 dolog, amit most ismerünk a pulmonalis artériás magas vérnyomásról Johnson; Johnson
- Pitvari szeptálhiba (ASD) kezelése és kezelése Cleveland Clinic
- A pitvari septum defektusai, tünetei, diagnózisa, kezelése
- 7 pulmonalis hipertónia kockázati tényezői pulmonalis hypertonia hírek
- A pitvari septum hibája - amit tudnia kell