A prenatális dexametazon és a posztnatális magas zsírtartalmú étrend által programozott elhízás a táplálkozás-szenzoros szignálok és a cirkadián-óra gének egyértelmű megváltozásához vezet a zsigeri zsírszövetben
Absztrakt
Háttér
Kimutatták, hogy a prenatális dexametazon-kezelés fokozza az utódok fogékonyságát a posztnatális, magas zsírtartalmú (HF) étrend által kiváltott programozott elhízásra. Vizsgáltuk a metabolikus fenotípusokat, a tápanyag-érzékelő szignál és a cirkadián-óra géneket a zsírszövetben, amelyeket a prenatális dexametazon expozíció és a postnatalis HF diéta programoz.
Mód
Sprague-Dawley patkányok hím utódait négy kísérleti csoportba osztották: normál étrend, prenatális dexametazon expozíció, posztnatális HF étrend, prenatalis dexametazon és posztnatális HF étrend. A születés utáni HF étrendet elválasztástól 6 hónapos korig írták elő.
Eredmények
A prenatális dexametazon és a posztnatális HF étrend szinergikus hatást gyakorolt a testtömegre és a zsigeri zsírosságra, míg a prenatális dexametazon és a posztnatális HF diéta megváltoztatta az anyagcsere profilját és a leptin diszregulációját okozta. A prenatális dexametazon és a posztnatális HF-diéta egyértelműen befolyásolta a tápanyag-érzékelő molekulákat és a cirkadián-óra géneket a zsírszövetben. Az mTOR, az AMPK-α2, a PPAR-α és a PPAR-γ mRNS-expresszióját prenatális dexametazon elnyomta, de posztnatális HF-diéta fokozta.
Következtetés
A prenatális dexametazon és a posztnatális HF kezelés a tápanyag-érzékelő molekulák és a cirkadián-óra gének diszregulációját okozza a zsigeri zsírszövetben. A megváltozott tápanyag-érzékelő molekulák és a cirkadián óra gének jellemzése potenciális terápiás jelentőséggel bír a prenatális stressz és a postnatalis HF étrenddel összefüggő anyagcserezavarok patogenezisében és kezelésében.
Háttér
Az elhízás egyre nagyobb egészségügyi probléma a világon. Mivel a populáció genetikai változékonysága nem változik gyorsan, az életmód változásai valószínűleg felelősek e növekedésért. Az életmód változásai magukban foglalják a magas zsírtartalmú étrendet, a csökkent fizikai aktivitást, a napi teljes alvásidő csökkentését, az éjszakai fokozott fényes fénynek való kitettséget és az éjszakai táplálkozást [1]. A legújabb tanulmányok kimutatták a kapcsolatot a magzati fejlődés során kialakuló prenatális inzultus és az egész életen át tartó krónikus betegségek, például az elhízás és más anyagcserezavarok között fennálló megnövekedett kockázat között [2]. Az anyák elhízását és a túlzott terhességi súlygyarapodást szintén meghatározták olyan tényezőként, amelyek hozzájárulnak az utódok fokozott elhízásához [3].
Az emberi terhesség alatt gyakran előírják a glükokortikoid (GC) kezelést, amikor koraszülés várható. [4] A prenatális stressz során azonban túlzott GC-expozíciót figyeltek meg, ami a későbbi életben metabolikus szindróma és magas vérnyomás fejlődési programozásához vezethet [5,6,7]. Felmerült, hogy az anyai GC túlzott magzati kitettsége miatt a stresszes patkánygátak utódai hajlamosabbak voltak a HF étrend okozta elhízásra [8]. Korábbi tanulmányaink is alátámasztották ezt a megfigyelést. Megállapítottuk, hogy a prenatális dexametazon kezelés fokozza az utódok fogékonyságát a posztnatális HF étrend által kiváltott programozott elhízásra, inzulin diszregulációra és magas vérnyomásra [6, 9, 10].
A zsírszövet feleslege az elhízás jellemzője. Az újabb bizonyítékok azt mutatják, hogy a zsírszövet aktív metabolikus szövet, amely számos fontos fiziológiai funkcióval rendelkező adipokint termel [11]. Megállapították, hogy a leptinnek fontos szerepe van az anyagcsere szabályozásában, mivel stimulálja az energiafelhasználást, csökkenti az étvágyat és javítja a glükóz homeosztázisát. A leptinrezisztencia elhízás esetén gyakran kialakul, ami korlátozza biológiai hatását [12]. Ezzel szemben az adiponektin javíthatja az inzulinérzékenységet, fokozhatja a zsírsav oxidációt és az energiafelhasználást [12], és szekréciója elhízás esetén gyakran csökken.
Az életben elengedhetetlen a környezeti tápanyagok szintjének ingadozásának észlelése és reagálása. A tápanyaghiány egy szelektív stressz, amely a legtöbb sejtes folyamat evolúcióját alakította. A tápanyag-érzékelő kaszkádokon keresztül a sejtek integrálják és összehangolják az intracelluláris és az extracelluláris táplálkozást. Élelmiszerben gazdag állapotban a tápanyag-érzékelési útvonal elősegíti az anabolizmust és a tápanyagok tárolását [13]. A kevés tápanyag katabolikus folyamatokat indít el, mint például az autofágia, a homeosztázis fenntartása érdekében. A tápanyag-érzékelő utak gyakran nem szabályozottak metabolikus betegségekben szenvedő embereknél [13].
A cirkadián ritmusok és az anyagcsere közötti molekuláris kapcsolatot közelmúltban ismertették [14,15,16]. Az egyik legvonzóbb szempont a tápanyag-érzékelési útvonalak és a cirkadián óra közötti kölcsönhatás. A cirkadián rendszer alkalmazkodik a környezeti változásokhoz a fiziológiai válasz optimalizálása érdekében. Az elülső hipotalamusz suprachiasmatikus magjai által elsajátított és a 24 órás fény/sötét ciklushoz szinkronizált központi órán kívül perifériás órák vannak a test szöveteiben [15]. A központi órával ellentétben az etetési/koplalási ciklusok a perifériás szövetek óráinak elsődleges célja. A perifériás szövet órái érzékenyek az elfogyasztott ételek összetételére és időzítésére. A cirkadián ritmus szabályozása és a nem megfelelő táplálkozás szorosan összefügg, és úgy gondolják, hogy hozzájárulnak bizonyos krónikus betegségek kialakulásához [15].
Jelenleg a zsírszövetet is javasolják a fejlesztési programozás fontos célpontjának [17]. A zsírszövet diszfunkciója szorosan összefügg az elhízással és a vele kapcsolatos rendellenességekkel. Ezért a zsírszövet patológiájának megértése nagy jelentőséggel bír az elhízással kapcsolatos rendellenességek megelőzésére és kezelésére szolgáló potenciális terápiás célok azonosításában. Jelen tanulmány célja a metabolikus fenotípusok, a tápanyag-érzékelő jel és a cirkadián-óra gének vizsgálata a zsírszövetben, amelyeket a prenatális dexametazon expozíció és a posztnatális HF diéta programoz.
Anyagok és metódusok
Állatok
Testtömeg és vérnyomásmérés
Az utódok testtömegét (BW) minden hónapban mértük, amíg el nem érték 6 hónapos korukat. A vérnyomást tudatos, 6 hónapos patkányokban mértük indirekt farok-mandzsetta módszerrel (BP-2000; Visitech Systems, Inc., Apex, NC) [6, 18].
Intraperitoneális glükóz tolerancia teszt
Az intraperitoneális glükóz tolerancia teszthez a vérmintákat 8 órás éhezés után öt időpontban gyűjtöttük: glükóz (2 g/kg) intraperitoneális injekció előtt és 15, 30, 60 és 120 perccel. A plazma glükózszintjét enzimatikus (hexokináz) módszerrel határoztuk meg [19].
Kísérleti eljárások és mintagyűjtés
A patkány utódokat 6 hónapos korban feláldoztuk xilazin és ketamin alkalmazásával [6]. Az eutanázia során heparinizált vérmintákat vettünk. Retroperitonealis zsírt gyűjtöttünk össze, és további vizsgálatokhoz használtuk fel [6].
A plazma metabolikus paramétereinek meghatározása
A plazma metabolikus paraméterei, beleértve a triglicerid, koleszterin, aszpartát-transzamináz (AST), alanin-transzamináz (ALT), lúgos foszfatáz (ALKP), vaszkuláris endotheliális növekedési faktor (VEGF), tumor nekrózis-α (TNF-α) szintjét (K + F) A Systems, Minneapolis, MN) és a leptint (Biovendor RD291001200R, Brno, Csehország) enzimhez kapcsolt immunszorbens vizsgálatokkal határoztuk meg a gyártó utasításai szerint.
Western blottolás
A retroperitonealis zsírszövetmintát (50 mg) 500 μl PRO-PREP protein extrakciós oldattal (# 17081, iNtRon biotechnology, Korea) homogenizáltuk. A sejteket jégen 30 percig inkubálva lizáltuk, majd 14 000x-n centrifugáltukg 20 percig 4 ° C-on. A fehérjekoncentrációkat Bio-Rad Protein Assay kit (Bio-Rad, Hercules, CA) alkalmazásával határoztuk meg. A fehérjemintákat (100 μg) 5 percig gélbetöltő pufferrel forraljuk, 10% SDS-PAGE-nak vetjük alá, majd polivinilidén-fluorid membránra visszük (Roche Applied Sciences, Basel, Svájc). A membránt 5% sovány tejet tartalmazó PBS-Tween-el blokkoltuk, majd 2 órán át inkubáltuk 1: 200 arányban hígított SIRT-1 anti-patkány SIRT-1 antitesttel (# ab110304, Abcam, Cambridge, MA) vagy GAPDH-val (Santa Cruz). 1% sovány tejet tartalmazó TBS. Ezután a membránokat ötször mostuk 0,1% T-TBS-sel, 1 órán át inkubáltuk peroxidázzal jelzett másodlagos antitesttel, 1: 1000 arányban T-TBS-ben hígítva, T-TBS-sel leöblítettük, majd Chemi Doc (Bio- rad Image Lab 5.0).
Kvantitatív reverz transzkripció-polimeráz láncreakció (qRT-PCR)
statisztikai elemzések
A prenatális dexametazon és a posztnatális HF étrend hatásait 6 hónapos patkány utódokban kétirányú ANOVA-val értékelték Tukey-féle poszt-hoc tesztelje, hogy az interakció szignifikáns-e az első négy csoportban. Minden tesztben, P
Eredmények
A prenatális dexametazon és a postnatalis HF-diéta különböző metabolikus megnyilvánulásokhoz vezet
Amint az 1. táblázat mutatja, a BW szignifikánsan magasabb volt a DHF csoportban, mint a VEH, DEX és VHF csoportokban. Kétirányú ANOVA segítségével megmutattuk, hogy a prenatális dexametazon-kezelés (1. hit) és a posztnatális HF-diéta (2. hit) jelentősen megnövelte a testtömeg-arányt. Sőt, mindkét kezelés szignifikáns interaktív hatást mutatott a BW-re (P = 0,048). A retroperitonealis zsírtömeg szintén szignifikánsan nagyobb volt a DHF csoportban, mint a VEH, DEX és VHF csoportokban (o 1. táblázat Testtömeg/zsírszövet tömeg, biokémia és egyéb biomarkerek
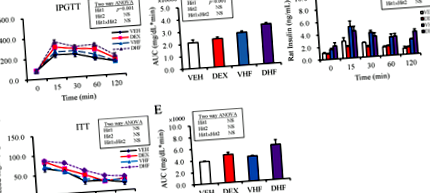
Az intraperitoneális glükóz tolerancia teszt eredményei azt mutatták, hogy a prenatális dexametazon kezelés szignifikáns hatást mutatott, míg a posztnatális HF étrend nem mutatott hatást a glükóz AUC-ra; a kezelések között nem volt interakció (1a., b. ábra). Kétirányú ANOVA segítségével megmutattuk, hogy a posztnatális HF diéta jelentős hatást fejtett ki (2. hit, o 1. ábra
A prenatális dexametazon és a posztnatális HF étrend krónikus gyulladást és leptin diszregulációt vált ki
A DHF csoportba tartozó állatok AST- és ALT-szintje magasabb volt, mint a másik három csoportéban, de a különbség statisztikailag nem volt szignifikáns (1. táblázat). Kétirányú ANOVA segítségével megmutattuk, hogy a prenatális dexametazon kezelés (1. hit) nem mutatott hatást, míg a posztnatális HF diéta pozitív hatással volt az AST és az ALT szintre (2. hit, o 2. ábra
A prenatális dexametazon és a postnatalis HF-diéta különféle hatásokat mutat a tápanyag-érzékelési útvonalon a retroperitoneális zsírszövetben
Tápanyag-érzékelő jeleket figyeltek meg a retroperitoneális zsírszövetben a prenatalis dexametazon kezelés és a postnatalis HF diéta programozási hatásainak vizsgálatára.
A Sirtuin 1 (SIRT1) az energia homeosztázis fontos szabályozója a tápanyagok elérhetőségére reagálva. Szabályozza a lipid homeosztázist és az inzulinrezisztenciát a peroxiszóma proliferátorok által aktivált α (PPARα)/PGC1-α és a GLUT4 receptor szabályozásával [20, 21]. A Western blotting elemzés eredményei azt mutatták, hogy a SIRT1 fehérje bőségét csökkentette a posztnatális HF diéta expozíció (3. ábra). A tápanyag-érzékelő szignál gyors dinamikus változásához más tápanyag-érzékelő molekulák mRNS-expresszióját vizsgálták. Amint a 4. ábrán látható, kétirányú ANOVA-val feltártuk, hogy a PGC1-α mRNS-expressziója a retroperitoneális zsírszövetben a postnatalis HF-diétával csökkent (Hit 2, o 3. ábra
A SIRT1 Western blot-analízisének eredményei a négy kísérleti csoportban. A SIRT1 bőséget a ponceau S bőséggel végzett normalizálás után mutatjuk be. A SIRT1 fehérje bőségét csökkentette a posztnatális magas zsírtartalmú étrend-kitettség. VEH, normál étrend; DEX, prenatális dexametazon expozíció; VHF, posztnatális HF diéta; DHF, prenatális dexametazon plusz postnatalis HF étrend
A prenatális dexametazon és a posztnatális HF-étrend deszinkronizációt vált ki a cirkadián óra gének expressziójában
A legújabb tanulmányok feltárták a kapcsolatot a zsírszövetben lévő óra gének deszinkronizálása és az elhízás kialakulása között [22, 23]. Így a prenatális dexametazon és a posztnatális HF diéta hatásait a cirkadián ritmussal összefüggő gének mRNS expressziójára tovább teszteltük. A Bmal-1 mRNS expresszióját a prenatális DEX kezelés befolyásolta, a posztnatális HF étrend azonban nem (5a. Ábra). Az 1. és a 2. találat sem befolyásolta szignifikánsan a Per1 és a Per2 mRNS-expresszióját a retroperitoneális zsírszövetben (5b. És c. Ábra). A prenatális dexametazon-kezelés csökkentette a Cry1 és Cry2 mRNS-expresszióját, míg a posztnatális HF-diéta növelte a Cry1 és Cry2 mRNS-expresszióját a retroperitoneális zsírszövetben a két kezelés közötti interakció nélkül (5d. És e. Ábra). Hasonlóképpen, a CLOCK és a CKle mRNS-expressziója csökkent a prenatális dexametazon kezeléssel, de a posztnatális HF-diétával megnövekedett, anélkül, hogy az 1. és a 2. találat között jelentős kölcsönhatás lépett volna fel (5f. És g. Ábra). A Rev-erbα mRNS expresszióját a retroperitoneális zsírszövetben a posztnatális HF diéta fokozta (Hit 2, o = 0,002), de nem prenatális DEX kezeléssel, és az 1. és a 2. találat közötti jelentős kölcsönhatás nélkül (5. h ábra).
Vita
Ebben a tanulmányban állatmodellt alkalmaztunk a prenatális dexametazon (1. hit) és a postnatalis HF-diéta (2. hit) hatásainak metabolikus megnyilvánulásokra történő vizsgálatára. A prenatális dexametazon kezelést prenatális stressz modellként alkalmazták, mert a magzat a prenatális stressz alatt gyakran túlzottan ki van téve glükokortikoidnak [24, 25]. Kimutatták, hogy a prenatális dexametazon-kezelés fokozza az utódok érzékenységét a posztnatális HF-diéta által kiváltott programozott elhízásra, inzulin-diszregulációra és magas vérnyomásra [6, 9, 10]. Itt foglalkoztunk tovább a tápanyag-érzékelő molekulák és a cirkadián-óra gének diszregulációjával a retroperitoneális zsírszövetben, amelyet a prenatalis dexametazon és a postnatalis HF kezelések indukáltak. Vizsgálatunk kimutatta, hogy a prenatális dexametazon és a posztnatális HF étrend szinergikus hatást mutatott a test és a zsigeri zsírosságra. Ezenkívül a prenatális dexametazon kezelés és a posztnatális HF diéta egyértelmű hatást mutatott a tápanyag-érzékelő molekulákra a retroperitoneális zsírszövetben. A prenatális dexametazon-kezelés és a posztnatális HF-diéta szintén megváltoztatta a cirkadián óra gének expresszióját a retroperitoneális zsírszövetben.
Úgy gondolják, hogy a krónikus gyulladás és az adipokin diszreguláció jellemzi az elhízást. Beszámoltak arról, hogy a zsírszövetben a TNFα koncentráció korrelál az elhízással és az inzulinrezisztenciával 2-es típusú cukorbetegségben és anélkül [26, 27]. A TNFα növelheti a szisztémás inzulinrezisztenciát azáltal, hogy elősegíti a zsírsavak felszabadulását a zsírszövetből a véráramba, hogy hatjanak a szövetekre, például izom- és májszövetekre. Így a TNFα lokálisan hathat a zsírszövetben, ami végső soron elősegíti az inzulinrezisztenciát a perifériás szövetekben [28]. Vizsgálatunk során azt tapasztaltuk, hogy a plazma TNFα szintjét a posztnatális HF expozíció növelte, de a prenatális dexametazon kezelés nem. Bár a prenatális dexametazon-kezelés nem növelte a plazma TNFα szintjét, csökkentette a TNF-R1 és a TNF-R2 mRNS-expresszióját a retroperitoneális zsírszövetben. Ez az eredmény arra utalt, hogy a prenatális dexametazon-kezelés TNFα-rezisztenciához vezethet a TNF-R gátlásán keresztül a helyi zsírszövetben.
Az emlősöknek cirkadián ritmusuk van, beleértve a cirkadián-óra gének halmazát, annak érdekében, hogy alkalmazkodjanak a környezeti rezgésekhez. A cirkadián ritmus mellett ezek a cirkadián órás gének fontos szerepet játszanak az energia homeosztázisában és az anyagcserében is [32]. Turek és mtsai. szemléltette azt a homozigótát Óra mutáns egereknél metabolikus szindróma alakulhat ki, amely hiperglikémiát, hipoinsulinémiát és máj steatózist mutat [23]. A cirkadián órát negatív visszacsatolású hurkok szabályozzák, amelyeket a CLOCK-BMAL1 heterodimer transzkripciós faktorok és azok transzkripciós célpontjai közvetítenek, beleértve a CLOCK-BMAL1 aktivitást közvetlenül elnyomó PER és CRY fehérjéket, valamint a REV-ERB és ROR nukleáris receptorokat, amelyek irányítják BMAL1 expresszió [35]. Vizsgálatunk során elemeztük a cirkadián órához kapcsolódó gének mRNS expresszióját, és megmutattuk, hogy a Bmal-1, cry1, cry2, Clock és CKle mRNS expresszióját befolyásolta a prenatális dexametazon kezelés. A cry1, cry2, Clock, CKle1 és Rev-erbα mRNS expresszióját a posztnatális HF diéta befolyásolta. Így a prenatális dexametazon kezelés és a postnatalis HF különböző hatásokat mutatott a cirkadián óra gének expressziójára.
A tápanyag-érzékelés és a cirkadián óra közötti kölcsönös kapcsolat megoldódott [14,15,16]. Például az AMPK kiválthatja a cirkadián óra PER/CRY foszforilációját és lebomlását [36]. A cirkadián óra szabályozhatja a tápanyag-érzékelő PPARαβγ-t, és az étrend által kiváltott elhízás előfordul a CLOCK domináns negatív mutáns egerekben [14]. A NAD +/SIRT-1 javasolt a cirkadián ritmus és a tápanyag-érzékelési út integrátoraként [14]. Vizsgálatok kimutatták, hogy a SIRT1 kölcsönhatásba lép a CLOCK-BMAL1-gyel, hogy közvetlenül szabályozza a cirkadián órával vezérelt gének expresszióját a PER2 és/vagy a BMAL1 dezacetilezésén keresztül [37, 38]. Ezzel szemben a NAD + mentést a CLOCK-BMAL1 szabályozhatja [39] is. Ezek az eredmények rávilágítanak a tápanyag-érzékelés és a cirkadián óra kölcsönös függőségére.
Következtetés
Összefoglalva, tanulmányunk kimutatta, hogy a prenatális dexametazon és a posztnatális HF-diéta által programozott elhízás a táplálkozás-szenzoros jelek és a cirkadián-óra gének egyértelmű változásához vezet a retroperitoneális zsírszövetben. Következésképpen a tápanyag-érzékelő molekulák és a cirkadián órás gének visszaállítása potenciális terápiás összefüggést mutat a prenatális stressz és a postnatalis HF étrenddel összefüggő anyagcserezavarok patogenezisében és kezelésében.
- Hasnyálmirigyrák gyógyszer, magas zsírtartalmú étrend, amely a májbetegség kockázatához kapcsolódik
- Az EDC-knek való kitettség és a magas zsírtartalmú étrend befolyásolja a társas viselkedést, Állatkísérletek -
- Háziállatok elhízásának hónapja - A kiegyensúlyozott étrend előnyei - Whiskas
- Elhízási konferenciák Súlykezelés Konferenciák Diéta menedzsment konferenciák Elhízás Konferencia
- Az elhízás olyan, mint a fulladás - Diet Diet