A Sjogren-szindróma és a lehetséges terápiás beavatkozások mikrobiómaváltásainak aktuális megismerése
Christina Tsigalou
1 Mikrobiológiai laboratórium, Orvosi Iskola, Tráki Demokritusz Egyetem, Alexandroupolis, Görögország
Elisavet Stavropoulou
2 Service Intermedicine Interneire, Centre Hospitalier Universitaire Vaudois (CHUV), Lausanne, Svájc
Eugenia Bezirtzoglou
3 Agrárfejlesztési Tanszék, Demokritosz Trák Egyetem, Orestiada, Görögország
Absztrakt
Kulcsüzenetek
A Sjogren-szindróma egy multifaktoriális, autoimmun betegség, amelyet még mindig nem diagnosztizálnak és nem kezelnek.
Minden kórélettani és etiológiai aspektusa nincs teljesen tisztázva.
A legújabb tanulmányok arra törekedtek, hogy megvizsgálják az emberi mikrobiómával való lehetséges kölcsönhatásokat a betegség valamennyi aspektusa tekintetében, felhasználva az egyéb autoimmun állapotokból származó alapvető információkat, nevezetesen az IBD-t, a T1DM-et stb.
Az SS-betegek diétás beavatkozásait és kiegészítéseit alaposan meg kell vizsgálni és meg kell kutatni az új terápiák és megelőzési intézkedések azonosítása érdekében a személyre szabott orvoslás összefüggésében.
Bevezetés
Számos kísérleti megközelítés igazolta, hogy összefüggés van a bél mikrobiota változásai és a betegség megnyilvánulásai, súlyossága és a kezelésre adott válaszkészség között. Például ma már ismert, hogy a szimbiontok alacsony relatív gazdagságával és a pathobiontok magas relatív gazdagságával járó béldiszbiózis rontja az SS-szerű betegséget egérmodellben, és korrelál az emberek SS-súlyosságával (6).
A mikrobiota elmozdulásának helyreállítását célzó beavatkozások, például étrend-kiegészítők segítségével, jelenleg mikroszkóp alatt vannak, hogy tisztázzák a klinikai állapotra gyakorolt hatásokat. A prebiotikumokat és a probiotikumokat a bél mikrobiota modulációjának modern stratégiájának tekintik, és ezúttal egy mini áttekintést nyújtunk be, amely az SS betegek mikrobiomjának változásaira, azok mikrobiom-gazda kölcsönhatásaira és az étrend manipulációját magában foglaló újszerű kezelésekre irányul a jövő személyre szabott orvostudománya felé.
Rövid összefoglalás az SS jelenlegi tanulmányában
A Sjogren-szindróma egy genetikai, környezeti és hormonális paramétereket magában foglaló heterogén és multifaktoriális betegség, amely bármely életkorban előfordulhat férfi és nő arányban 1:10 (2). Ha csak SS létezik, akkor elsődleges SS-nek nevezzük, hogy különbséget tegyünk a másodlagos SS helyzetétől, amikor egy másik autoimmun betegség létezik vagy létezik, nevezetesen szisztematikus lupus erythematosus vagy RA. A szövetek limfocita infiltrációjában az uralkodó jellegzetes alak, az esetek többségében a túlerőben lévő T-sejtek, más esetekben pedig a B-sejtek. Az oldalsó helyzet nyilvánvalóvá válik bizonyos autoantitestek jelenlétével, elsőként Ro/SSA és La/SSB, valamint második reumatoid faktor, anti-fodrin antitestek stb.
Annak ellenére, hogy az SS patofiziológiáját intenzíven tanulmányozták, még nem teljesen tisztázott. Megalapozott, hogy a genetikai hajlam és a különféle környezeti vagy hormonális tényezők hozzájárulhatnak és elősegíthetik a mirigy hámsejtjeinek deregulációját. Ezek a potenciális kiváltók adhéziós molekulák és kemokinek, például CD54/ICAM-1 és CD40 felszabadulásához vezetnek a hámsejtekből (7). Ezek a molekulák plazmakitoid dendritikus sejteket és T-limfocitákat toboroznak a mirigyekbe. A dendritikus sejtek nagy mennyiségű IFN-a-t szabadítanak fel, ami folytatja a T-limfociták, főként a CD4 +, toborzását és retencióját, ami a mirigyek mirigybe való beszivárgását eredményezi, ami az SS egyik kiemelkedő tényezője. Az aktivált T-sejtek különféle citokineket, nevezetesen IFN-y, IL-2, IL-6, IL-10 stb. Termelnek, amelyek korrelálnak az SS elváltozásaival (8).
Ugyanakkor az interferonok elősegítik a B-sejt aktiváló faktor (BAFF) szekrécióját az epitheliális, a dendritikus és a T-sejtekből. Bizonyos vizsgálatokban jól mutatja a BAFF SS-betegek szérumszintjének növekedését, amely korrelál a B-sejtek deregulációjával. Ennek a helyzetnek az eredményeként olyan autoantitestek vannak jelen, mint anti-SSA/Ro, anti-SSB/La stb. (9, 10). A kutatók szerint a genetikai hajlam a fő hisztokompatibilitási komplex II. Osztályú génrégiót vonja maga után, különösen a HLA-DR és a HLA-DQ allélokat. A kapcsolódó vizsgálatok többségét a veleszületett és adaptív immunitáshoz kapcsolódó fehérjék specifikus génjeinek szentelik, például a PT-PN22W variáns (11) vagy a TNFAIP3 variáns (12), amelyek az SS genetikai hátterét próbálják bizonyítani. Ezenkívül sok érdeklődés gyűlik össze a különböző epigenetikus tényezők iránt, mint például a miRNS, a hosszú, nem kódoló RNS és a DNS-metiláció (13–15).
Általánosan elfogadott, hogy a genetika a környezeti tényezőkkel, különösen a vírusokkal (krónikus hepatitis vírus, Epstein – Barr vírus, stb.) Együttesen provokálja a szürkehályog megindulását, amely gyulladáshoz és autoimmunitáshoz vezet mirigyes és extra mirigyes megnyilvánulásokkal (16).
A tünetek és a diagnózis tekintetében az SS által végzett legújabb kutatások a pSS különböző altípusainak megkülönböztetésére (17), a limfóma kialakulásának független rizikófaktorainak (pl. RF pozitivitás, Raynaud-jelenség) értékelésére (18), neurológiai és vesebetegségekre összpontosítanak. és társbetegségek (pl. szív- és érrendszeri rendellenességek, depresszió stb.) (17).
Ami a kezelési lehetőségeket illeti, az az igazság, hogy a tudósok a Hold sötét oldalán járnak. 2017 hajnalán Birt et al. egy populációalapú vizsgálatban, amely több mint 10 000 pSS-ben szenvedő beteget vont be, azt javasolta, hogy az első vonalbeli gyógyszerek a tünetek és az immunszuppresszívek, míg hiányoznak a biológiai terápiás előírások (19). Más vizsgálatok szerint a lehetséges terápiás beavatkozások közé tartoznak az anti-BAFF antitestek vagy a BAFF antagonisták (például Belimumab, Atacicept, Briobacept stb.). Ezenkívül az anti-CD20 és az anti-CD22 terápia eredményeként a B-sejtek kimerülnek, ami javítja az SS tüneteit (pl. Rituximab), a metotrexátot mint immunszuppresszív gyógyszert, valamint a közelmúltban interleukin célzott kezelést (pl. IL-6 tocilizumab) ( 16, 20–26). Sajnos mindezek a lehetőségek még mindig emberi kísérleteket igényelnek hatékonyságuk bizonyítására, különösen a pSS betegeknél.
Új színész a színpadon: Az emberi mikrobióm
Mindezek az interakciók kellően bonyolultak, és a nemekre jellemző mikrobiotával és annak kapcsolataival, valamint a kísérleti eredmények óvatos magyarázatával kapcsolatos jövőbeni kutatások valószínűleg megvilágítják az autoimmun állapotok sötét oldalait.
Kétirányú kapcsolat a mikrobióm és az SS között
Mindezek figyelembevételével több mint nyilvánvaló, hogy a felhalmozódó kutatások jelenleg az emberi mikrobiomnak a szisztémás autoimmun betegségekhez (SAD) való hozzájárulására összpontosítanak. A mikrobiom baktériumai kapcsolatba lépnek a nyálkahártya immunrendszerével, és különféle interakciók után diszbiózishoz vezethetnek, helyi gyulladással és a bélgát megszakadásával. Hályogként számos következmény fordulhat elő, például gyulladáscsökkentő citokinek a szisztémás keringésben, gyulladás távoli hatása, például ízületek, nagyobb antigén-expozíció az autoantitest-termelés növekedésével stb. Az SAD-ek multifaktoriális betegségek, amelyek genetikai hajlamot, környezeti tényezőket vonnak maguk után, hormonális hatások és rendezetlen immunrendszer (42).
Tanulmányok szerint a nyálkahártya T- és B-sejtjei jelentősen befolyásolják és elősegítik az immun homeosztázist, amely két különböző területen működik, kiaknázva az immunválaszt a jótékony mikrobákkal szemben, és fenntartva a bélsorompó teljességét (43). A mikrobiota közösségekből származó egyes baktériumok egyedülálló képességekkel rendelkeznek, hogy befolyásolják és elősegítsék bizonyos limfocita részhalmazok aktiválódását és polarizációját. Például egereken végzett kísérletek azt mutatták, hogy a T helper 17-et (Th17) a vékonybélben szegmentált filamentális baktériumok részesítik előnyben, ami autoimmun ízületi gyulladást eredményez (44, 45). De a Th17 sejtek funkcionalitása ugyanazon érmék két oldalát jelenítheti meg, amelyek vagy a fertőzés megelőzésével hatnak, vagy gyulladásgátló citokinek szekréciójával patogének lehetnek (46–49). A Th-differenciálás ezen eljárásának pontos mechanizmusa még mindig homályos.
Egy másik nagy számú limfocita szubpopuláció a T szabályozó (Treg) sejtek. A tregek felbecsülhetetlen értékűek abban, hogy hozzájárulnak az étrendből származó antigének és a bélmikrobák immun toleranciájához. A bél mikrobiotájának a Treg-ek indukciójára gyakorolt hatásának nagyságrendjével kapcsolatos vizsgálatok még gyerekcipőben járnak. Például a Treg-eket Clostridium fajok indukálják a belekben gyulladáscsökkentő hatással (50, 51).
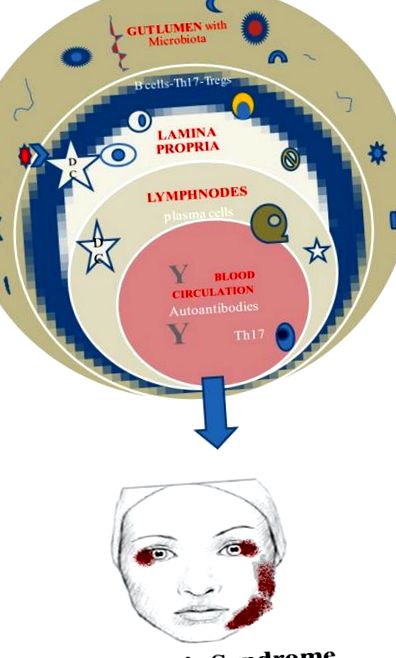
Végül, a mikrobiota e hasznos szerepének létfontosságú követelménye, hogy életében korán megteremtődjön. Ellenkező esetben az invariáns természetes gyilkos sejtek elterjedtsége és a Tregs szuppressziója egerekben a vastagbélgyulladáshoz és az asztmához kapcsolódik (52, 53) (ábra (1. ábra 1).
Mikrobiome és Sjogren-szindróma.
Általánosan elfogadott az autoreaktív B-sejtek és a Th17-sejtek patofiziológiai szerepe az SS-ben és az emberi mikrobiom közvetlen vagy közvetett implikációja.
Th17 sejtek vannak jelen SS betegek nyálmirigyében és a perifériás vérben is. Tehát szilárd hipotézis lehet, hogy ennek a populációnak a dysbiosis miatt bekövetkező növekedése a keringésbe kerül és az exokrin mirigyekbe jut. Sajnos még mindig nem világos, hogy a Th17 sejtek eredete a bél lamina propriája, és a bél immunitása a disztális helyeken (azaz a nyálmirigyekben) autoimmun eljárásokat vált ki (42).
Mikrobiómaváltások és jövőbeni étrendi beavatkozások az SS-ben
Összességében az összes fenti információ hangsúlyozta a dysbiosis elleni „harcot”, amely egyértelműen szerepet játszik az autoimmunitás kialakulásában és folytatásában. Az SS-re vonatkozó különféle tanulmányok közvetett bizonyítékokat mutattak be a szájüregi, a bőr és a bél mikrobiomjának elmozdulásában (58, 59), de nem közvetlen kapcsolat vezetett ahhoz a hipotézishez, hogy ha a mikrobiom valóban fontos szerepet játszik, akkor új kezelési módszerek, például diétás beavatkozások és “ funkcionális táplálék ”alternatívát kínálhat a hagyományos immunszuppresszív terápiákkal szemben. A diszbiózis, mint a mikrobiota rendellenes működésének feltétele, amely az immun- és metabolikus homeosztázis deregulációjához vezet, az alacsony fokú krónikus gyulladás hozzájárulhat vagy hajlamossá teheti a gyulladásos betegségek széles körét, például allergiát, asztmát, autoimmun betegségeket, elhízást és anyagcserezavarokat, kognitív és mentális egészségi zavarok stb. (60). A diszbiózis megcélzása a mikrobiom diéta okozta elmozdulásaival befolyásolhatja az autoimmunitás kialakulását. A zavart bél-gát működésképtelenségének kijavítására irányuló erőfeszítések általában a probiotikumok, a prebiotikumok, az élelmi rostok és a széklet mikrobiota transzplantációját foglalják magukban a betegségtől függően.
A probiotikumok élő mikroorganizmusok, amelyek megfelelő mennyiségben történő beadás esetén egészségügyi előnyökkel járnak a gazdaszervezet számára (61). A probiotikus mikroorganizmusok közé tartoznak elsősorban azok a baktériumok, amelyek tejsavat termelnek, mint Lactobacillus és Bifidobacterium nemzetségek (LAB). Használatuk elsősorban a mikrobiota egyensúlyhiányának helyreállítására különféle mechanizmusok révén, amelyek még mindig kutatások alatt állnak (62), bár rengeteg tanulmány bizonyítja az allergiás betegségekre (pl. Asztma és ekcéma), elhízásra, metabolikus szindrómára, emésztőrendszeri rendellenességekre gyakorolt jótékony hatást. stb. (60). A prebiotikumok nem emészthető fermentálható oligoszacharidok, amelyek megváltoztathatják a bélflóra összetételét és/vagy funkcionalitását, és hozzájárulhatnak a hasznos baktériumok, nevezetesen a Lactobacillusok és a Bifidobacteriumok növekedéséhez (36, 63, 64). Ugyanígy alkalmazták a pre- és probiotikumok (szimbiotikumok) kombinációját (65).
Valójában számos bizonyíték van arról, hogy vannak olyan baktériumok, amelyek befolyásolhatják a Treg sejtek indukcióját a bélben és megakadályozhatják a Th17 expanziót, mint például a Bacteroides fragilis és a Clostridium törzsek kísérleti vastagbélgyulladásban, T1DM és IBD-ben. Ezek az eredmények értékes tanulságok lehetnek az állatokkal és az emberekkel kapcsolatos jövőbeni vizsgálatok során az SS-vel és a mikrobiota alakításával az autoimmunitás elnyomására. Tekintettel a kedvezményezett baktériumok döntő szerepére, valamint a probiotikumok és prebiotikumok alkalmazásával történő lehetséges diétás beavatkozásokra, az SS-betegek enyhíthetik a betegség súlyosságát és előrejelzését. A kifejezetten erre az entitásra vonatkozó vizsgálatok, akár állat-, akár humán vizsgálatok, kevéssé mutatják a probléma nagyságát. Más autoimmun rendellenességek ismerete megkönnyítheti annak feltételezését, hogy a mikrobiom manipuláció enyhítheti a betegség terheit.
Következtetés
Szerző közreműködései
Az EB felügyelte a munkát. A CT felelős a laboratóriumi adatokért, a munka és a kézirat egy részéért. Az ES felelős a felülvizsgálat klinikai vonatkozásaiért.
Összeférhetetlenségi nyilatkozat
A szerzők kijelentik, hogy a kutatást bármilyen kereskedelmi vagy pénzügyi kapcsolat hiányában végezték, amely potenciális összeférhetetlenségként értelmezhető.
- Diétás tippek a Sjogren számára; s szindrómás betegek - Sjogren; s szindróma hírek
- Down-szindróma és táplálkozás NCHPAD - Egészséges befogadó közösségek kiépítése
- Down-szindróma, amely segíti gyermekét a Michigan Orvostudomány független étkezésében
- Gyakori terápiás étrend csalólap - orvosi e-tanulmány
- Gyakori terápiás étrend csalólap - orvosi e-tanulmány