A szénhidrát vagy fehérje zsírra cseréje javítja a lipiddel kapcsolatos kardiovaszkuláris kockázati profilt a túlsúlyos férfiaknál és nőknél, ha ad libitum fogyasztják őket
Mario Kratz
1 Fred Hutchinson Rákkutató Központ, Népegészségügyi Tudományok Osztálya, Rákmegelőzési Program, Seattle, WA
2 Washingtoni Egyetem, Orvostudományi Tanszék, Metabolizmus, Endokrinológia és Táplálkozás Osztály, Seattle, WA
David S. Weigle
2 Washingtoni Egyetem, Orvostudományi Tanszék, Metabolizmus, Endokrinológia és Táplálkozás Osztály, Seattle, WA
Patricia A. Breen
2 Washingtoni Egyetem, Orvostudományi Tanszék, Metabolizmus, Endokrinológia és Táplálkozás Osztály, Seattle, WA
Kaatje E. Meeuws
3 Oregoni Egészségügyi és Tudományegyetem, Súlyszabályozás Tanulmányozási Központ, Endokrinológiai, Diabétesz és Klinikai Táplálkozási Osztály, Portland, OR
Verna R. Burden
3 Oregoni Egészségügyi és Tudományegyetem, Súlyszabályozás Tanulmányozási Központ, Endokrinológiai, Diabétesz és Klinikai Táplálkozási Osztály, Portland, OR
Holly S. Callahan
4 Washingtoni Egyetem Általános Klinikai Kutatóközpont, Seattle, WA
Colleen C. Matthys
4 Washingtoni Egyetem Általános Klinikai Kutatóközpont, Seattle, WA
Jonathan Q. Purnell
3 Oregoni Egészségügyi és Tudományegyetem, Súlyszabályozás Tanulmányozási Központ, Endokrinológiai, Diabétesz és Klinikai Táplálkozási Osztály, Portland, OR
Absztrakt
Az alacsony zsírtartalmú étrendnek a plazma lipoprotein profilra gyakorolt hatása nem teljesen ismert. Két 16 hetes étrendi vizsgálatot hajtottunk végre, hogy összehasonlítsuk a mérsékelt zsírtartalmú (mod-FAT) étrend hatásait szénhidrátokban (magas CHO, n = 16) vagy fehérjében (magas zsírtartalmú) gazdag izokaloros és ad libitum alacsony zsírtartalmú étrenddel. PRO, n = 19) a plazma lipidjein, a poszt-heparin lipáz aktivitásokon, a koleszteril-észter transzfer fehérjén (CETP) és a foszfolipid transzfer fehérjén (PLTP). A mod-FAT-ról az izokaloros, magas CHO-tartalmú étrendre váltás csökkentette a plazma HDL-koleszterin-koncentrációját (p Kulcsszavak: Zsír, szénhidrát, fehérje, lipoproteinek, lipidek, szív- és érrendszeri betegségek
Bevezetés
Az LDL-koleszterin és a trigliceridek emelkedett plazmakoncentrációja és a HDL-koleszterin alacsony plazmakoncentrációja önmagában vagy kombinációban a koszorúér-betegség (CHD) megállapított kockázati tényezője (1-3). Az emelkedett plazma triglicerid és az alacsony HDL-koleszterin koncentráció gyakran társul a kisebb, sűrűbb LDL részecskék túlsúlyával, amelyekről újabban kimutatták, hogy szintén befolyásolják a CHD kockázatát (4). A HDL-részecskék között vannak olyan adatok, amelyek arra utalnak, hogy a HDL2 alacsony koncentrációja és a HDL3 magas koncentrációja hozzájárul a CHD kockázatához (5). Az LDL és a HDL összetételét megváltoztató fehérjék megemelkedett plazmaaktivitása, beleértve a koleszteril-észter transzfer fehérjét (CETP) és a foszfolipid transzfer fehérjét (PLTP), szintén összefüggésbe hozható az érelmeszesedéssel (6, 7).
A lipiddel összefüggő CHD kockázati tényezők közül sokat módosíthat a testtömeg és az étrend összetételének változása. A megnövekedett testtömeg és különösen a hasi elhízás a megemelkedett plazma triglicerid koncentrációval, alacsony HDL-koleszterinszinttel és kisebb, sűrűbb LDL részecskékkel jár (8). Az alacsony HDL-koleszterin-koncentrációkat részben a CETP megnövekedett plazmaaktivitásának köszönheti, amelyet elhízott egyéneknél írtak le (8). A súlycsökkenést követően mind a CETP, mind a PLTP plazmaaktivitása csökken, csökkent trigliceridkoncentrációkkal, valamint a HDL-koleszterin és az LDL részecskeméretének növekedésével együtt (8-10). Stabil testsúly esetén az étkezési zsír szénhidráttal történő helyettesítése növeli a plazma triglicerid koncentrációját, csökkenti a plazma HDL-koleszterin koncentrációját és csökkenti az LDL részecskeméretét (11-13). Az izokalorikus táplálás azonban nem tükrözi a szabad életkörülményeket, amelyekben a szénhidrátok zsírral történő helyettesítése az élelmiszer-bevitel spontán csökkenését és mérsékelt fogyást eredményez (14). Ennek a spontán fogyásnak az eredményeként a szénhidrátban gazdag étrendnek a lipidkoncentrációkra gyakorolt néhány kedvezőtlen következménye enyhülhet.
Kevés tanulmány vizsgálta az étrendi zsír fehérjével történő helyettesítésének hatását a plazma lipidkoncentrációira (11) és a lipoproteinek feldolgozásában szerepet játszó fehérjék aktivitására. Számos tanulmány nem tudta ellenőrizni az étkezési fehérje forrását (11) vagy a zsír- és szénhidrát-összetételbeli különbségeket (15, 16). Ezenkívül az étkezési zsír fehérjével való helyettesítése korábbi tanulmányokban gyakran nem sikerült kontrollálni az ad libitum etetés során fellépő fokozott jóllakottságot és fogyást.
Nemrégiben befejeztünk két diétás vizsgálatot, amelyek összehasonlították az étkezési zsírkorlátozás és az étrendi szénhidrát vagy fehérje növekedésének a súlyszabályozásban és a spontán fogyásban részt vevő hormonokra gyakorolt hatásait az ad libitum táplálás során (17, 18). Ezeknek a vizsgálatoknak a részeként a CHD lipiddel kapcsolatos rizikófaktorait is mértük, különös hangsúlyt fektetve a lipoprotein részfrakciókra és a lipoprotein részecske eloszlásában szerepet játszó fehérjék plazma aktivitására. Ezek a tanulmányok lehetővé tették számunkra az étrendi makrotápanyag-változások lipid-kimenetelre gyakorolt hatásainak számítását izokalorikus körülmények között, amikor a súlyváltozás nem zavaró tényező, valamint az étrend-változások és a fogyás ad libitum körülmények közötti lehetséges kombinált hatásait.
Anyagok és metódusok
Vizsgálati populáció
Két étrendi vizsgálatot végeztek együtt a washingtoni University of Washington (UW) és a Portland-i Oregon Health & Science University (OHSU) között. Az A vizsgálathoz (teljes leírás az alábbiakban) 18 egészséges felnőttet (2 férfit, 16 nőt) átlagosan 45 (28-63) éves életkorral és 27,1 (24,5-30,2) kg/m 2 testtömegindexsel vettek fel. újsághirdetés útján a környékükön. Ezek közül két alanyot kizártak az elemzésekből az ad libitum étrend be nem tartása miatt (17, 18). A B vizsgálat esetében (lásd még alább) külön 19 egészséges felnőtt csoportot (3 férfi, 16 nő), átlagos (tartományi) életkora 41 (27-62) év és testtömeg-indexe 26,2 (22,5-30,1) kg/m 2 -et újsághirdetés is beszervezte (17, 18). A beiratkozás előtt az alanyok tájékozott írásbeli hozzájárulást adtak. Valamennyi eljárást az UW és az OHSU intézményi felülvizsgálati testülete hagyta jóvá.
Tanulmányterv és étrend
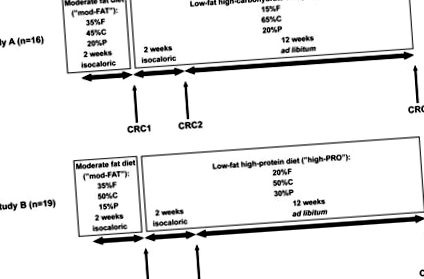
A két tanulmány megtervezése. Mindkét vizsgálatban az alanyok az első két hétben közepes zsírtartalmú diétát („mod-FAT”) fogyasztottak. Ez idő alatt a kalóriabevitelt úgy állították be, hogy a testtömeg a kiindulási érték 1 kg-ján belül maradjon. Ezen időszak 14. napján az alanyok a Klinikai Kutatóközpontba (CRC) érkeztek vérvételre. A CRC1-ből való kiürülést követően az alanyok az A vizsgálatban szénhidrátban gazdag étrendre („magas-CHO”), a B. vizsgálatban pedig fehérjében gazdag étrendre („magas-PRO”) váltottak. Az első két héten ezen diétákon, a kalóriabevitelt azon a szinten tartották, amely az előző szakaszban súlystabilitáshoz vezetett. Ezt az izokalorikus fázist ismét a CRC látogatása követte a vizsgálat 28. napján. A vizsgálatok utolsó 12 hetében az alanyok továbbra is fogyasztották ezeket a diétákat; most azonban több ételt kaptak, és szabadon választották a kalóriabevitelt (ad libitum). Az alanyok a 112. napon harmadik CRC látogatásukkal fejezték be a vizsgálatot. F = zsír, C = szénhidrát, P = fehérje.
Az étrend összetétele az energiafogyasztás% -ában kifejezve mindkét vizsgálat első két hetében 30-35% zsír-, 45-50% szénhidrát- és 15-20% fehérje volt, az összes kalóriát úgy állították be, hogy az alanyok súlya stabil maradjon (mod FAT diéta). Az A vizsgálatban az alanyok a kiindulási periódushoz képest 20% -kal kevesebb zsírt és 20% -kal több szénhidrátot fogyasztottak (magas CHO-tartalmú étrend) a második izokalorikus fázisban és az ad libitum fázisban. Ez a magas CHO-tartalmú étrend több rostot (3,3 vs. 2,2 g/MJ) és kevesebb koleszterint (17 vs. 27 mg/MJ) tartalmazott, mint az alap diéta. A B vizsgálatban az alanyok 15% -kal kevesebb zsírt és 15% -kal több fehérjét fogyasztottak (magas PRO-tartalmú étrend) a második izokalorikus fázisban és az ad libitum fázisban az alapszakaszhoz képest. Ez a magas PRO-tartalmú étrend valamivel kevesebb rostot tartalmazott (2,4 vs. 2,8 g/MJ) és valamivel több koleszterint (22 vs. 18 mg/MJ), mint az alap diéta.
Minden ételt az UW és az OHSU CRC táplálkozási kutató konyháiban készítettek. Az összes étrendet mennyiségileg meghatároztuk a ProNutra és a ProNessy szoftverrel (3.0 verzió, Viocare Technologies Inc., Princeton, NJ). Minden étrendi szakasz [az alap diéta (CRC1), az izokaloros, alacsony zsírtartalmú étrend (CRC2) és az ad libitum diéta (CRC3)] befejeztével az alanyokat felvették a saját intézményük CRC-jébe, hogy a leírtak szerint teszteljék őket. lent.
Laboratóriumi módszerek
Lipidek és lipoproteinek
12-16 órás éjszakai böjt és legalább 15 perces pihenőidő után az iv. Elhelyezés után a kiindulási vért 0,1% EDTA-ban gyűjtöttük a lipid vizsgálatokhoz. Ezután 60 U/kg heparin bolust adtunk, és tíz perc múlva vért gyűjtöttünk lítium-heparin csövekbe a lipáz aktivitás mérésére. A vért azonnal centrifugáltuk 4 ° C-on, 3000 fordulat/perc sebességgel 15 percig. Ezután a plazma alikvot részeit lefagyasztottuk és -70 ° C-on tároltuk. Az összes koleszterint, trigliceridet, HDL-koleszterint, a lipoprotein frakciók koleszterintartalmát és a csúcs LDL részecske felhajtóerőt, a HDL2-koleszterint, a HDL3-koleszterint és az apolipoprotein B-t az északnyugati lipidkutató laboratóriumban mértük az előzőekben leírtak szerint (22, 23).
Post-heparin lipáz aktivitások
A teljes lipolitikus aktivitást a plazmában mértük a heparin bolus után, a korábban leírtak szerint (24). A lipoprotein lipáz (LPL) aktivitását a plazmából az LPL elleni specifikus monoklonális antitesttel történő inkubálás útján eltávolított lipolitikus aktivitásként számítottuk, és a máj lipáz (HL) aktivitást az LPL antitesttel való inkubálás után megmaradó aktivitásként határoztuk meg. Az enzimaktivitást a szabad zsírsav nanomoljában fejezzük ki, percenként felszabadulva milliliter plazmában 37 ° C-on. Az intra- és interay assay variációs együtthatók (CV) a HL esetében 6, illetve 14%, az LPL esetében 7, illetve 8% voltak.
CETP plazmakoncentráció
A CETP plazmakoncentrációit kereskedelmi forgalomban lévő szendvics ELISA immunvizsgálati készlettel (Wako Chemicals USA, Richmond, VA) mértük 2 monoklonális antitest felhasználásával. A vizsgálaton belüli CV és az inter-assay CV 3,1%, illetve 10,5% volt. Amint arról korábban beszámoltunk, az ezzel az ELISA assay-vel mért CETP-tömeg nagymértékben korrelál (r = 0,83, n = 42) a CETP-aktivitással (25).
PLTP aktivitásvizsgálat
A PLTP-aktivitást úgy határoztuk meg, hogy a jelölt foszfatidil-kolin átvitelét a vezikulákból a HDL3-ba mértük (26, 27), anélkül, hogy a plazmát hordozóként használtuk volna, amint azt korábban leírtuk (26). Ez a módszer a PLTP foszfolipidtranszfer aktivitását tükrözi, a CETPét nem. Három humán kontroll-plazmát hármas példányban vontunk be minden egyes vizsgálatba, és ezeket használtuk az inter-assay variációk korrekciójára. Az intra- és inter-assay CV 8%, illetve 2% volt.
Koleszterin koncentráció lipoprotein frakciókban
A lipoprotein sűrűség eloszlását és a koleszterin tartalmat nem egyensúlyi sűrűség gradiens ultracentrifugálással határoztuk meg egy korábban leírt technika és egy Sorvall TV-865B függőleges rotor (DuPont, Wilmington, DE) módosításával (28). A HDL a 0-6, az LDL a 7-18, az IDL a 19-30 és a VLDL a 30-38 frakciókban található. Az LDL relatív flotációt (LDL Rf), amely az LDL részecske csúcsképződésének mértéke, úgy határoztuk meg, hogy a csúcs LDL koleszterin koncentrációt tartalmazó 7 és 19 közötti frakciószámot elosztottuk az összegyűjtött frakciók teljes számával (egyenlő 38-mal). Ezt a technikát az apolipoprotein B részecskék részfrakcióinak elkülönítésére optimalizálták, és nem a sűrűbb HDL fajokat. Az LDL-frakciókat is összevontuk a koleszterin- és az apolipoprotein B-tartalom meghatározásához.
- Az étkezési fehérje, lipid és szénhidrát arány hatása a növekedésre, a takarmány hatékonyságára és a testre
- Teljes cikk A BMI és az éhomi inzulin társulása a szív- és érrendszeri betegségek kockázati tényezőivel
- A friss görögdinnye fogyasztás hatása a szív- és érrendszeri betegségek kockázati tényezőire túlsúlyos és
- 3 ad libitum étrend összehasonlítása a fogyás fenntartása, a szív- és érrendszeri betegségek kockázata és
- Az étrend minősége és a carotis atherosclerosis közepes kardiovaszkuláris kockázattal rendelkező egyénekben Táplálkozás