A szintetikus étrendi inulin, a Fuji FF, késlelteti az étrend okozta elhízás kialakulását a bél mikrobiota profiljának javításával és a rövid láncú zsírsavtermelés növelésével.
Miki Igarashi
1 Alkalmazott Biológiai Tudományok Tanszék, Mezőgazdasági Doktori Iskola, Tokiói Mezőgazdasági és Technológiai Egyetem, Fuchu, Tokió, Japán
Miku Morimoto
1 Alkalmazott Biológiai Tudományok Tanszék, Mezőgazdasági Doktori Iskola, Tokiói Mezőgazdasági és Technológiai Egyetem, Fuchu, Tokió, Japán
Asuka Suto
1 Alkalmazott Biológiai Tudományok Tanszék, Mezőgazdasági Doktori Iskola, Tokiói Mezőgazdasági és Műszaki Egyetem, Fuchu, Tokió, Japán
Akiho Nakatani
1 Alkalmazott Biológiai Tudományok Tanszék, Mezőgazdasági Doktori Iskola, Tokiói Mezőgazdasági és Technológiai Egyetem, Fuchu, Tokió, Japán
Tetsuhiko Hayakawa
1 Alkalmazott Biológiai Tudományok Tanszék, Mezőgazdasági Doktori Iskola, Tokiói Mezőgazdasági és Műszaki Egyetem, Fuchu, Tokió, Japán
Kenjirou Hara
2 Fuji Nihon Seito Corporation, Shizuoka, Japán
Ikuo Kimura
1 Alkalmazott Biológiai Tudományok Tanszék, Mezőgazdasági Doktori Iskola, Tokiói Mezőgazdasági és Műszaki Egyetem, Fuchu, Tokió, Japán
Társított adatok
Az adatok rendelkezésre állásával kapcsolatban a következő információkat közölték:
A nyers adatok a Kiegészítő fájlokban találhatók.
Absztrakt
Háttér
Az étrendi rostok, beleértve az inulint, erjesztési termékek révén - például a rövid láncú zsírsavak (SCFA-k) révén - elősegítik az egészséget a rostból a bél mikrobiotája által. Az SCFA-k pozitív élettani hatással vannak az energia-anyagcserére, a bél immunitására és az idegrendszerre. A kereskedelmi forgalomban lévő inulin nagy részét növényi forrásokból, például cikória gyökereiből vonják ki, de inzulint termelő enzimek segítségével enzimatikusan szintetizálhatók szacharózból is. A cafeteria-étrenddel táplált rágcsálókon végzett vizsgálatok azt sugallták, hogy a szintetikus inulin ugyan növeli a plazma propionsav szintjét, ugyanakkor a természetes inulinéval azonos módon modulálja a glükóz és a lipid metabolizmusát. Ezért ennek a tanulmánynak a célja a szintetikus inulin, a Fuji FF hatásának meghatározása az energia-anyagcserére, a széklet SCFA termelésére és a mikrobiota profilokra magas zsírtartalmú/magas szacharóztartalmú étrenddel etetett egerekben.
Mód
A három hetes C57BL/6J hím egereket 12 héten keresztül magas zsírtartalmú/magas szacharóz tartalmú táplálékkal táplálták, amely cellulóz vagy Fuji FF volt, és értékelték az energia-anyagcserére, az SCFA-termelésre és a mikrobiota profilokra gyakorolt hatásokat.
Eredmények
A testtömeg-növekedést a magas zsírtartalmú/magas szacharóz tartalmú táplálékkal táplált C57BL/6J egerekben gátolta a Fuji FF-pótlás, csökkentve a fehér zsírszövet súlyát, miközben növelte az energiafelhasználást, összehasonlítva a cellulózzal kiegészített egerekkel. A Fuji FF emelte az ecetsav, propionsav és vajsav szintjét az egér ürülékében, és emelte a plazma propionsavszintjét egerekben. Ezenkívül a székletminták 16S rRNS-gén amplikon szekvenálása a Fuji FF-del kiegészített egerekben megemelkedett Bacteroidetes-bőséget és csökkent Firmicutes-mennyiséget mutatott a menedék szintjén, összehasonlítva a cellulózzal kiegészített egerekben. A Fuji FF a Bacteroidales S24-7 család bőségét és a Desulfovibrionaceae csökkenését eredményezte a székletben is.
Következtetés
A Fuji FF hosszú távú fogyasztása javította az egerek bélkörnyezetét a mikrobiota összetételének megváltoztatásával és az SCFA-termelés növelésével, ami összefüggésben lehet annak elhízásellenes hatásával.
Bevezetés
A túlsúlyos és elhízott egyének prevalenciája globálisan növekszik az olyan anyagcserebetegségek, mint a II. Típusú diabetes mellitus (T2DM), a máj steatosis és a rák több típusa mellett (Chooi, Ding & Magkos, 2019; Collaboration, 2017). Bár úgy gondolják, hogy az elhízás etiológiája a genetikai és környezeti tényezők komplex kölcsönhatását vonja maga után, az étrendet tartják a legfontosabb hozzájárulónak az elhízott és túlsúlyos egyének világszerte növekvő előfordulásában (Chan & Woo, 2010; Chooi, Ding & Magkos, 2019) . Az étrendi zsírbevitel a megnövekedett feldolgozott és gyorsételek fogyasztása miatt megnövekedett, mivel csökkent az olyan élelmi rostok bevitele, amelyek olyan egészségügyi előnyöket nyújthatnak, mint például az olyan betegségek kockázatának csökkentése, mint az elhízás és a cukorbetegség (Delzenne et al., 2020; Hadrevi, Sogaard és Christensen, 2017). Az élelmi rostok ezen előnyei a tápanyagok bélben történő felszívódásának megzavarásával járnak, míg a hasznos rostokat a mikrobiota erjedt meg. Az élelmi rostok megváltoztathatják a mikrobiota összetételét is, hogy csökkentse a betegségek kockázatát, beleértve az elhízást is. Ezért egy olyan étrendi rostot, amely elősegíti a hasznos mikroorganizmusok szaporodását a belekben, prebiotikumnak nevezik, fogyasztása pedig a fogadó egészségének fenntartása érdekében ajánlott (Gibson et al., 2017).
Különböző növények természetesen termelnek inulint, amely egy élelmi rost (Mensink és mtsai., 2015), amely ismétlődő fruktozilcsoportok egyenes láncait tartalmazza, amelyek β (2 → 1) kötésekkel kapcsolódnak egy (1↔2) D-glükozil részhez. vége (Mensink et al., 2015). Ezeknek a fruktózláncoknak a hossza változó, a polimerizáció mértéke (DP) általában 2 és 60 között van (Mensink és mtsai, 2015). Az inulin az élelmiszeriparban, a gyógyszeriparban és a vegyiparban alkalmazott poliszacharid, a fizikai-kémiai tulajdonságainak egyedülálló változatossága miatt (Mensink et al., 2015). A felhalmozódó bizonyítékok hangsúlyozták az élelmi rostok fontosságát az elhízás megelőzésében és kezelésében (Delzenne et al., 2020). Az inulin prebiotikus elhízás elleni hatásokat fejt ki, mert a bél mikrobiotája SCFA-ra, különösen vajsavvá fermentálja (Hoving et al., 2018). Úgy tűnik, hogy ezek a hatások nemcsak az étrendi adagtól, hanem az inulin DP-jétől is függenek (Van Loo, 2004). A DP különbségei hatással vannak az inulin fermentációra és a bél régióra is, ahol előfordul, és ez megváltoztatja a metabolitok összetételét és a mikrobiómot a bélszegmensekben (Le Blay et al., 2003). A jelenlegi kutatások az inulin prebiotikus funkcióinak különbségeit igyekeznek megérteni különböző DP-vel vagy hosszúsággal (Le Blay és mtsai, 2003).
Anyagok és módszerek
Tanulmányterv és kísérletek
Az energia-anyagcsere és a mozgásmérés
A metabolikus kamrában egyedileg elhelyezett egereket legalább 12 órán át akklimatizáljuk a 9. és 11. hét között. Ezután MK-5000RQ eszközzel mértük a VO2 és VCO2 értékeket, és a mozdony aktivitását a CompACT AMS ver.3 szoftverrel (mindkettő a Muromachi Kikai Co.-tól). Ltd., Tokió, Japán). A rendszert szigorú, 12 órás fény/sötét ciklus alatt, 22 ° C és 30–60% páratartalom mellett végeztük. A mérések legalább 48 órán át folytak, beleértve az akklimatizálódási időszakot (≥12 óra), szabad hozzáféréssel az ételhez és a vízhez. A légzési hányadokat és az energiafelhasználást az MMS-4 6.2-es verziójával (MK-5000RQ operációs szoftver) meghatározott VO2 és CO2 értékek alapján számoltuk. Folyamatos 24 órás adatokat nyerünk ki a légzési hányadról, az energiafelhasználásról és a mozdony aktivitásáról. A rendszer korlátai és a kísérleti ütemterv által előidézett időbeli korlátok miatt 12 és 10 egérben mértük az energia-anyagcserét és a mozgást cellulózt és Fuji FF-et kapva.
Rövidláncú zsírsavak mennyiségi meghatározása
A széklet mikrobiotájának elemzése 16S rRNS gén amplikon szekvenálással
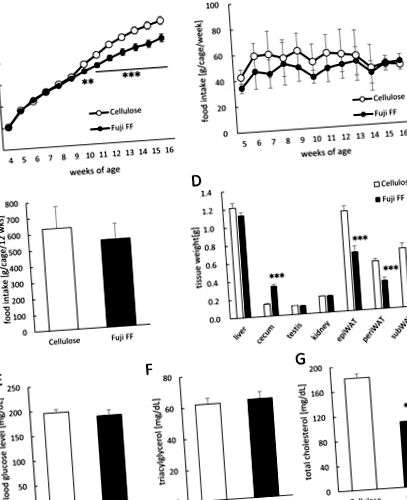
(A) Testtömeg-növekedés. (B) Heti táplálékfelvétel (g/ketrec/hét; n = 9). (C) Teljes táplálékfelvétel (g/ketrec/12 hét; n = 9). (D) A máj, a vakbél, a vese, a herék és a fehér epididimális (epiWAT), a perirenal (periWAT) és a szubkután (subWAT) zsírszövetek súlya magas zsírtartalmú/magas szacharóz-diétával táplált egerekben, cellulózzal vagy Fuji FF-el kiegészítve 12 hét. (E) Vércukorszint, (F) plazma triacilglicerin és (G) plazma összkoleszterin-értékek egerekben mértek 5 órás éhgyomorra után. Az adatokat átlag ± SEM (A, D, E, F és G) vagy ± ± SD (B és C) átlagokban fejezzük ki. A jelentőséget a kiigazított p-n állapítják meg (1. ábra). A légzési hányados (RQ) alacsonyabb volt a sötét időszakban a Fuji FF-tel kiegészített egerekben a sötét időszakban, mint a cellulózzal (2A. És 2B. Ábra; 2B; p = 0,0448, p = 0,0344, p = 0,0128 és p = 0,003 23:00 órakor h, 00:00 h, 01:00 h, illetve a sötét periódusok), ami arra utal, hogy a Fuji FF-del kiegészített egerek több zsírt metabolizálnak, mint szénhidrátot vagy fehérjét. Másrészt a Fuji FF-del kiegészített egerek lényegesen több energiát költöttek mind a sötét, mind a világos periódusban (2C. És 2D. Ábra; 2D; p = 0,006 08:00 órakor, p 2E. És and2F. Ábra; 2F.; p 3. ábra). Az ecetsav, a propionsav és a vajsav szintje (3A, 3B, 3B és 3C, illetve 3C, 3C. Ábra) szignifikánsan megemelkedett a Fuji FF-del kiegészített egerek székletében, összehasonlítva az egerek cellulózával (3E. Ábra). kiegészítve Fuji FF-rel (p = 0,039), míg az ecetsav (3D-s ábra) és a vajsav (3F. ábra) nem. Így a Fuji FF fermentációval növelte az SCFA béltermelését, ami aztán megemelte a propionsav plazmaszintjét, talán azért, mert a bélben termelődött SCFA-k többsége a májban metabolizálódott.
A Fuji FF nyilvánvalóan csökkentette a zsír felhalmozódását az egerekben azáltal, hogy növelte a zsír oxidációját és az energiafelhasználást, amit alacsonyabb RQ és több energiafelhasználás tükröz. Nevezetesen, az inulin és az oligofruktóz nem befolyásolja az ileostomiás betegek zsírelválasztását a vékonybélben (Ellegard, Andersson és Bosaeus, 1997), bár a hatás a rostok dózisától függhet. Ezért a Fuji FF által indukált megnövekedett SCFA-szintek lehetnek a fokozott energia-anyagcsere modulátorai, mert az SCFA-k a G-fehérjéhez kapcsolt receptor (GPR) 41 és GPR43 endogén ligandumai (Kimura és mtsai, 2011), amelyek számos fiziológiai folyamatok, beleértve az energia-anyagcserét és a neurológiai funkciókat (Kimura et al., 2014). Az egerek és az emberek szimpatikus ganglionjai kifejezetten kifejezik a bőséges GPR41-et; így az energiafogyasztást és a testhőmérsékletet befolyásolhatják az SCFA-k a GPR41-en keresztül, amely szabályozza a szimpatikus idegrendszer aktiválódását (Kimura et al., 2011). Ezenkívül a GPR43 a zsírszövetekben expresszálódik, ahol szabályozza a zsír felhalmozódását. A GPR43-hiányos egerek fenotípusa elhízott, míg a zsírszövetekben a GPR43-t túlzott mértékben expresszáló egereké sovány/normális (Kimura et al., 2013). További vizsgálatokra van szükség annak tisztázása érdekében, hogy ezek a receptorok hogyan vesznek részt a Fuji FF egészségügyi előnyeiben.
Következtetések
Ez a tanulmány azt vizsgálta, hogy a szintetikus inulin, a Fuji FF megakadályozhatja-e a diéta által kiváltott elhízás kialakulását a bél mikrobiota és az SCFA termelésének in vivo módosításával.
Eredményeink azt mutatták, hogy a Fuji FF erőteljesen képes megakadályozni az étrend által kiváltott elhízást azáltal, hogy egerekben SCFA-ként történő fermentáció révén módosítja a bél környezetét. Az SCFA-k potenciális szerepét a Fuji FF inulin elhízás elleni fellépésében tovább kell vizsgálni, értékelve azok GPR41 és GPR43 receptorokra gyakorolt hatását.
- Az étrendi tényezők szerepe a bazális sejtrák és a pikkelysmr kialakulásában
- Kérődzők táplálkozása, a kérődzők gyomorfejlődését befolyásoló étrendi tényezők Journal of
- Tápanyagok Ingyenes teljes szövegű étrend-kiegészítő címkék adatbázisának fejlesztése Olaszországban Fókuszban az FoodEx2
- Paradox rezisztencia a magas zsírtartalmú étrend okozta elhízással és a makrofágok megváltozott polarizációjával szemben
- Elhízás és az epekő kialakulásának kockázata rendszeres 1200 kcald (5025 Kjd) étrenden - PubMed