A TAT-HBV célzott ribonukleáz anti-HBV hatása
Levelezés: Cai-Fang Xue professzor vagy Dr. Jun Liu, Negyedik Katonai Orvostudományi Egyetem Etiológiai Tanszéke, Hszian 710032, Shaanxi tartomány, Kína. nc.ude.ummf@ygoloite
Telefon: + 86-029-3374536 Fax: + 86-029-3374594
Absztrakt
CÉL: A TAT-HBV célzott ribonukleáz fúziós fehérje előkészítése és tisztítása, értékelje annak transzdukciós aktivitását és vizsgálja a HBV replikációra gyakorolt hatását 2.2.15 sejtekben.
MÓDSZEREK: A TRT gént tartalmazó pTAT prokarióta expressziós vektort alkalmaztuk az E.coli BL21 (DE3) LysS transzformálásában, és a TR-t IPTG indukcióval expresszáltuk. A TAT-TR fúziós fehérjét Ni-NTA-agróz és PD-10 sótalanító oszlopok segítségével tisztítottuk, és SDS-PAGE-val elemeztük. A TAT-TR transzdukciós hatékonyságát immunfluoreszcencia vizsgálattal detektáltuk, és a HBeAg koncentrációját a 2.2.15 sejtek felülúszójában szilárd fázisú radioimmunassay (spRIA) segítségével határoztuk meg. MTT vizsgálatot alkalmaztunk a TAT-TR citotoxicitásának kimutatására.
Eredmények: Az SDS-PAGE azt mutatta, hogy a TAT-TR fúziós fehérjét sikeresen tisztítottuk, és a TAT-TR tisztasága 90% volt. A TAT-TR immunfluoreszcencia vizsgálattal történő vizualizálása azt mutatta, hogy nagy a hatékonysága a 2.2.15 sejtek transzdukciójában. Az RIA eredménye arra utal, hogy a TAT-TR hatékonyan gátolhatja a HBV replikációját, nem befolyásolta a sejtek növekedését és nem volt citotoxikus.
KÖVETKEZTETÉS: A TAT-TR jelentős anti-HBV aktivitással rendelkezik, és a TAT-TR fúziós fehérje elkészítése megalapozta a TR használatát a HBV fertőzés terápiás vizsgálatában.
BEVEZETÉS
A fehérjék bejuttatását az emlős sejtekbe expressziós vektorok transzfekciójával, mikroinjekcióval vagy fertőző vírussal stb. Sikerült elérni. Bár ezek a megközelítések némileg sikeresek voltak, a klasszikus manipulációs módszerek nem könnyen szabályozhatók és fáradságosak lehetnek. E problémák megoldásának egyik megközelítése a PTD által közvetített fehérje transzdukció alkalmazása [1,2]. Kovalensen kapcsolódva fehérjékhez, peptidekhez, nukleinsavakhoz, vagy teljes hosszúságú fehérjékkel történő keretfúzióként, a PTD lehetővé tenné számukra, hogy receptoroktól és transzporterektől függetlenül bármilyen sejttípusba belépjenek [3]. A HIV-TAT a fehérje transzdukciós domének tagja, és úgy tűnik, hogy magas szintű fehérje transzdukciós hatékonysággal rendelkezik [4,5]. Kimutatták, hogy a TAT fúziós fehérjék az egerekben jelenlévő összes sejtbe és szövetbe transzdukálódnak [6], beleértve azokat is, amelyek a vér-agy gáton vannak jelen [7,8]. És sok, ha nem a legtöbb fehérje transzdukálódhat a sejtekbe ezzel a technológiával. Ezért a TAT PTD lehetővé teheti új kérdések megválaszolását a preklinikai kutatások során, sőt segíthet az emberi betegségek kezelésében.
A hepatitis B az egész világon jelentős egészségügyi probléma [9-13]. A krónikus fertőzés a májcirrózis és az elsődleges májkarcinóma magas kockázatával jár [14-22]. A jelenleg rendelkezésre álló terápiák korlátozott hatékonyságúak [23-35]. A HBV-célzott ribonukleáz (TR) gént, a HBVc és a hEDN fúziós génjét Liu és munkatársai [36] konstruálták laboratóriumunkban, a kapszid-célzott vírus inaktiválás (CTVI) elmélete szerint, amely ígéretes stratégia az anti- víruskutatás. HBVc-t alkalmaztunk célmolekulaként, amely a HBV szerkezeti fehérje volt, és nélkülözhetetlen volt a HBV-részecske csomagolása során. Az effektor molekula hEDN volt, egyfajta emberi ribonukleáz, amely képes lebontani a HBV pgRNS-jét. A 2.2.15 sejtek transzfekciója a TR gént hordozó eukarióta expressziós vektorral arra utalt, hogy a TR szignifikánsan gátolta a HBV replikációját [37]. Ezért a HIV-TAT és a TR összekapcsolása hatékonyabb megközelítést biztosítana a TR hepatocitákba történő bejuttatásához, és nagymértékben elősegítené a TR felhasználását a HBV fertőzés kezelésében. Itt közöljük a TAT-TR fúziós fehérje tisztítását, transzdukciójának azonosítását és a 2.2.15 sejtekre kifejtett anti-HBV hatást. Anti-HBV mechanizmusának megerősítése érdekében előkészítettünk és tisztítottunk TAT-TRmut, TAT-hEDN és TAT-HBVc fehérjéket negatív kontrollként történő felhasználásra.
ANYAGOK ÉS METÓDUSOK
Anyagok
A Ni-NTA-agroszt a Qiagen Company-tól vásároltuk. A PD-10 sótalanító oszlopokat az Amersham Pharmacia Biotech cégtől szereztük be. Anti-his mAb-je a Santa Cruz Company-tól származott. A fehérje molekulatömeg-markerek, az IPTG és a G418, az imidazol és az MTT mind a Sino-American Biotech cégtől származnak. A RIA HBVeAg vizsgálati készletet a Beimian Dongya Biotechnológiai Intézettől vásároltuk. A 2.2.15 sejtek Prof. Cheng, a kínai PLA 302 kórházának kedves ajándékai voltak. A hEDN-t Li és munkatársai tisztították [36]. A pTAT-HA/TR, TAT-HA/TRmut, a pTAT-HA/hEDN és a pTAT-HA/HBVc laboratóriumunkban mind elkészültek [38]. A laboratóriumunkban PET-30a/TR, PET-30a/TRmut, PET-30a/HBVc és E.coli BL21 (DE3) LysS-t tartottunk.
Mód
TAT fúziós fehérjék kifejezése és tisztítása pTAT-HA/TR, TAT-HA/TRmut, pTAT-HA/hEDN, pTAT-HA/HBVc és pTAT-HA-t alkalmaztunk az E.coli BL21 (DE3) LysS transzformálására CaCl2 perforáció alkalmazásával. A transzformánsokat külön-külön tenyésztettük 3 ml TB amp-ban (100 μg/l) 37 ° C-on egy éjszakán át. 100 μl tenyészetet oltottunk be 10 ml friss TB erősítőbe, és 4 órán át inkubáltuk 37 ° C-on. Ezután minden csőhöz IPTG-t adtunk 100 μmol/l végkoncentrációig, és a tenyészetet további 4 órán át inkubáltuk. Az indukált sejteket centrifugálással gyűjtöttük össze, és a sejtlizátumokat 120 g/l SDS-PAGE-val elemeztük. A jelölt fúziós fehérjéket Ni-NTA-agróz és PD-10 sótalanító oszlopok felhasználásával tisztítottuk meg a gyártó ajánlásai szerint (Qiagen és Amersham Pharmacia). A tisztított fehérjéket 120 g/l SDS-PAGE-val analizáltuk.
Fehérjék kifejezése és tisztítása TAT PTD nélkül PET-30a/TR, pET-30a/TRmut és pET-30a/HBVc transzformált E.coli BL21 (DE3) LysS. Az expressziós szintek elemzése után a három fehérjét ugyanúgy tisztítottuk, mint a TAT fúziós fehérjéket.
2.2.15 sejt tenyésztése A sejteket 150 ml/l szarvasmarha magzati szérumot tartalmazó DMEM-ben tenyésztettük 37 ° C-on 50 ml/l CO2-ban és 100 mg/l G418-ban.
A TAT fúziós fehérje transzdukciójának azonosítása 2.2.15 sejtet (2x108/L) 6 lyukú lemezekre szélesztettünk fedőrétegekkel, és hagytuk 24 órán át tapadni. A lyukakba TAT-TR, TAT-TRmut, TAT-hEDN, TAT-HBVc, TR, TRmut, hEDN és HBVc-t adtunk 100 nmol/l végkoncentrációban. 30 percig 37 ° C-on inkubáljuk, az összes sejtet azonnal steril PBS-sel (pH 8,0) mossuk, 20 g/l paraformaldehidben és PBS-ben hígított 1 g/l TritonX-100-ban rögzítjük, és jégre helyezzük 30 percig. A sejteket háromszor mossuk hideg PBS-sel. A nem specifikus epitópokat 10 g/l BSA alkalmazásával 10 percig 42 ° C-on blokkoltuk. A sejteket háromszor hideg PBS-sel mostuk, majd egér anti-His mAb-jével (1: 500) inkubáltuk 15 percig 42 ° C-on. . Háromszor hideg PBS-ben végzett mosás után FITC-vel (1: 1000) jelzett nyúl anti-egér IgG-t adtunk mindegyik üregbe, és 10 percig inkubáltuk 42 ° C-on. 1 órán át PBS-sel öblítettük, és a fedőlemezeket a tárgylemezekre rögzítettük 500 ml/l glicerin alkalmazásával. A sejteket fluoreszcens mikroszkóppal figyeltük meg.
A TAT-TR anti-HBV hatásának meghatározása 2.2.15 sejtet 2x108/L sűrűségben 12 üregű lemezekre szélesztettünk. A lyukakba TAT-TR, TAT-TRmut, TAT-hEDN és TAT-HBVc-t adtunk 100 nmol/l végkoncentrációban. 20 μL DMEM-et adagoltunk a lyukakba mint modellcsoport. Minden csoporthoz négy párhuzamot állítottak fel. 24 órával később a felülúszó HBVeAg-értékét a gyártó által leírt spRIA kit segítségével határoztuk meg.
MTT assay 2.2.15 sejtet 2x108/l sűrűségben 96 lyukú lemezekre szélesztettünk. 24 óra elteltével TAT-TR, TAT-TRmut, TAT-HEDN, TAT-HBVc-t adtunk az (A), (B), (C), (D) csoportokba 100 nmol/l végkoncentrációban. 20 μl DMEM-et adtunk az (E) üregbe. 72 órával később a sejtek morfológiáját inverz mikroszkóppal figyeltük meg, és MTT-t alkalmaztunk mindegyik mélyedésben 5 g/l végkoncentrációban. További 4 órás tenyésztés után 150 µl DMSO-t adunk az összes üregbe, és kimutatjuk az A490 fényelnyelését.
Statisztikai analízis
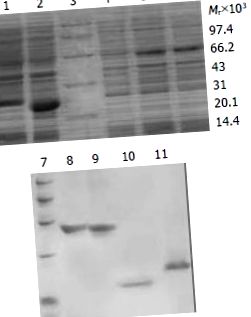
Az összes kapott adatot SPSS szoftverrel dolgoztuk fel. P (1. ábra). 1). A fúziós fehérjék tisztaságának foka 90%, 88%, 80% és 85% volt.
A TAT fúziós fehérjék expressziójának és tisztításának SDS-PAGE elemzése. 1. ábra: pTAT-HA/HBVc transzformálja; 2. ábra: pTAT-HA/hEDN által transzformálva; 3: Fehérje marker; 4. ábra: pTAT-HA transzformálja; 5. ábra: transzformált pTAT-HA/TR; 6. ábra: transzformálta pTAT-HA/TRmut; 7. ábra: Fehérje marker; 8. ábra: Tisztított TAT-TN; 9. ábra: Tisztított TAT-TNmut; 10. ábra: Tisztított TAT-hEDN; 11. Tisztított TAT-HBVc.
Fehérjék kifejezése és tisztítása TAT PTD nélkül
Hasonló módon indukálták a pET-30a/TR, a pET-30a/TRmut és a pET-30a/HBVc fehérjék expresszálását TAT PTD nélkül az IPTG segítségével a BL21 (DE3) LysS-ben, és előre jelzett molekulatömegű fehérjéket termeltek (ábra (2. ábra). 2). Ezután a fehérjéket Ni-NTA affinitás oszlopok és PD-10 sótalanító oszlopok segítségével tisztítottuk. A fúziós fehérjék tisztaságának foka 88%, 76% és 81% volt.
Tisztított kontroll fehérjék SDS-PAGE elemzése. 1: Fehérje marker; 2. ábra: Tisztított HBVc; 3. ábra: pET30-a/HBVc-vel transzformált BL21 expressziós terméke; 4. ábra: pET30-a-val transzformált BL21 expressziós terméke; 5. ábra: a BL21 expressziós terméke, amelyet pET30-a/TR transzformál; 6. pET30-a/TRmut által transzformált BL21 expressziós terméke; 7. ábra: Tisztított TR; 8. ábra: Tisztított TRmut.
A fehérje transzdukciójának azonosítása
A fúziós fehérjék transzdukciós képességének értékelése a 2.2.15 sejt membránjának keresztezésében. TAT-TR, TAT-TR mut, TAT-hEDN és TAT-HBVc hozzáadtuk a táptalajhoz 100 nmol/l végkoncentrációban. TR, TRmut, hEDN és HBVc TAT PTD nélkül használtuk negatív kontrollként. A fluoreszcens mikroszkóp alatt bőséges fluoreszcenciát lehetett látni a TAT fúziós fehérjékkel transzdukált sejtek citoplazmájában, de a kontroll sejtekben nem találtunk fluoreszcenciát (3. ábra). Ez az eredmény egyértelműen arra utal, hogy a TAT fúziós fehérjék nagy hatékonysággal képesek átjutni a 2.2.15 sejtek membránján.
A TAT fúziós fehérjék transzdukciójának kimutatása 2.2.15 sejtekben. V: Hozzáadva a TAT-TR-hez; B: TAT-hEDN-nel hozzáadva; C: TAT-HBVc-vel hozzáadva; D: Hozzáadva a TAT-TRmut-tal; a: TR-el hozzáadva; b: Hozzáadva hEDN-el; c: HBVc-vel hozzáadva; d: Hozzáadva a TRmut paranccsal.
Az anti-HBV aktivitás elemzése a TAT-TR esetében
Az SPSS szoftverrel végzett statisztikai elemzés azt mutatta, hogy a TAT-TR csoport átlagos HBeAg koncentrációja szignifikánsan csökkent a kontroll csoportokhoz képest (Az átlagos különbség 0,05 szinten szignifikáns). Ezenkívül nincs szignifikáns különbség a kontrollcsoportok átlagos koncentrációja között (P> 0,05). A TAT-TR csoport HBeAg koncentrációja 60,3% -kal csökkent (ábra (4. ábra 4).
A HBeAg koncentráció összehasonlítása a különböző csoportok között.
MTT assay
72 órás tenyésztés után inverz mikroszkóp alatt figyelték meg a sejtek morfológiáját, és azt találták, hogy a négy kísérleti csoport és a DMEM kontroll között nem volt észrevehető különbség. Az MTT assay nem mutatott szignifikáns különbséget az öt csoport között. A490-es abszorbanciaértékük (¯x ± s, n = 4) 0,4875 ± 0,018, 0,4675 ± 0,022, 0,4690 ± 0,028, 0,4800 ± 0,029 és 0,4855 ± 0,050 volt (P> 0,05).
VITA
- A test összetétele fiatalkori idiopátiás ízületi gyulladásban szenvedő gyermekek étrendi bevitelének
- Test karcsúsító hatása
- Az összes Karcsúsító Világ csoport azonnali hatállyal bezárult a legújabb koronavírus-tanácsok nyomán -
- Az összes Karcsúsító Világ csoport azonnali hatállyal bezárult a legújabb koronavírus-tanácsok nyomán -
- A mézes kávé előnyei és mellékhatása a fogyáshoz