A transzkriptómanalízis robusztus génexpressziós programot azonosít az öregedés során az egér bélhámjában
Juri Kazakevych
1 Babraham Intézet, Cambridge, CB22 3AT, Egyesült Királyság
Elena Stoyanova
1 Babraham Intézet, Cambridge, CB22 3AT, Egyesült Királyság
Anke Liebert
1 Babraham Intézet, Cambridge, CB22 3AT, Egyesült Királyság
3 Jelenlegi cím: The Francis Crick Institute, London, NW1 1AT UK
Varrick-Weisz Patrick
1 Babraham Intézet, Cambridge, CB22 3AT, Egyesült Királyság
2 Genomika és számítási biológia, Biológiai Tudományok Iskola, Essexi Egyetem, Colchester, Egyesült Királyság
Társított adatok
Az ebben a tanulmányban létrehozott adatkészletek a GEO adattárban érhetők el,> GSE122441 csatlakozási számmal.
Absztrakt
A bélhám folyamatosan regenerálódik, amelyet a bél őssejtjei hajtanak. Fontos, de kevéssé feltárt kérdés, hogy az öregség milyen hatással van a transzkriptómra ebben a rendkívül dinamikus szövetben. A válogatott bél őssejteken és a felnőtt enterocitákon található transzkriptikumok segítségével azonosítottunk olyan jelölt géneket, amelyek megváltoztatják az expressziót az öregedés során. Ezek további validálása több középkorú vagy idős egér bélhámján rávilágított a Ccr2 kemokinreceptort kódoló gén expressziójának következetes felfelé történő szabályozására, amely a gyulladás közvetítője és számos betegségfolyamat. Megfigyeltük az Strc expressziójának megnövekedését, a sztereocilin kódolását és az Rps4l expressziójának drámai csökkenését, amely egy riboszóma alegységet kódol. A Ccr2 és az Rps4l a 9., illetve a 6. kromoszóma telomer régióihoz közel helyezkedik el. Mivel csak kevés gén expresszálódott differenciálisan, és nem figyeltünk meg szignifikáns fehérjeszint-változásokat az azonosított öregedési markerekben, elemzésünk rávilágít az egér bélhámgén expressziójának általános robusztusságára idős korig.
Bevezetés
Annak ellenére, hogy a bélrendszer létfontosságú az élet és az egészség szempontjából, korlátozott ismeretek állnak rendelkezésre arról, hogyan lehet a bél egészségét fenntartani egész életen át. Számos, az életkorral összefüggő bélbetegség, például vastagbélrák, divertikuláris betegség és gyulladásos bélbetegség (IBD) vált általánossá a fejlett országokban az életmód, különösen a táplálkozás változásával, amely potenciálisan mögöttük állhat. Az öregedés befolyásolja a bélműködést és az egészséget 1. Az életkor a rák egyik leggyakoribb formája, a vastagbélrák erős kockázati tényezője is. A gyomor-bélrendszeri állapotok az idősek morbiditásának és kórházi kezelésének egyik leggyakoribb oka Európában, és ezek továbbra is növekszik 2 .
Érdekes módon különböző modellorganizmusokban, például a Caenorhabditis elegans és a Drosophila esetében a belek a legfontosabb szervek az élettartam és az egészség meghatározásában 3, 4. Emberekben az öregedés a fokozott béláteresztő képességgel és a veleszületett immunválaszokkal függ össze 5, 6 .
Az öregedés, még az „egészséges” öregedés is összefügg a génexpresszió változásával, beleértve a bél 5–7-ét is. Egy tanulmány, amely fiatal (2–4 hónapos) és idős (18–22 hónapos) egerek bél őssejtjeit (ISC) hasonlította össze, kimutatta, hogy az öregedés az ISC számának növekedésével, proliferációjával és az ISC apoptózisának növekedésével jár 8. Arról azonban keveset tudunk, hogy az öregedés hogyan és milyen mértékben befolyásolja a bél őssejtjeinek génexpresszióját, amelyek a bélhám állandó és esszenciális regenerációját vezérlik. Saját és más munkáink, ideértve az egysejtes transzkripciós elemzést is, a génexpressziós változásokat javasolják a vérképző rendszer szomatikus őssejtjeiben és prekurzor sejtjeiben az öregedéskor 9, 10. Így valószínű, hogy ezek az emlős bél őssejtjeiben és származékaik sejttípusaiban is előfordulnak. Ezért fontos megérteni az öregedésnek a bélsejt gén expressziójára és működésére gyakorolt hatását. Itt transzkriptóm alapú szűrést végeztünk azon gének azonosítására, amelyek öregkori expresszióváltozásokat mutatnak az egér bélhám sejtjeiben. Meghatároztuk a Ccr2 és Strc upregulációt és az Rps4l downregulációt mint az idősebb bélsejtek jellemzőjét egy átfogó robusztus génexpressziós program hátterében.
Eredmények
Az RNAseq azonosítja az életkor által szabályozott jelölt géneket a bélhámsejtekben
Lgr5-EGFP-IRES-CreERT2 knock-in egereket használtunk az Lgr5 + bél őssejtek (ISC) 11, 12 és felnőtt enterociták (AE) izolálására. Lgr5-EGFP magas sejteket és AE-t izoláltak a fiatalabbaktól (
33 hét) és öreg egerek (
118 hét) fluoreszcenciával aktivált sejtszortírozással a közzétett 12., 13. eljárás alkalmazásával (S1. Ábra). Középkorú egerek kiválasztása a fiatalabb kohorszhoz lehetővé teszi az öregedési folyamat vizsgálatát, amelyet nem fednek el a korai felnőttkorban bekövetkező változások. A poli (A) + RNS-t mindkét sejtpopulációból izoláltuk, és a génexpressziót RNS-szekvenálással (RNAseq) elemeztük. Ez azt mutatta, hogy a szortírozott ISC ismert őssejtmarkereket, például Olfm4 és Lgr512 expresszált, igazolva a sejttisztítási sémát (S2 és S3B ábra). Hasonlóképpen, az AE ismert differenciált enterocita markereket Vil1, Apoc3 és Sis 13, 14 expresszált. A proliferáció (pl. Myc) és a sejttípusú markerek (pl. Lgr5, Vil1) expressziós mintázata az öregedéssel nem változott, jelezve robusztus expressziójukat (S2 és S3B ábra).
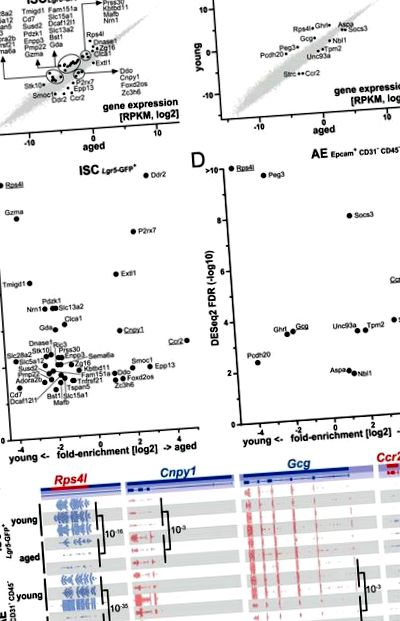
Az őssejtekben 10 szignifikánsan életkorral felül szabályozott gént és 29 életkorral alacsonyabban szabályozott gént azonosítottunk, valamint felnőtt enterocitákban 7, életkorral felül és 5 életkorral alacsonyabban szabályozott gént azonosítottunk (1. ábra). A kombinált 49 génlista gén ontológiai (GO) elemzése többek között a következő kifejezéseket határozta meg: gyulladásos válasz (P = 0,026), az immunválaszban részt vevő mieloid sejtaktiváció (P = 0,018), a külső ingerre adott válasz negatív szabályozása (P = 0,031) és a plazmamembrán belső komponense (P = 0,0004) (az elemzéshez és az eredmény részleteihez lásd az 1. kiegészítő táblázatot, S4. Ábrát). Nevezetesen, a Ccr2-t, az idős egerekben a legerőteljesebben felfelé szabályozott, differenciálisan expresszált gént (DEG) találták mind az ISC, mind az AE sejtekben, valamint a leginkább lefelé szabályozott DEG, az Rps4l-t (1. ábra).
A génexpresszió az öregedéskor megváltozik a vékonybél őssejtjeiben (ISC) és a felnőtt enterocitákban (AE). (A,B) A szóródiagramok különböző módon szabályozott géneket mutatnak az ISC-ben (A) és AE (B) és információt szolgáltatnak relatív expressziós szintjükről, mint log2 skála RPKM kvantálás. Minden bemutatott gén és jelentősen fel/le szabályozott gének (DESeq2 teszt cut-off FDR S3A-val .
A Ccr2 és Strc fokozott expressziója és az Rps4l mRNS csökkent expressziója az idős bélhámsejtek markerei
Mivel az öregedés heterogén folyamat, még az izogén egyedek is különböző sebességgel engednek az életkorral összefüggő változásoknak, az RNAseq adatokból fordított transzkripcióval, majd kvantitatív polimeráz láncreakcióval (RT-qPCR) validáltuk a jelölt géneket, egyes sejtekből kivont sejtek felhasználásával. egy nagyobb éves korcsoport (
109 hét) és fiatal egerek (
37 hét). Az RNAseq eredményeink validálásához kriptákat izoláltunk, mivel ezek többnyire ISC-t és közvetlenül az ISC-ből származó sejteket tartalmaznak: tranzit-amplifikáló (TA) és Paneth sejteket. A bőségesebb TA-sejtek a bél differenciálódásának kezdetén jelennek meg az ISC-kből, az ISC-hez hasonló expressziós mintázattal. Ezért nem számítottunk lényeges hatásokra a gén expresszióban megfigyelt, életkorral összefüggő változásokra. Az AE-t izoláltuk a villiból, ahogy azt az RNAseq esetében tettük.
Mivel a Ccr2 részt vesz a monociták és a neutrofilek 15, 16 toborzásában, a vékonybél hámszeleteit egy myeloperoxidáz elleni antitesttel festettük meg, amely detektálja a neutrofileket és a monocitákat, hogy ellenőrizzük, hogy megváltozott-e ezeknek a sejteknek az utánpótlása a fiatalabb szövetekhez képest. Megtaláltuk az MPO pozitív sejtek cseppjeinek számát az öregedő szövetben (3. ábra és S6 kiegészítő ábra).
Neutrofilek és monociták a vékonybél hámjában az öregedés során. (A,B) A myeloperoxidase (MPO) -pozitív sejtek bélhám lokalizációja (zöld) immunfluoreszcencia festéssel és DAPI-val (kék) végzett nukleáris ellenfestéssel mutatja a fiatalok maximális intenzitású vetületeit (A) és idősebbek (B) vékonybél-hám (SI). Méretarányok: 40 µm. Megnövelt nagyítás a kripta rekeszek (A,B), valamint a negatív festési kontrollokat az S6. ábra mutatja. (C) Az F4/80-pozitív sejtek mennyiségi meghatározása a fiatal és idős SI képzett kriptája/villusa területén. A feltüntetett P-értékeket kétirányú ANOVA-val határozták meg Holm-Sidak többszörös összehasonlító tesztjével (n = 4-5). A nyers kvantifikációs adatokat és a teljes statisztikai eredményeket a 4. kiegészítő táblázat mutatja. Pontozási példákat mutatunk be az S6A, C ábrán .
Vita
Az RNAseq, majd az azonosított génjelöltek RT-qPCR elemzése azt mutatta, hogy fiatal és idős állatok között csak néhány gén expresszálódik következetesen differenciálisan a bélhámsejtekben. Ez tükrözheti a dinamikus szövet rendkívül robusztus génexpressziós mechanizmusát. Rávilágít a Babraham Intézet idős egerek telepének kiváló egészségi állapotára is, mivel a gyulladáshoz kapcsolódó markerek újraszabályozásáról kevés bizonyíték áll rendelkezésünkre, a Ccr2 és P2rx7 kivételével.
Figyelemre méltóak azok a gének, amelyek a vékonybél kriptafrakciójából származó sejtekben az expresszió változásának tendenciáját mutatják az öregedéskor. A Ddr2 egy transzmembrán kollagén receptort kódol, tirozin kináz aktivitással, és különféle betegségfolyamatokban vesz részt, mint például az érelmeszesedés és a rák 33. A Ddo egy D-aszpartát-oxidázt kódol, amelynek promótere számos 34–36 vizsgálat során kimutatták, hogy az emberek öregedésével elveszíti a DNS-metilációt. A Pcdh20 egy protocadherint, egy homofil sejt-adhéziós fehérjét kódol, és azt javasolják, hogy működjön tumor-szuppresszor génként 37, 38. A PCDH20 szerepe a bélhámban kevéssé ismert. A P2rx7 egy purinerg receptort kódol, amely a gyulladás és a gyulladásos fájdalom közvetítője az IL-1β feldolgozásának és felszabadulásának szabályozásán keresztül, beleértve a bélben 39 .
Vizsgálatunk markáns különbségeket mutat a korábbi vizsgálatokhoz képest. Moorfield és mtsai. 8 vizsgálta az expresszió változását 96 jelölt gén között fiatal és öreg ISC, valamint egérből származó felnőtt enterociták között kvantitatív RT-PCR-rel, és számos olyan változást azonosított, amelyet nem. Jelentős különbségeket észlelünk megközelítéseinkben, nevezetesen Moorfield et al. összehasonlítva a fiatalabb (2–4 hónapos) és az idősebb (18–22 hónapos) egereket, míg a középkorú egereket (
8 hónap), szemben az öreg egerekkel (
27 hónap), ezért megvizsgálják a késői öregedésre jellemző folyamatokat.
Egy humán vizsgálatban a bélpermeabilitás korhoz kapcsolódó változásai társultak a claudin-2 mRNS expressziójának up-szabályozásához, bár a claudin-2 fehérje eloszlásában nem voltak változások 5. Elemzéseink során nem figyeltünk meg változásokat a claudin gén expressziójában. Mivel az egerek és az emberek élettartama, táplálkozása, mikrobiómája és genomszerkezete eltér, az öregedésnek az emberi bélhám génexpressziójára gyakorolt hatása további kutatásra szorul.
Összefoglalva: adataink hangsúlyozzák a génexpressziós program robusztusságát, kevés transzkripciós változással és bizonyítékkal a szoros poszt-transzkripciós kontrollra az öregedő bélben. Bár a hám transzkripciója nagyon ellenálló az öregedéssel szemben, az életkorral összefüggő változások az egész emésztőrendszerben bekövetkeznek, amint azt a 29., 40–43. Mikrobiómás összetétel és az immunrendszer összetevői korábban bemutatták (áttekintve ebben a tanulmányban 44).
Mód
Minden kísérlethez C57BL/6 háttérrel rendelkező hím egereket használtunk. A C57BL/6 hím egerek egészséges idős telepét specifikus kórokozótól mentes (SPF) körülmények között hozták létre, és a helyi és a belügyminisztérium szabályainak és az ARRIVE irányelveinek megfelelően tartották fenn. Az összes egeret ad lib-et etették. Az RNSseq-re szánt állatok átlagosan 118 hetesek voltak az idős kohorszban (115 119 és 122), és 33 hetesek voltak a fiatal kohorszban (31,33 és 35). Az RT-qPCR esetében a régi kohorsz átlagosan 109 héten (105–118, 11 egér), a fiatal kohort átlagosan 37. héten (25–43, 10 egér). Az RNAseq kohorszban levő egerek Lgr5-GFP pozitívak voltak az ISC-izolálás megkönnyítése érdekében (Lgr5-EGFP-IRES-creERT2 egerek, a Jackson Laboratory cégtől). A kísérleti protokollokat a Babraham Research Campus helyi etikai felülvizsgálati bizottsága és a Belügyminisztérium hagyta jóvá (PPL 70/8994 és 80/2529).
Sejtkivonás vékonybél kriptákból és bolyhokból
Az egereket CO2 hatásának kitéve, majd a méhnyak elmozdulását elöltük. A vékonybelet kivontuk, hosszanti irányban kinyitottuk és foszfáttal pufferolt sóoldattal (PBS) mostuk, majd a kriptát és a villus frakciókat szobahőmérsékleten izoláltuk a 13. leírás szerint. A bél kriptákból az egysejtű szuszpenziók előállításához a Dispase II-t (Sigma D4693, 0,05 mg/ml végkoncentráció) használtuk a DNáz (Qiagen 79254, 20 Kunitz U/ml végkoncentráció) és a kollagenáz (Sigma C7657, 0,15 mg/ml) mellett. végső koncentráció).
RNS izolálása AE-ből, ISC-ből és az egész kriptahámból
Az RNAseq és RT-qPCR villussejt-szuszpenzióit, valamint az RT-qPCR kriptasejt-szuszpenzióit 2% magzati szarvasmarha-szérumban (FBS)/PBS-ben festettük 1: 200 arányú APC-konjugált anti-Epcam antitestekkel (CD326, eBioscience 17-5791). -82), 1: 1000 AF488-konjugált anti-CD45 antitestek (Biolegend 103122) és 1: 1000 AF488-konjugált anti-CD31 antitestek (Biolegend 102414) 15 percig szobahőmérsékleten, háromszor mostuk és 2% FBS/PBS 3,2 µg/ml ROCK-inhibitorral (Y-27632, Sigma). Az összes sejtpreparátumot 4 ’, 6-diamidino-2-fenilindollal (DAPI) festettük a válogatás előtt. Az Epcam magas CD31 - CD45 - DAPI - sejteket BD Aria III SORP sejtválogatón válogattuk 100 µM-os fúvókával (S1A, C ábra). Az RNSseq ISC-t (GFP magas DAPI -) az Lgr5-GFP + egerek kriptaszuszpenzióiból izoláltuk, és a fentiek szerint dolgoztuk fel, kivéve a festési lépést (S1B ábra). 60 000–100 000 sejtet rendeztek RLT pufferbe a későbbi RNS-izoláláshoz, a gyártó protokollja szerint, az oszlopon lévő DNS-emésztéssel az RNeasy Micro kit-lel (Qiagen 74004). Az RNS mennyiségét és minőségét Bioanalyzer Eukaryote Total RNS Pico assay-vel (Agilent Technologies, 5067–1513) mértük.
RNAseq
Bioinformatikai elemzés
Az RNAseq leolvasásokat Trim Galore-val (0.4.4 verzió) vágtuk le, mielőtt a HiSat2-vel (2.1.0 verzió) leképeztük volna az egér referencia genomjára GRCm38/mm10. Az egyedileg feltérképezett RNAseq adatokat a SeqMonk 1.42.0 verziójával elemeztük. Az olvasásszámokat a SeqMonk-ban megvalósított RNAseq kvantitációs csővezeték segítségével számszerűsítettük, az egyesített transzkriptumokat exonokon keresztül számszerűsítve az összes könyvtár 75 százalékos normalizálásával. A differenciálisan expresszált géneket a nyers leolvasási mennyiségi kvantitációból extraháltuk a SeqMonkban megvalósított többszörös teszteléssel korrigált DESeq2 45 algoritmussal. A DEG-k GO-dúsítási elemzését g: profiler 46-mal végeztük a bélben expresszált gének háttérlistájával szemben, amint azt az 1. kiegészítő táblázat részletezi .
RT-qPCR
32 célpont egy részét választottuk ki biológiai jelentőségük alapján a fiatal és idős állatok között differenciáltan expresszált 49 génből (DESeq2, FDR 2), amelyet az NCBI Primer-BLAST szoftver tervezett egér mRNS templáttal. A teljes RNS-t reverz átírással írtuk le és kvantitáltuk a Luna Universal One-Step RT-qPCR kit (NEB E3005) és a BioRad thermocycler CFX384 készülékkel. A Cq-értékeket mintánként normalizáltuk az Actg1-re, majd célonként az átlagos céljelre az egyes sejttípusokban. Az öreg és fiatal állatok közötti differenciál expressziót külön-külön értékeltük az ISC és az AE esetében, kétirányú ANOVA alkalmazásával, Holm-Sidak többszörös tesztkorrekcióval, szignifikancia küszöbérték P 47 (3. kiegészítő táblázat).
Neutrofil/monocita mennyiségi meghatározás
Immunfluoreszcens festéseket készítettünk és konfokális képalkotást végeztünk a 48. leírás szerint, primer mieloperoxidáz (MPO) antitesttel (R&D AF3667, 5 µg/ml) 2 órán át szobahőmérsékleten inkubálva, és másodlagos kecskeellenes AlexaFluor 488 (Invitrogen A11055, 10 µg/ml) éjszakán át 4 ° C-on inkubáltuk. A permeabilizációt 4 percig végeztük 0,3% -os TritonX/PBS-ben. 2% BSA/2% szamár szérum/PBS-t használtunk blokkoló oldatként. Leleplezés nem történt. A képalkotást Zeiss 780 konfokális mikroszkóppal végeztük 20 × Plan Apo légobjektívvel, optimális felbontási beállításokkal, 2x vonalas átlagolással. 5 × 2 µm-es optikai halmokat dolgoztunk fel maximális intenzitású fedvényként (optikai vastagság 8 µm. Kontrasztfokozást (küszöbölő háttérjel) hajtottunk végre a FIJI 47-gyel. Három technikai replikátumot (ugyanazon a mintán belül különböző bélpozíciók) mértünk és átlagoltunk mintánként. Átlagos teljes képalkotó kriptaterület mintánként: 0,16 mm2, villus terület 0,18 mm 2. A kriptát és a villus területét FIJI-vel mértük, a pozitív sejteket manuálisan számláltuk a háttérkorrekció után.
- A teljes genom szekvenálása azonosítja az új ABCB7 génmutációt az X-hez kapcsolt veleszületett kisagyhoz
- Teljes súly átkeretezés program - figyelmes élethipnózis
- Az emberi növekedési hormon receptor (hGHR) Gene V2 promóter transzkripciós szabályozása
- A legjobb életmód - Fogyás csoport program
- Átalakítási program 4 részből álló fogyás; Bélegészségügyi rendszer