A teljes genom szekvenálása azonosítja a regényt ABCB7 génmutáció X-kapcsolt veleszületett kisagyi ataxia esetén a mongol ősök nagy családjában
Tárgyak
Absztrakt
Bevezetés
X-kapcsolt veleszületett kisagyi ataxiák
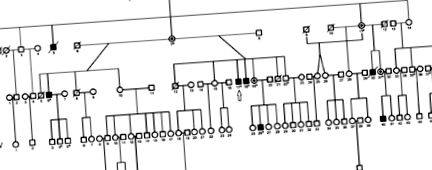
A Buryat család genealógiája. A teljes genom szekvenálását egy nyíllal kijelölt beteg esetében végeztük; szilárd szimbólumok jelzik az érintett egyéneket; pontozott körök - kötelező heterozigóta hordozó nőstények; nyitott szimbólumok - nem érintett egyének; elvágott szimbólumok - elhunyt alanyok; csillagok - egyének, akiket genotipizáláshoz használtak. 6.
Klinikai leírás
A mágneses rezonancia képalkotás (MRI) vizsgálatai a burjati törzskönyvben érintett férfiaknál a kisagyféltekék és a vermisek hipopláziáját tárták fel. Az összes érintett családtag gyakori neurológiai tünetei a fejlődés késleltetése, a beszéd és koordináció nehézségei, a végtagok és a csonkok ataxiája és a dysarthria voltak (1. kiegészítő táblázat). A vizsgált betegek 15 hónapos koruk előtt semmilyen időben nem tudtak ülni támasz nélkül, vagy 7 éves koruk előtt önállóan járni, és 4 éves koruk előtt kimondani első szavaikat. A betegek többségénél nystagmust, oftalmoplegiát és fokozott ínreflexeket figyeltek meg. A törzskönyvből származó összes betegnél nem voltak jelei memóriának vagy kognitív károsodásnak. 6.
A szideroblasztos vérszegénység vagy a réz rendellenesség jellemzőit nem sikerült kimutatni. A Buryat törzskönyvből származó X-kapcsolt ataxiában szenvedő beteg (III-18) hematológiai vizsgálata nem mutatott eritropoetikus sejtek rendellenességeit vagy vasszemcsék felhalmozódását. A hemoglobin értékek átlagosan 149 g/l (normál tartomány, 130–180 g/l), a színindex átlagosan 1,0 (normál tartomány, 0,80–1,05), az eritrocita ülepedési teszt átlagosan 3 mm/h (normális tartomány, 0–15 mm/h) és a fehérvérsejtszám általában normális volt. Minden biokémiai teszt normális volt, kivéve a kissé megemelkedett bilirubinszintet, 14,5 mg/l (normál tartomány, 5–12 mg/l), és a vizeletelemzés nem volt figyelemre méltó. 6.
Anyagok és metódusok
Valamennyi alany vérmintáit korábban, megfelelő tájékozott beleegyezéssel vették össze, és ezekről az adatokról már beszámoltak. 6 Nem találtak rokonságot a törzskönyvben (1. ábra). Genom könyvtárat készítettünk a III-17 beteg 2 μg DNS-mintájából, a Paired-End DNA Sample Prep Kit (Illumina, San Diego, CA, USA) protokolljának betartásával. Nagy teljesítményű genom szekvenálást végeztek az Illumina HiSeq 2000 platformon, a GRCh37 genom legalább 14-szeres lefedettségi mélységével. A genomelemzést a csoportunk által tervezett 'ngs-pipeline' szoftver segítségével végeztük: http://rogaevlab.ru/ngs-pipeline. Az azonosított ritka variánsokat benyújtották az NCBI ClinVar-hoz, és a www.ncbi.nlm.nih.gov/clinvar/?LinkName=orgtrack_clinvar&from_uid=505407 címen érhetők el.
Az apaságot STR (rövid tandem ismétlés) elemzéssel határoztuk meg házi STR markerekkel és PowerPlex 16 rendszerrel (Promega, Madison, WI, USA).
Eredmények
Az egész genom szekvenálása
Változatok azonosítása ABCB7 és ATP7A gének. A mutációkat tartalmazó genomi régió ábrázolása IGV (Integrative Genomics Viewer) eszközökkel: (a) 16. exon ABCB7 gén (hg19 chrX: g.742734204C> T), (b) A 41,4 kb méretű törölt régiója ATP7A gén (hg19 chrX: g.77190006_77231471del), beleértve a 2. exont is; függőleges nyilak (a) és (b) jelezte a ABCB7 és ATP7A gének. (c) A jelölt mutációk igazolásának szekvenciaellenőrzése a 16. Exonban ABCB7 gén. (d) A törlés validálására szolgáló primerek rendszere ATP7A gén. (e) A validálás szekvenálása Sanger szekvenciával a törlés során ATP7A gén a betegeknél. (f) A PCR termékei ATP7A génből törölt régió: M, DNS létra; R, a törlési régióval szomszédos „jobb” irányban; A régió belső törlése; L, a bal oldali deléciós régióval rendelkező bal oldalon (R, In, L - termékek vannak jelen, ha hiányzik a deléció; Del - termék van jelen, ha deléció van a DNS-mintában).
ABCB7 gén
Nemnévtelen missense variáns hg19 chrX: g.74273420C> T a 16. exonban (AF241887) ABCB7 gén (gén azonosító: 22) a glicin szérinnel történő szubsztitúciójához vezet az ATP-kötő 7-es kazetta tag fehérje 682. pozíciójában (NP_001258625, UniProt O75027) (2a. és c. ábra). Mivel az azonosított variáns a 16 exon első kódoló triplettjén belül egy akceptor-splice-hely közelében helyezkedik el, megvizsgáltuk, hogy a szubsztitúció új erős splice-hely kialakulásához vezethet-e. A feltételezett splicing helyeket tesztelő bioinformatikai eszközök konstitutív, kazettás, belső akceptorok és külső akceptorok nukleotid frekvenciái alapján az egyes helyek helyzetében (−20 és +3 között) azt jelezték, hogy nincsenek splicing változások a 18, 19 mutáns allél számára (5. kiegészítő táblázat).
Számos ismert átirata van ABCB7 a fehérje izoformákat kódoló gén, és az azonosított variáns hatással van az összes előre jelzett fehérje izoformára. Az ABCB7 fehérje domének felépítése és funkciója nem teljesen ismert. A mutáció az ABCB7 fehérje (NP_001258625, UniProt O75027) nukleotidkötő doménjében (NBD) található, és ennek a régiónak az ATM1 élesztő ortológiában történő megzavarása a fehérje funkciójának elvesztéséhez és a vas felhalmozódásához vezet a mitokondriumban (3A. Kiegészítő ábra) . 20 A Phyre2 bioinformatikai program segítségével tanulmányoztuk az ABCB7 fehérjét hordozó mutáns szerin variáns szerkezeti változásait. 21 Összehasonlító elemzés
A szupercsalád ABC transzporterfehérjék 1000 paralóg és ortológikus aminosav-szekvenciája erősen konzervált glicinváltozatot mutat a 682. pozícióban (3. ábra). A szerin szubsztitúció rotációhoz vezet a mozdulatlan fehérje oldalon. További bioinformatikai előrejelzéseket hajtottak végre erre a mutációra. A mutáns variáns ABCB7 A gént a SIFT 22 károsnak, a PolyPhen valószínűleg károsnak (0,996) értékelte. 23 A mai napig további négy mutációt találtak a ABCB7 szideroblasztos vérszegénységgel és kisagyi ataxiával társított gén (3A. kiegészítő ábra).
A mutációs régió evolúciós elemzése. A missense mutáció ABCB7 és törlés ATP7A a gének megváltoztatják a gerincesekben nagyon konzervált aminosav-szekvenciákat. Az evolúciós aminosavkonzerváció szintje, amelyet a nem konzervált fehér fehértől az erősen konzerváltnál a sötétszürke árnyékolás mutat. Az illesztéseket az UCSC Genome Browser (Multiz Alignments of 100 Gerte Gerates), 48 ClustalW-ből szereztük be. 49
ATPáz, Cu 2+ szállító, alfa polipeptid (ATP7A) gén
Mutációk a ATP7A gént a rézhiány/Menkes-kór (MD; OMIM: 309400) kapcsolták össze, amelyet súlyos mentális retardáció, görcsrohamok, növekedési retardáció, hipotermia, perverz vagy acélos haj, a bőr és az ízületek lazasága és a korai életkor mortalitása jellemez. Az enyhe occipitalis kürt szindróma (OHS) szintén összefüggésbe hozható a ATP7A gén (OMIM: 304150). Ennek ellenére ezeknek a betegségeknek egyik klinikai jellemzőjét sem fedezték fel olyan burjati betegeknél, akiknek hiányzott a ATP7A gén. Feltételeztük, hogy a deléciónak viszonylag szerény, ha van ilyen hatása lehet a klinikai fenotípusra ezeknél a betegeknél, ami nem függ össze a korábban leírt klinikai tünetekkel a ATP7A gén.
PGAM4 gén
Genetikai heterogenitás
A mutációt/deléciót a ABCB7 és ATP7A gének mind a négy vizsgált betegségben érintették ugyanabban a diagnózisban a Burját családból származó férfi rokonokat, négy tünetmentes nőstény rokonban pedig az érintett fiak (6. kiegészítő táblázat). A mutáció/deléció minden vizsgált férfiban hemizigóta állapotban volt, és minden női hordozóban heterozigóta volt. Mind a négy vizsgált, azonos törzskönyvből származó egészséges férfi hemizigóta volt a vad típusú allélokra nézve.
Továbbá négy, egymással nem rokon betegcsoportot teszteltünk, akiknek nagyon hasonló klinikai megnyilvánulása volt, és kizárólag velük együtt előforduló veleszületett nonprogresszív ataxia diagnosztizálására került sor (7. kiegészítő táblázat). Az összes exon elemzése ABCB7 gén közvetlen szekvenálásával (8. kiegészítő táblázat) nem mutattak különbségeket az emberi referencia genom szekvenciákkal összehasonlítva. Hasonlóképpen nem találtunk az exon 2 exonjának törlését ATP7A gén és retrogén PGAM4 e családokban érintett férfiaknál. Ezen családok genotipizálása az NM_001001344.2 mutációhoz: c.3321G> A (p.Gly1107Asp) a ATP2B3 gén, amelyet korábban a cerebellum ataxia eseteiben írtak le, 4 szintén nem mutatott különbséget a vad típusú referencia allélhoz képest.
Vita
A nem progresszív ataxiák közös jellemzője a korai motoros fejlődés észrevehető késleltetése és a motoros koordináció zavara az élet során a cerebellaris hypoplasia/atrophia következtében. Itt egy újszerű mutációról számolunk be ABCB7 ez a cerebellaris hypoplasia/atrophia és a nonprogresszív ataxia okozó tényezője, így tovább bővíti a cerebelláris ataxiához kapcsolódó génmutációk listáját. Korábban négy különböző mutációt találtak a ABCB7 cerebellaris patológiához és sideroblastos anaemiához kapcsolódtak. Szideroblasztos vérszegénységben a vas nem épül be a hemoglobinba, mivel a csontvelőben egészséges vörösvértestek előállításához szükséges. Esetünk figyelemre méltó jellemzője, hogy a betegek nonprogresszív ataxiában szenvednek, a szideroblasztikus vérszegénység klasszikus tünetei nélkül. Csábító spekulálni, hogy ez a mutáció egyedi helyének köszönhető ABCB7. Alternatív megoldásként az ATP7A N-terminális részének törlése potenciálisan szerepet játszhat a genetikai faktor módosításában.
Az ABCB7 fehérje hat transzmembrán doménből és két intramitokondriális régióból áll, amelyek NBD-t alkotnak (3A. Kiegészítő ábra). A mitokondriális belső membránban, valamint a citoplazmatikus membránon és a citoplazmában lokalizálódik. 30 ABCB7 fontos szerepe van a citoszolos és mitokondriális Fe-S klaszterfehérjék érésében, befolyásolva a citokróm működését c, NADH dehidrogenáz (nikotinamid-adenin-dinukleotid, redukált forma) és szukcinát-dehidrogenáz. Részt vesz a DNS-javításban és a nukleotid-excízió helyreállításában, az oxidatív DNS-károsodás helyreállításában, a riboszóma biogenezisében és a tRNS tiomodifikációjában. 31 Az ABCB7 fehérje mutációja betegeinkben a belső mitokondriális tér felé néző doménben helyezkedik el. Az összes eddig leírt, refrakter vérszegénységet és ataxiát okozó mutáció a transzmembrán domének közelében vagy azokban lokalizálódik. 20, 32, 33, 34, 35, 36 Mint ilyen, ez a mutáció befolyásolhatja aktivitását vagy más társfaktorokkal való kötődését, mivel az ABCB7 szabályozza a mitokondriális vastranszportot és a protoporfirin kötődést a hemoglobin szintézis során. 20,32,33,36
A mentális és neurológiai tünetek változatosak azoknál a betegeknél, akiknél leírt mutációk vannak a ABCB7 gén. Néhány beteg esetében leírták a depressziót, a kognitív hanyatlást vagy az értelmi fogyatékosságot, sőt a skizofréniát (9. táblázat). A Buryat család érintett tagjainak neurológiai megnyilvánulásai mutatnak néhány közös vonást a ABCB7 mutációval járó tünetek más esetekben, például kisagyi ataxia, izomgyengeség hiánya és érzéshiány (9. kiegészítő táblázat). Amint azt az MRI mutatja a Buryat család esetében, az agy atrófiája leginkább a kisagyféltekékben és a vermisekben lokalizálódott. Más régiókban azonban nem sikerült kimutatnunk a rendellenességeket, beleértve a más esetekben bemutatott pons-t és velőt. 34
Az MD betegek 15% -a. 39 Csábító tehát feltételezni, hogy a hímivarú férfiaknál ATP7A Az első MBD törlése esetén a fennmaradó öt rézkötő domént hatékonyan felhasználják a funkció fenntartására ATP7A.
Nem zárhatjuk ki, hogy az ABCB7 diszfunkciója és az ATP7A szerényen módosított aktivitása kölcsönösen befolyásolhatja egyes szövetsejtek homeosztázisát, mivel az ABCB7 károsodása vasionok felhalmozódását okozhatja a mitokondriumokban, míg az ATP7A transzporter mutációja befolyásolhatja a rézion szintjét a sejt citoplazma. A vashiány növeli az ATP7A 40 bélszöveti expresszióját és az agy rézszintjét. A rézről ismert, hogy szabályozza a vas felhasználását a csontvelőben és a hemoglobin szintézisében. 42, 43, 44, 45 Fontos, hogy mindkettő ABCB7 és ATP7A gének expresszálódnak a 26, 46 csontvelőben és a különböző szövetekben (Illumina Human Body Map 2.0), 26, 46, 47 (5. kiegészítő ábra). Tekintettel a réz és a vas felvételének kölcsönös szabályozási hatására, a Buryat-betegeknél leírt klinikai fenotípus függhet a gének genetikai hibáinak feltételezhető kölcsönhatásától az MBP-k esetében egyes szövetsejtekben, ami egy érdekes szindróma esete, amely X-ként kapcsolva öröklődik monogén tulajdonság. Azt állítjuk azonban, hogy ezeknél a betegeknél a cerebellaris hypoplasia és az ataxia klinikai fenotípusának fő okát ez az új mutáció okozza. ABCB7 gén.
- A transzkriptómanalízis robusztus génexpressziós programot azonosít az egér béljében
- A vércsoport-diéta leromlott, vagy géneledelt tartalmaz
- Mi a dinamikus szekvenáló jóga
- A szovjet regény A történelem mint rituálé - PDF ingyenes letöltés
- Egy új mobil Diabetes Prevention Program szállító platform fogyás hatékonysága emberrel