A vesefibrózis útjai és a mátrixforgalom modulációja kísérleti hiperkoleszterinémiában
A Belgyógyászati Osztály, a Nefrológiai és Hipertónia (ARC, OPM, XZ, SCT, LOL) és a Kardiovaszkuláris Betegségek (MR-P., AL, LOL) és a Laboratóriumi Orvostudomány és Patológia (JPG) osztályától, Mayo Klinikai Főiskola Orvostudomány, Rochester, Minn.
A Belgyógyászati Osztály, a Nefrológiai és Hipertónia (ARC, OPM, XZ, SCT, LOL) és a Kardiovaszkuláris Betegségek (MR-P., AL, LOL) és a Laboratóriumi Orvostudomány és Patológia (JPG) osztályából, Mayo Klinikai Főiskola Orvostudomány, Rochester, Minn.
A Belgyógyászati Osztály, a Nefrológiai és Hipertónia (ARC, OPM, XZ, SCT, LOL) és a Kardiovaszkuláris Betegségek (MR-P., AL, LOL) és a Laboratóriumi Orvostudomány és Patológia (JPG) osztályából, Mayo Klinikai Főiskola Orvostudomány, Rochester, Minn.
A Belgyógyászati Osztály, a Nefrológiai és Hipertónia (ARC, OPM, XZ, SCT, LOL) és a Kardiovaszkuláris Betegségek (MR-P., AL, LOL) és a Laboratóriumi Orvostudomány és Patológia (JPG) osztályából, Mayo Klinikai Főiskola Orvostudomány, Rochester, Minn.
A Belgyógyászati Osztály, a Nefrológiai és Hipertónia (ARC, OPM, XZ, SCT, LOL) és a Kardiovaszkuláris Betegségek (MR-P., AL, LOL) és a Laboratóriumi Orvostudomány és Patológia (JPG) osztályából, Mayo Klinikai Főiskola Orvostudomány, Rochester, Minn.
A Belgyógyászati Osztály, a Nefrológiai és Hipertónia (ARC, OPM, XZ, SCT, LOL) és a Kardiovaszkuláris Betegségek (MR-P., AL, LOL) és a Laboratóriumi Orvostudomány és Patológia (JPG) osztályától, Mayo Klinikai Főiskola Orvostudomány, Rochester, Minn.
A Belgyógyászati Osztály, a Nefrológiai és Hipertónia (ARC, OPM, XZ, SCT, LOL) és a Kardiovaszkuláris Betegségek (MR-P., AL, LOL) és a Laboratóriumi Orvostudomány és Patológia (JPG) osztályától, Mayo Klinikai Főiskola Orvostudomány, Rochester, Minn.
A Belgyógyászati Osztály, a Nefrológiai és Hipertónia (ARC, OPM, XZ, SCT, LOL) és a Kardiovaszkuláris Betegségek (MR-P., AL, LOL) és a Laboratóriumi Orvostudomány és Patológia (JPG) osztályától, Mayo Klinikai Főiskola Orvostudomány, Rochester, Minn.
Ön a cikk legfrissebb verzióját nézi. Előző verziók:
Absztrakt
A hiperkoleszterinémia gyakori kardiovaszkuláris kockázati tényező. A középkorú felnőtt populáció körülbelül 50% -ának teljes koleszterinszintje meghaladja a kívánt szintet, 1 az ateroszklerózis progressziójának erős, független előrejelzője. 2 A dislipidémia gyakran kíséri és súlyosbítja a korai és előrehaladott vesebetegséget. 3,4 Korábban sertésmodellben kimutattuk, hogy egy 10-12 hetes étrend által kiváltott hiperkoleszterinémia, a korai érelmeszesedés, a veseműködési zavarok, a gyulladások és a fibrózis kockázati tényezője, amelyet részben a megnövekedett oxidatív stressz közvetít. 5–8 A megnövekedett oxidatív stressz hozzájárulhat a vesekárosodáshoz a hiperkoleszterinémiában és az ateroszklerózisban a reaktív oxigénfajok (ROS) fokozott generációja és az LDL-ek oxidációja révén, 8–12, amelyek endotheli diszfunkciókat indukálhatnak, és aktiválhatják a redox-érzékeny növekedési faktorokat és citokineket. Ezenkívül a lipidfelhalmozódás vagy a sejtkárosodás elősegítheti a veseműködési zavarokat, a glomeruláris sérüléseket és az intersticiális fibrózist. 13,14
Egy dinamikus és komplex folyamat, amelyben a szövetek növekedését a lebomlás és az eltávolítás ellensúlyozza, megőrzi a vese normál szerkezetét, és részben modulálható az endotheliumból származó tényezők által. A vesebetegséget és a normális vesefejlődést az extracelluláris mátrix (ECM) magas forgalmának jellemzője. Számos fibrogén tényező kapcsolódik ehhez a folyamathoz, például a növekedési faktor-β (TGF-β), az angiotenzin II és az endothelin-1 (ET-1) transzformálása, 15 míg a vese ECM lebomlásának fő szabályozói a mátrix metalloproteinázok (MMP) ) család. Korábban megfigyeltük, hogy a szűkületes vesében az egyidejű hiperkoleszterinémia felerősíti a vesekárosodást és a hegesedést, 9,12, de a dyslipidaemia modulálja a vesefibrózist nem teljesen határozták meg. Ezt a tanulmányt annak a hipotézisnek a tesztelésére tervezték, miszerint a hiperkoleszterinémia nemcsak a fibrogén aktivitást segíti elő, hanem a vese MMP-t is csökkenti, ezáltal tompítja az ECM lebomlását és megkönnyíti a vese hegesedését. Ezeket a mechanizmusokat tovább lehet kezelni egy étrendi lipidcsökkentő beavatkozással.
Mód
Az intézményi állatgondozási és -használati bizottság minden eljárást jóváhagyott. Huszonegy házi keresztezett sertést (65-75 kg) vizsgáltak 16 hetes megfigyelés után. A sertés modellt a sertés és az emberi kardiovaszkuláris és vesefiziológia, a lipidprofil és a testméret hasonlósága miatt választották ki. 14 sertésben a korai érelmeszesedést szimulálták úgy, hogy 2% magas koleszterinszintű (HC) diétával etették őket (TD-93296; Harlan-Teklad). Ezek közül 6–9 7 állatot 10 hétig etettek HC-étrenddel, majd a fennmaradó 6 héten át normál sertéshúsra váltottak (HC-N; n = 7), míg a másik 7-ben a HC-étrend a teljes 16 héten át fennmaradt (HC-HC; n = 7). Korábban kimutattuk, hogy a sertésekben a 10-12 hetes HC-étrend endotheliális diszfunkciót és a 8,17,18 káros mechanizmusok aktiválódását eredményezte obstruktív ateroszklerotikus plakkok hiányában a különböző vaszkuláris ágyakban (pl. Aorta, vese, ill. koszorúerek), hasonlóan a korai érelmeszesedésben szenvedő emberekhez. 19 További, 16 hétig normál táplálékkal etetett sertések csoportját használtuk kontrollként (normál; n = 7). 10 és 16 hetes táplálkozás után az összes sertésből vénás vérmintákat vettünk, és in vivo és in vitro vizsgálatokat végeztek 16. héten.
Vese fehérje expresszió
Western Blotting
A standard blotolási eljárásokat homogenizált vesefeldolgozásban (főleg kortikálisban) hajtottuk végre, az előzőekben leírtak szerint. 6,9 Részletekért lásd az online mellékletet, amely a http://www.hypertensionaha.org címen érhető el.
Valós idejű kvantitatív PCR
A teljes RNS-t a vesékből izoláltuk TRIZOL (InvitrogenTM) módszerrel. A cDNS-t az InvitrogenTM SuperScripTM első szálú szintézis készlet segítségével szintetizáltuk, amint azt a közelmúltban leírtuk. 24 A prepro – ET-1, –ET-A és –ET-B receptorok, valamint az MMP-2, MMP-9, TIMP-1 és TIMP-2 mRNS, RT-PCR (DNS motor OPTICON) expressziójának vizsgálata; MJ Research) SYBR Green JumpStartTM alkalmazásával végeztük Taq ReadyMixTM készlet (Sigma). Részletekért lásd az online mellékletet.
A CD-3 és az ED-1 immunhisztokémiáját deparaffinizált veseszöveten és IV kollagén esetében fagyasztott keresztmetszetben végeztük. 12 Részletekért lásd az online mellékletet.
Zselatin szimbólum
Az MMP-2-t és az MMP-9-et zselatinolitikus aktivitásra vizsgáltuk zselatin-zymográfiával, standard eljárásokat követve. Részletekért lásd az online mellékletet.
Adatelemzés
Az aorta, a vesekéreg, a medulla és a papilla EBCT képein kézzel kiválasztott érdeklődési körzeteket választottunk ki, és ezek sűrűségéből mintát vettünk. Az egyvese RBF-t, a GFR-t és a vese regionális perfúzióját (ml/g/perc/cm3 szövet) az Ach infúzió előtt és után kiszámítottuk korábban validált módszerekkel. 7,8,20,21 A részletekért lásd az online mellékletet.
Szövettan
A vese közepes-vidám keresztmetszeteit (beleértve a kortikális és medulláris régiókat) és a transzmurális bal kamrai szívizomot (állatonként 1) 5,6,8,9-ben vizsgáltuk, mivel a vaszkuláris közeg/lumen arányt 20-30 véletlenszerűen értékeltük. kiválasztott intrarenalis és intramyocardialis erek, a korábban leírtak szerint. 6,8 A részleteket lásd az online mellékletben.
Statisztikai analízis
Az eredményeket átlag ± SEM-ben fejezzük ki. A csoportokon belüli összehasonlításokat párosított Student alkalmazásával végeztük t tesztet és az ANOVA-t használó csoportok között, Bonferroni-korrekcióval több összehasonlításra, majd párosítatlan Student t teszt. Nem normális eloszlás esetén a csoportok közötti összehasonlításhoz nem-paraméteres (Wilcoxon/Kruskal – Wallis) teszteket alkalmaztunk. A statisztikai szignifikancia elfogadott a P≤0,05.
Eredmények
10 hetes HC-diéta után a teljes és az LDL-koleszterin, valamint az Ox-LDL szint szignifikánsan és hasonlóan emelkedett a HC-HC és HC-N csoportokban a normál csoporthoz képest, míg a SOD aktivitás szignifikánsan alacsonyabb volt (táblázat). Mindezeket normalizálták HC-N-ben, miután 6 héten át váltottak a normál étrendbe, de továbbra is magasak voltak a HC-HC-ban. A HDL-koleszterin hasonlóan emelkedett a HC-HC-ban és a HC-N-ben a kontrollokhoz képest a 10. héten, amint azt korábban bemutattuk, 25, és a HC-HC-ban is magas maradt a 16. héten. Ezenkívül 16 hét elteltével az összes izoprostán csak HC-HC-ban emelkedett szignifikánsan, míg az átlagos artériás nyomás nem volt különbözõ a csoportok között (táblázat). Korábban bemutattuk modellünkben, hogy a 12 hetes HC-diéta következetesen nem növelte a vérnyomást sem. 8,17,25
Szisztémás jellemzők és a bazális egyvese hemodinamika (átlag ± SEM) normál (N), HC (HC-HC) és HC-N sertésekben
A vese endothel funkciója és az oxidatív stressz
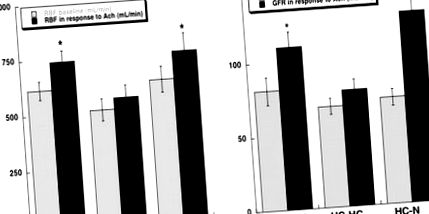
A protokoll befejezése után mért bazális egyvese térfogat, RBF, GFR és regionális perfúzió hasonló volt a csoportok között (táblázat). Az Ach infúziója normál és HC-N állatokban az RBF, a GFR hasonlóan szignifikáns növekedésével járt (1. ábra; P≤0,05 a kiindulási értékhez viszonyítva), és a kérgi perfúzió (5,5 ± 0,5, illetve 5,7 ± 0,5 ml/g/perc/cm3 értékig; P≤0,05 a kiindulási értékhez viszonyítva), míg a medulláris és papilláris perfúzió szignifikánsan csak normál állatoknál emelkedett meg (P
1.ábra. Az RBF (a) és a GFR (b) a kiindulási helyzetben (szürke sávok) és az Ach (ml/perc; fekete sávok) hatására normál, hiperkoleszterinémiás (HC-HC) és HC sertésekben a lipidcsökkentés (HC-N) után. Az étrend megfordítása normalizálta a tompa reakciókat HC-HC-ban. *P
A tompított vesefunkcióval együtt HC-HC-ban a NAD (P) H-oxidáz (gp91phox és p22phox alegységek) expressziója megnőtt, míg az eNOS gyengült a normál állatokhoz képest (2a. Ábra), ami a szuperoxid-képződés növekedésének lehetőségére és csökkent NINCS biohasznosulás. Ezenkívül a HC-HC szignifikáns növekedést mutatott a prepro – ET-1 és –ET-A receptorok vese mRNS-expressziójában, ami az endogén ET-rendszer felszabályozására utal (2b. Ábra).
2. ábra. A gp91phox, p22phox és eNOS vesefehérje-expressziója és prepro – ET-1, –ET-A és –ET-B receptorok (b) mRNS-expressziója normál, hiperkoleszterinémiás (HC-HC) és hiperkoleszterinémiás sertésekben lipidszint-csökkentő (HC-N). A diétás lipidcsökkentő beavatkozás normalizálta a gp91phox, p22phox és eNOS expressziót, valamint csökkentette a prepro – ET-1 és –ET-A receptorok mRNS-ét, ami az érszűkület potenciáljának csökkenésére utal. *P
Vesemorfológia és fibrogén tényezők
A HC-HC vesék a CD-3 + és ED-1 + gyulladásos sejtek fokozott perivaszkuláris és tubulointerstitialis felhalmozódását mutatták, ami nyilvánvalóbb volt a kéregben (3a. És 3b. Ábra). Ezenkívül a HC-HC szignifikáns növekedést mutatott a kortikális perivaszkuláris és tubulointerstitialis fibrózisban (kollagén IV és trichrom; 3c és 3d ábra), valamint megemelkedett az interlobuláris és íves artéria közeg/lumen aránya (3c ábra, alja). A glomerulosclerosist egyetlen csoportban sem figyelték meg.
3. ábra. Reprezentatív vesefestés (× 40) a CD-3 (a), az ED-1 (b), a perivascularis kollagén IV lerakódás (d) és a trichrom (c; × 20) és a vesemorfometria szempontjából normál, hiperkoleszterinémiás (HC-HC) és hiperkoleszterinémiás sertések lipidcsökkentés után (HC-N). A diéta okozta hiperkoleszterinémia növelte az intrarenalis CD-3 + (barna festés; nyíl) és az ED-1 + (fekete festés; nyíl) gyulladásos sejtek jelenlétét, valamint a perivaszkuláris kollagén felhalmozódást (c, vastag nyíl), a tubulointerstitialis fibrózist (d ) és a közeg/lumen arány (c, alsó), amelyek a lipidcsökkentő étrend után megfordultak. *P
Extracelluláris mátrix
A profibrotikus TGF-β, a Smad-2/3 és a Smad-4 mediátorai, valamint a kollagén IV vesekérgi expressziója mind a HC-HC-ban szignifikánsan megnőtt, míg a PAI-1 változatlan maradt (4. ábra). Ezzel szemben az MT1-MMP, az MMP-2 és az MMP-9 fehérje expressziója HC-HC-ban gyengült, amelyet a TIMP-1, TIMP-2 és TSP 1/2 MMP-inhibitorok megnövekedett expressziója követett, ami tompára utal. ECM lebomlás (4. ábra). Nevezetesen a HC-HC vesék csökkent MMP-2 és MMP-9 aktivitást mutattak, bár az MMP és a TIMP mRNS expressziója nem volt különbözõ a csoportok között (5. ábra).
4. ábra. A TGF-β, a foszforilált Smads 2/3 és a Smad 4, PAI-1, kollagén IV, MMP-9, TIMP-1, MT1-MMP, MMP- vesefehérje-expressziójának reprezentatív sávjai (felül) és densitometriája (alul) 2, TIMP-2 és TSP 1/2 normál, hiperkoleszterinémiás (HC-HC) és hiperkoleszterinémiás sertésekben a lipidcsökkentés után (HC-N). A HC-HC vesék a TGF-β útvonal és a TSP 1/2 fokozott aktiválódását, a TIMP növekedését és az MMP fehérje expressziójának csökkenését mutatták, ami fibrogén aktivitásra utal. Az étrend megfordítása HC-N-ben javította ezeknek a változásoknak a többségét. *P
5. ábra. Az MMP-9 és MMP-2 vese enzimográfiai aktivitása (felső) és mRNS-expressziója (alul) normál, hiperkoleszterinémiás (HC-HC) és hiperkoleszterinémiás sertésekben a lipidcsökkentés után (HC-N). A HC-HC vesék csökkent MMP-9 és MMP-2 aktivitást mutattak (de nem mRNS expressziót), ami javult a lipidcsökkentő beavatkozás után.
Összehasonlítás céljából megvizsgáltuk az MMP expresszióját ugyanazon állatok szívében. Érdekes módon az MMP-9 nem változott, de az MMP-2 erőteljes tendenciát mutatott a HC-HC növekedésére a normál értékhez képest (P= 0,08; kiegészítő ábra, online elérhető a http://www.hypertensionaha.org oldalon), amelyet jelentős szívizom intersticiális fibrózis kísért, de megmaradt a média/lumen arány (P= NS).
Lipidszint csökkentő beavatkozás
A 6 hetes normál étrend után a gp91phox, p22phox, eNOS (2. ábra), TGF-β/Smads, MMPs/TIMP és TSP 1/2 expressziója HC-N-ben nem különbözött a normálistól (4. és 5. ábra ). A prepro – ET-1 és –ET-A expressziója szignifikánsan csökkent (bár nem normalizált), és az intrarenalis gyulladás és a fibrózis HC-N-ben csökkent a HC-HC-hoz képest (3. ábra).
Vita
Ez a tanulmány azt sugallja, hogy a vesefibrózis az érelmeszesedés korai szakaszában számos sérülési út egyidejű modulációjának eredménye. A HC indukálta a vese endotheliális diszfunkcióját, szabályozta az intrarenális endothelin, a TIMP és a TGF-β rendszereket, és tompította az MMP-ket, összességében elősegítve a vese hegesedését az ECM lerakódásának és a mátrix lebomlásának megkönnyítésével. Fontos, hogy a jelenlegi tanulmány azt is mutatja, hogy az étrendi beavatkozás részben visszafordíthatja a hiperkoleszterinémia káros hatásait, és csökkentheti a vesefunkcionális és strukturális károsodást.
Az elmúlt években jelentős erőfeszítéseket tettek a krónikus vesebetegség mechanizmusainak tisztázására, amely egyre gyakoribb állapot gyakran a vese pusztulásához vezet. A lipid-rendellenességeket egyre inkább a vesebetegség progressziójának kulcsfontosságú kockázati tényezőjeként ismerik el. 4,27 Nevezetesen, még a koleszterin rövid távú expozíciója is károsíthatja az érrendszeri endothel funkciót, ami viszont megkönnyítheti a szöveti sérüléseket az érszűkület elősegítésével, a mitogének, például az ET-1 fokozott aktivitásával, valamint az endogén vazodilatátor és antimitotikus szerek csökkent pufferhatásainak támogatásával. NO, amely általában csökkenti a gyulladást és a fibrózist. Korábban kimutattuk, hogy egy 10–12 hetes HC-étrend elegendő volt ahhoz, hogy jelentősen károsítsa a renovaskuláris funkciót 18, 25, és intrarenalis gyulladást, érrendszeri átalakulást, valamint perivaszkuláris és tubulointerstitialis fibrózist indukáljon. 5,6,8,9,12 A jelenlegi tanulmány kiterjeszti korábbi megfigyeléseinket, feltárva azokat a downstream mechanizmusokat, amelyek közvetítik a vesekárosodást hiperkoleszterinémiában. Megfigyeltük, hogy a hiperkoleszterinémia modulálja a szövetek átalakulásának dinamikus folyamatában résztvevő utakat, amelyek magukban foglalják az ECM szintézisét, lerakódását és eltávolítását.
A redox-érzékeny TGF-β számos alapvető biológiai folyamatot szabályoz, és kulcsfontosságú közvetítő a krónikus vesebetegségben. 36 Korai atherosclerosisban korábban megfigyeltük a tubuláris és glomeruláris TGF-β expresszió megnövekedését, 8 amely farmakológiai beavatkozással manipulálható volt. 5,6 A jelenlegi tanulmány azt is bizonyítja, hogy a hiperkoleszterinémiás vesében a megnövekedett TGF-β expresszió Smad effektorainak felemelkedésével és aktiválásával jár, hangsúlyozva a fibrogén aktivitást. A TGF-β receptorok foszforilezése aktiválja intracelluláris jelátviteli hatását, a Smad fehérjéket, amelyek aztán transzlokálódnak a sejtmagba a transzkripció szabályozása érdekében. A receptor által szabályozott Smad-2-t és Smad-3-at a TGF-β receptor foszforilezi, ez a folyamat elengedhetetlen a Smad-4-hez (Smad szövetkezet) való kapcsolódáshoz, és ezért a sejtproliferációban és a szövetek növekedésében szerepet játszó transzkripciós kofaktorok toborzását kezdeményezi. 37,38
Perspektívák
A jelenlegi tanulmány a vesekárosodás elkülönült útját vonja maga után a korai érelmeszesedésben, amely az ECM-termelés összehangolt növekedésének és a tompa lebomlásnak az eredménye, ami általánosságban kedvez a vese hegesedésének. Hosszabb időtartamú és előrehaladottabb érelmeszesedés állandósíthatja ezeket a mechanizmusokat és felgyorsíthatja a vesefunkció romlását. Ennek ellenére a HC-étrend megfordítása sertésekben gyengítette a vese gyulladását, normalizálta a legtöbb fibrogén tényező expresszióját, és visszafejlődött vaszkuláris és vese fibrózis. Így ezek közül az utak közül sok reverzibilis lehet, legalábbis a korai szakaszban, és ezért megalapozza a lipidszint-csökkentő stratégiák alkalmazását a vese megőrzésére hiperkoleszterinémiában.
Ezt a munkát a Nemzeti Egészségügyi Intézet és az American Heart Association támogatta a HL-63282 és a HL-77131 támogatásokkal. Köszönjük Stephen S. Cha-nak (Biostatisztika Osztály, Mayo Klinikai Orvostudományi Kar) a technikai támogatást a tanulmányban bemutatott statisztikai elemzésért.
- A CRTC1 gén pszichotróp gyógyszer által kiváltott genetikai-epigenetikai modulációja korai
- A hipertóniás vesekárosodás hipertóniájának kórélettana
- Royal Canin állatorvosi diéta Vese támogatása száraz macskaeledel - Vásárlói vélemények
- Royal Canin Veterinary Diet Feline vesefélék halakkal Nagyszerű ajánlatok
- A koleszterinnel kapcsolatos génexpresszió modulálása ergoszterinnel és ergoszterinnel dúsított kivonatokkal