Az agyalapi mirigy funkcionális összekapcsolhatósága és a BMI
Paige Rucker
1 Orvostudományi Kar, Mississippi Egyetem Orvosi Központ, Jackson, MS, Egyesült Államok
Toshikazu Ikuta
2 Kommunikációs Tudományok és Rendellenességek Tanszék, Mississippi Egyetem, Oxford, MS, Egyesült Államok
Absztrakt
Az agyalapi mirigy (PG) hormonális felszabadulások révén befolyásolja a testtömeget; a testtömeg és a PG más agyi régiókkal való együttmûködése közötti kapcsolat azonban továbbra sem tisztázott. Itt arra törekedtünk, hogy azonosítsuk (1) a PG funkcionális összekapcsolhatóságát és (2) a testtömeg-indexhez kapcsolódó funkcionális összekapcsolhatóságot a nyugalmi állapot funkcionális mágneses rezonancia képalkotó adatainak vizsgálatával. A továbbfejlesztett Nathan Kline Institute-Rockland Sample alkalmazásával 494 egyén PG funkcionális összekapcsolhatóságát elemeztük, hogy voxel-módon értékeljük. Negatív összefüggést találtak a BMI és a PG funkcionális kapcsolata között az orbitofrontalis kéreggel, a hippocampusszal, a putamennel és a temporális lebenyel. Eredményeink azt mutatják, hogy az ezekhez a régiókhoz tartozó PG diszkontektivitása magasabb BMI-vel van összefüggésben, és arra utalnak, hogy ezeknek a dopaminerg régióknak és a PG-nek az összekapcsolódása a táplálkozási viselkedés és a növekedés révén összefüggésben lehet a testtömeg fenntartásával.
Bevezetés
Kimutatták, hogy a hipotalamusz-hipofízis-mellékvese (HPA) tengely, beleértve az agyalapi mirigyet (PG), összefügg az elhízással (Pasquali et al., 2006). Elhízás esetén a növekedési hormon felszabadító faktorra adott válaszok romlottak (Williams és mtsai., 1984). A krónikus stressz az elhízás elősegítésére irányul a HPA tengelyen keresztül (Bose és mtsai, 2009). A leptin receptorok genetikai variációja szintén összefüggést mutat az elhízással (Clement et al., 1998). A PG szintetizálja és szekretálja a testtömeget szabályozó hormonokat, beleértve a szomatotropinokat és az oxitocint; a PG aktivitás és az elhízás társításáért felelős agyi régiók azonban nem egyértelműen ismertek.
A PG nyugalmi állapotú funkcionális összekapcsolhatóságát minimálisan tanulmányozzák, bár a funkcionális kapcsolódás összefügg az adrenokortikotrop hormon (ACTH) szintjével. Megállapították, hogy a kortizol-koncentrációk megjósolják az interhemisphericus kapcsolódást, és kimutatták, hogy az ACTH-koncentrációk összefüggenek a subcallosalis elülső cinguláris kéreggel (Kiem et al., 2013). Mindazonáltal a nyugalmi állapotú PG-kapcsolat továbbra is tisztázatlan. Ebben a tanulmányban (1) megvizsgáltuk a PG nyugalmi állapot funkcionális kapcsolódását, és (2) a BMI-hez társított PG nyugalmi állapot funkcionális kapcsolódásának elkülönítését tűztük ki célul.
Anyagok és metódusok
Adatgyűjtés
Az MRI képeket, a klinikai adatokat és a továbbfejlesztett Nathan Kline Institute-Rockland Sample (Nooner et al., 2012) mintájának demográfiai adatait a Collaborative Informatics and Neuroimaging Suite (Biswal és mtsai, 2010) munkatársainál szereztük be. Ez az adatállomány 494 olyan személyből állt, akiknek nem ismertek neurológiai előfeltételei (például stroke, tumor és traumás agykárosodás) és MRI-ellenjavallatok (43,46 ± 20,81 évesek), 310 nő és 184 férfi, hat bennszülött amerikai, 25 ázsiai, 102 fekete vagy afro-amerikaiak, két bennszülött hawaii, 346 kaukázusi és 13 másik faj, az átlagos BMI 27,32 ± 6,35 (15,29 és 56,28 között), akik számára nyugalmi állapot és strukturális adatok egyaránt rendelkezésre álltak. A mintában résztvevőket a New York-i Rockland megyéből toborozták, amelynek demográfiai adatai az Egyesült Államokat képviselik (Nooner et al., 2012). Azok a betegek, akiknek ismert agyalapi mirigy-betegségei vannak (például agyalapi mirigy-daganat), nem kerültek be az elemzési adatokba.
A nyugalmi állapotú echo planar kép (EPI) kötetének 64 szelete volt 2 mm-es 112 × 112-es mátrixszal, 2 mm vastagsággal (voxelméret = 2 mm × 2 mm × 2 mm), FOV = 224 mm, ismétlési idejével (TR) 1400 ms és 30 ms echo idő (TE). Összesen 404 térfogatot (~ 10 perc) használtunk az elemzéshez. A nagy felbontású T1 térfogatot 176 szagittális szeletként kaptuk 1 mm vastagságban (voxel méret = 1 mm × 1 mm × 1 mm, TR = 1900 ms és TE = 2,52 ms, FOV = 256).
Adatfeldolgozás
A PG ROI-t manuálisan definiáltuk az MNI 2 mm-es térben, amelynek középpontja körülbelül [MNI: 0, 2, -32] volt (2. ábra: Piros), a korábbi MRI szakirodalom alapján (Klomp és mtsai, 2012). Az adatokat kizártuk, ha a PG a beszerzésen kívül található. Voxel-kapcsolati elemzést végeztünk minden egyes agyban. Az időbeli lefutást térben átlagoltuk az EPI térbe bejegyzett PG ROI-n belül, hogy összefüggéseket lehessen tesztelni a ROI és az egyes agyi voxelek között. A ROI és a voxel közötti korrelációt képviselő Z-pontszámokat használtuk a csoportszintű elemzéshez, miután regisztráltuk az MNI 2 mm-es agytérbe.
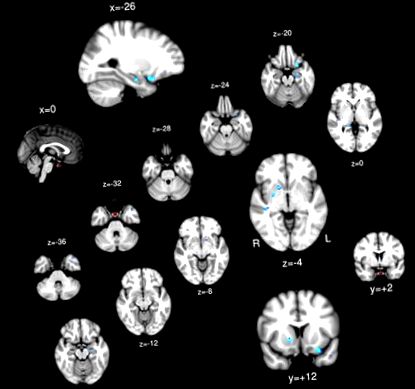
Az agyalapi mirigy ROI (piros) és azok a régiók, amelyeknek agyalapi mirigy-kapcsolata negatív összefüggést mutatott a BMI-vel (kék).
Egy mintás t teszt; Az agyrégiók jelentős pozitív (sárga/piros) és negatív (kék) kapcsolatot mutatnak a PG-vel.
Egyetlen régió sem mutatott pozitív összefüggést a PG funkcionális összekapcsolhatósága és a BMI között. A bal orbitofrontális kéreg, a bilaterális hippocampus, a bilaterális putamen és a jobb felső temporális gyrus funkcionális kapcsolatot mutatott a BMI-vel fordítottan összefüggő PG-vel (1. táblázat és 2. ábra).
Asztal 1
Azok a régiók, amelyek PG-kapcsolata negatív összefüggést mutatott a BMI-vel.
| 1 | 45 | 0,0002 | 0,015 | -26. | 12. | -20 | Bal Orbitofrontal Cortex |
| 2 | 41 | 0,0012 | 0,019 | -24. | -12. | -20 | Bal Hippocampus |
| 3 | 33 | 0,0064 | 0,046 | 40 | -26. | -4 | Jobb felsőbb ideiglenes Gyrus |
| 4 | 23 | 0,0024 | 0,019 | 16. | 10. | -4 | Jobb Putamen |
| 5. | 22. | 0,006 | 0,022 | 26. | -2 | -4 | Jobb Putamen/Pallidum |
| 6. | 21 | 0,013 | 0,030 | -44. | 16. | -30 | Bal Temporal Pole |
| 7 | 14 | 0,009 | 0,024 | 16. | -36 | 0 | Jobb Hippocampus |
| 8. | 10. | 0,023 | 0,035 | -14 | 8. | -10. | Bal Putamen |
Vita
Ennek a tanulmánynak az volt a célja, hogy azonosítsa (1) a PG funkcionális összekapcsolhatóságát és (2) agyi régiókat, amelyek funkcionális kapcsolódása a PG-vel összefüggéseket mutat a testtömeg-indexdel. Egy mintás T-teszt során a hipotalamusz pozitív összefüggéseket mutatott a PG-vel. Ez megfelel a HPA tengely részeként klasszikusan ismert szoros kapcsolatuknak, amelyről ismert, hogy az elhízással jár (Chalew és mtsai., 1995). Ebben a jelenlegi vizsgálatban azonban a hipotalamusz-PG funkcionális kapcsolat nem mutatott szignifikáns kapcsolatot a BMI-vel.
Tekintettel szoros kapcsolatukra, elvégeztük a hipotalamusz és a PG közötti ROI-ROI kapcsolat elemzést. A BMI és a hipotalamusz-PG kapcsolat közötti összefüggés értékeléséhez többszörös lineáris regressziót számoltunk, hogy megjósoljuk a hipotalamusz-PG kapcsolatot a BMI, az életkor és a nem alapján. A regresszió nem volt szignifikáns, ami arra utal, hogy a hipotalamusz-PG kapcsolat közötti kapcsolat állandó a BMI-n keresztül, míg a PG és a hipotalamusz-kapcsolat az agy más voxel-elemzésünkben azonosított részeivel összefüggésben van a BMI-vel. Vagyis a PG-t és a hipotalamust hasonlóan befolyásolja az agy többi része, ami azt eredményezi, hogy a hipotalamusz-PG kapcsolat a BMI-ben állandó marad. Mivel a hipotalamusz és a PG erősen pozitív kapcsolatban vannak, várható, hogy a hipotalamusz funkcionális kapcsolata hasonló mintázatot mutat a PG-vel a BMI-vel való összefüggésben.
Az orbitofrontális kéreg (OFC) pozitív funkcionális kapcsolatot mutatott a PG-vel, és fordított összefüggést mutatott a BMI-vel a PG-hez való kapcsolódás során. Feltételezhető, hogy a PG és az OFC között kisebb a kapcsolat a BMI-vel. Kimutatták, hogy az OFC összefügg az elhízással, valamint felelős az íz- és ízfeldolgozásért (Small et al., 2007) és az ételválasztásért (Cohen et al., 2011). Csökkent OFC szürkeállomány-mennyiséget találtak mind serdülőkori (Ross et al., 2015), mind pedig a középkorú elhízásban (Driscoll et al., 2011). Megállapítást nyert, hogy az OFC térfogata megjósolja az elhízás kockázatát (Smucny et al., 2012). Pontosabban, az OFC szerepet játszik a túlevés megakadályozásában. Kimutatták, hogy az OFC felelős az étkezés megakadályozásáért (Maayan és mtsai., 2012), ami magában foglalja annak fontosságát az elhízás megelőzésében. Az OFC mennyisége összefüggésbe hozható az elhízás jutalom-válaszával is (Shott et al., 2015). A PG és az OFC közötti csökkent kapcsolat az elhízottabb populációban azt sugallhatja, hogy az OFC a PG felett szabályozott lesz.
A putamen fordított összefüggést mutatott a PG-kapcsolat és a BMI között. Vagyis a kisebb PG-putamen kapcsolat a magasabb BMI-vel jár. Az agyalapi mirigy-putamen diszkonnektivitása és a BMI közötti összefüggést a jutalom feldolgozásában betöltött szerepe is magyarázhatja, mivel a putamen és a PG egyaránt gazdag dopamin D2 receptorokban. Kimutatták, hogy az elhízott egyéneknél a striatális D2 receptorok csökkentek (Wang és mtsai., 2004), és a D2 receptorok rendelkezésre állásának hiánya megjósolja a jövőbeni súlygyarapodást (Michaelides et al., 2012). Az antipszichotikumok, amelyek farmakológiai mechanizmusát a D2 antagonizmus képviseli, széles körben ismert, hogy súlygyarapodást váltanak ki (Correll et al., 2011). Megállapították, hogy egy D2 agonista brómokriptin ellensúlyozza az elhízást (Kok és mtsai, 2006). Genetikai szinten a D2 receptor gén (DRD2) polimorfizmusai szerepet játszottak az elhízással való összefüggésében (Nisoli és mtsai., 2007; Ariza és mtsai., 2012), valamint az antipszichotikumok súlygyarapodására adott válaszban (Lencz és mtsai.). al., 2010). A PG D2R profiljai összefüggést mutatnak az elhízással is. A D2 receptorok megzavarása az agyalapi mirigy laktotrópjaiban súlygyarapodást eredményez (Perez Millan et al., 2014). A PG és a striatum dopaminerg modulációi egyaránt szerepet játszanak a BMI-vel való összefüggésben.
Meg kell jegyezni, hogy a prolaktin nem az egyetlen mechanizmus, amely kölcsönhatásba léphet a PG-vel és a striatummal a komplex HPA tengelyben. A voxel-alapú morfometrikus vizsgálat kimutatta, hogy a putamen mennyisége csökkent az elhízásban, és negatív összefüggést mutat az éhomi plazma leptin-koncentrációk és az elhízás között (Pannacciulli et al., 2006), ami arra utal, hogy a putamen szerepet játszik a leptin által közvetített szerepében az ételbevitel szabályozásában. Az elhízás során a putamen és a PG közötti diszkontektivitás összefüggésbe hozható a leptin szabályozásának mechanizmusán keresztül.
A hippocampus fordított összefüggést mutatott a PG-vel való összeköttetésében, míg a hippocampus antikorrelációt mutatott a PG-vel az egymintás T-teszt során. Feltételezhető, hogy az antikorreláció pozitívan kapcsolódik a BMI-hez. Míg a hippokampuszok dopaminerg afferenteket is kapnak a ventrális tegmentális területről, a hippocampus és az ételbevitel manipulációja, valamint a testmozgás közötti összefüggést jól dokumentálták. A fizikai testmozgás, amelyről kiderül, hogy megakadályozza a túlzott súlygyarapodást, hirtelen növeli a hippocampus térfogatát, míg a hippocampus csökkenése egy sor cafeteria-diéta után tapasztalható egereknél (Sack et al., 2017). Kimutatták, hogy a kalória-korlátozás javítja a megismerést az agyi eredetű neurotróf faktor (BDNF) szabályozásával és az oxidatív stressz csökkentésével a hippokampuszban (Kishi et al., 2015). Kimutatták, hogy a hippocampus akkor aktiválódik, ha magas kalóriatartalmú ételekről készült képeket mutatnak be, és ezt az aktiválást kiderítették, hogy az inzulin plazma éhomi szintjének függvényében függ (Wallner-Liebmann et al., 2012), ami arra utal, hogy a hippocampi reagál energiainger az éhség állapotának hatása alatt. A PG-hippocampus diszkonnektivitási eredményünk arra utalhat, hogy a PG-t az éhség állapota és az élelmiszer-hozzáférhetőség alapján a hippocampus szabályozza.
A jelenlegi tanulmány számos korlátozásával foglalkozni kell. Először is, mivel ez a tanulmány funkcionális összekapcsolhatóságon alapul, ahol a funkcionális összekapcsolhatóságot két régió együttes aktiválásával becsüljük meg, az oksági összefüggések nem világítanak meg, bár a PG ismert endokrinológiai tulajdonságai révén erre következtetni lehet. Másodszor, a PG-n belüli ismert felosztások, például az agyalapi mirigy elülső és hátsó része ellenére, elkerüljük a különbségtételt a 2 mm 3 voxel képalkotó felbontása és a feldolgozás során alkalmazott simítás miatt. Ez a két régió, amely a BMI-vel összefüggő funkcionális diszkapcsolhatóságot mutatott, a PG két különálló alrégiójából származhat.
Azt is meg kell vizsgálni, hogy a jelenlegi tanulmány nem tesz különbséget abban, hogy a PG-kapcsolat befolyásolja-e a BMI-t, vagy a BMI befolyásolja-e a PG-kapcsolatot. Míg az agykapcsolat kimutatták, hogy kifejezetten befolyásolja a testsúlyt a jutalmazási rendszer összefüggésében, a sebészeti beavatkozások által kiváltott testtömeg-állapot a funkcionális agykapcsolatot is befolyásolja (Lepping et al., 2015). Továbbra sem világos, hogy kapcsolódási eredményeink a testtömeg okozói vagy eredményei.
Ebben a tanulmányban a PG és a dopaminerg régiók, köztük a putamen, a hippocampus és az OFC közötti funkcionális diszkapcsoltságot találtunk. Az eredmények dopaminerg modulációt feltételeznek a PG és ezen régiók között, amely befolyásolja a testtömeget.
Etikai nyilatkozat
Ezt a tanulmányt a Mississippi Egyetem Intézményi Felülvizsgálati Testülete hagyta jóvá. Ebben a vizsgálatban nem vettek részt közvetlenül sem embereket, sem állatokat. Minden emberi alany írásbeli tájékozott beleegyezést adott.
Szerző közreműködései
A PR és a TI megtervezte a tanulmányt és elkészítette a kéziratot. A TI elemezte az adatokat.
- A prosztata mirigy meghatározása, mérete, betegségei és kockázatai - HIFU prosztata
- Táplálkozási és életmódbeli változások, amelyeket ma elvégezhet a pajzsmirigy alulműködés kezelésében Integratív; Funkcionális
- A nyálmirigy fertőzésének okai, kockázati tényezői és tünetei
- Nyálmirigy ráksebészet American Cancer Society
- Csipkebogyó Oxymel útmutató Andrea Hughes nyugati gyógynövénygyógyász készítéséhez, Funkcionális orvoslás, Est