A magas zsírtartalmú étrend a vagális afferens mechanizmus révén rontja a hűlés által kiváltott barna zsírszövet aktiválódást
Absztrakt
Drámai ellentétben a kontroll étrendben lévő patkányokkal, a magas zsírtartalmú étrenden (HFD) tartott patkányok a hűtés során nem tudták aktiválni a barna zsírszövetet (BAT) annak ellenére, hogy BAT-aktivitásuk erőteljesen megnőtt, miután a BAT-szimpatikus premotoros neuronjaik közvetlenül aktiválódtak a raphe pallidus. A nyaki vagotomia vagy a glutamát receptorok blokkolása a tractus solitarii (NTS) magjában megfordította a hideg által kiváltott BAT aktivitás HFD által kiváltott gátlását. Így a HFD nem akadályozza meg a patkányokat abban, hogy robusztus, központilag vezérelt BAT termogenezist szereljenek fel; a HFD azonban megváltoztatja az NTS neuronok vagális afferens bemenetét, megakadályozva ezzel a BAT termogenezis normális aktiválódását a hűtésre. Ezek az eredmények, párhuzamosan az elhízott emberek BAT-jában a hűtés által kiváltott glükózfelvétel hiányával, olyan idegi mechanizmust tárnak fel, amelyen keresztül a HFD fogyasztása hozzájárul az energiafelhasználás csökkenéséhez és így a súlygyarapodáshoz.
hűvös környezetnek való kitettség növeli a barna zsírszövet szimpatikus kiáramlását (BAT), biztosítva az alapvető hőszabályozási ösztönzést az anyagcsere és a hőtermelés serkentésére az emlős BAT-ban, beleértve a felnőtt emberekét is (5, 18, 24, 31, 33). A nem termoregulációs tényezők széles skálája (például prosztaglandinok, leptin, trijódtironin és lipidek) szintén működhetnek a központi idegrendszerben, közvetlenül BAT-ban vagy vagális afferenseken keresztül, hogy befolyásolják a BAT termogenezisét (áttekintve a 16. hivatkozásban). A lipid energiatárolók fogyasztása révén a BAT termogén anyagcseréje idegileg szabályozott közreműködő az energia homeosztázisban. Így, különösen az energiatartalmú ételek megnövekedett fogyasztása mellett, a BAT-tevékenység krónikusan csökkent szintje hozzájárulna az elhízást jellemző, fokozott zsírenergia-raktárakhoz.
Valóban, a BAT nélküli egerek hajlamosak az elhízásra és a cukorbetegségre (8, 13), és fordítva, a BAT termogeneziséért elsősorban felelős protein-1 (UCP-1) túlzott expressziója véd a magas zsírtartalmú étrendtől (HFD) okozta elhízás (9). Az állandó megállapítások, miszerint az elhízott embereknél alacsonyabb a metabolikusan aktív BAT előfordulási gyakorisága (5, 20, 24, 31), és hogy a BAT bazális szimpatikus aktivációja csökken a patkányokban, amelyeket krónikusan HFD-n tartanak (10, 25), szintén szerepet játszanak a csökkent az BAT aktivitás az elhízás túlzott zsírfelhalmozódásában. Látszólag ellentétben áll ezekkel a megfigyelésekkel, az UCP-1-et a HFD által kiváltott elhízott rágcsálókban szabályozzák (áttekintve a 7. hivatkozásban), ami ennél aktívabb BAT-t javasol ebben a modellben.
A HFD hatásának közvetlen meghatározására a BAT szimpatikus aktiválására teszteltük a BAT alapvető hőszabályozó hideg-védekező aktivációját HFD-n tartott patkányokban. A [18F] fluorodeoxi-glükóz alacsony, hűtés által kiváltott BAT-felvételét kövér embereknél utánozva a magas zsírtartalmú patkányok szinte nem növelték a BAT-aktivitást a bőr és a mag lehűlésére reagálva. A hűlés által kiváltott BAT-aktivitás hirtelen visszatérése a vagális afferens aktivitás megszakadása után a megváltozott vagális BAT-gátló bemenetre (17) utal, mint a patkányokban a BAT-aktiváció károsodásának elsődleges neurobiológiai mechanizmusára HFD-n.
ANYAGOK ÉS METÓDUSOK
Minden eljárás megfelelt a laboratóriumi állatok gondozásának és felhasználásának útmutatójában részletezett előírásoknak: 8. kiadás (Nemzeti Kutatási Tanács, National Academies Press, 2010), és azokat az Oregoni Egészségügyi és Tudományegyetem Állattenyésztési és Felhasználási Bizottsága hagyta jóvá.
Hím és nőstény Sprague-Dawley patkányokat (Charles River Laboratories, Indianapolis, IN) egy 22-23 ° C-os hőmérsékletű, 12: 12 órás világos-sötét ciklus alatt tartott telephelyen helyeztünk el. A patkányokat kontroll táplálékkal (13% kcal zsírból; Laboratory Rodent Diet 5001, LabDiet.com) tápláltuk, amíg 275-350 g közötti súlyuk nem volt, ekkor két kontroll étrend egyikébe helyeztük őket (zsírból 10% kcal; Laboratóriumi rágcsáló-étrend 5001 vagy Research Diets D12450H) vagy HFD (45% kcal zsírból; Research Diets D1245). A patkányokat a kísérlet előtt ≥60 napig tartottuk ezen az étrenden. A két kontroll étrenden tartott patkányok válaszai között nem észleltek különbségeket, ezért ezeket az adatokat a statisztikai összehasonlítás során egyetlen csoportnak tekintették. A HFD-n tartott patkányok esetében megfigyeltük a súlygyarapodás felismert változékonyságát, amelyet általában a rezisztens, a közepes és az elhízott csoportnak írtak le a súlygyarapodás tercilisei alapján (27 Mivel nem volt különbség a BAT termogén válaszokban, amikor az adatokat három csoportnak tekintettük, a HFD-n lévő összes patkányt statisztikai összehasonlításként egyetlen csoportnak tekintettük.
Az akut fiziológiai kísérletekhez a patkányokat izofluránnal (2–3% 100% O2-ben) altattuk a légcső, a femorális artéria és a véna kanülálása előtt, mielőtt átállítottak volna uretánra (750 mg/kg iv) és α-kloralózra (60 mg/ml). kg iv) érzéstelenítés. A patkányokat mesterségesen szellőztették (100% O2), és d-tubokurarinnal megbénították. A patkányokat egy sztereotaxiás keretbe helyeztük, és a termikus elemeket a végbélbe helyeztük a test testhőmérsékletére (TCORE), a bal interscapularis BAT párnára a BAT hőmérséklet (TBAT) és a hátsó negyed bőrére a hőtakaró alatt a bőr hőmérsékletére (TSKIN). A jobb interscapularis BAT párnát beidegző szimpatikus ideget bipoláris kampós elektródákkal rögzítettük (15). A BAT szimpatikus idegaktivitást (SNA) felerősítettük (x10K, 1–300 Hz, CyberAmp 380; Axon Instruments), és digitalizáltuk egy merevlemezre (Spike 2; Cambridge Electronic Design) az összes többi változóval együtt.
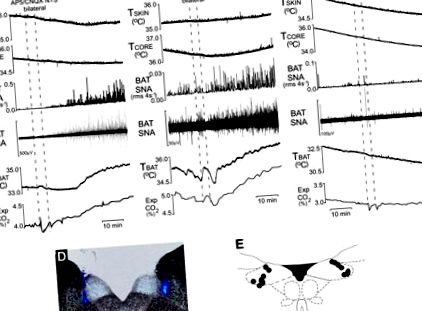
A tractus solitarii (NTS) sejtmagjában található glutamátreceptorok blokádja helyreállítja a BAT bőrhűtés által kiváltott aktivációját HFD-n tartott patkányokban. Reprezentatív példák a BAT SNA és a TBAT hűlés által kiváltott növekedésére a glutamát receptor antagonisták (2R) -amino-5-foszfonovaleránsav (AP5) és a 6-ciano-7-nitroquinoxalin-2,3-dion kétoldalú nanoinjekcióit követően (CNQX) (A) vagy kinurenát (B) az NTS-ben 2 patkányban, HFD-n tartva. C: reprezentatív példa a BAT SNA és a TBAT bőrhűtés által kiváltott növekedésének hiányára az NTS kétoldali nanoinjekcióit követően HFD-n tartott patkányokban. D: hisztológiai koronális metszet, amely szemlélteti az NTS tipikus kétoldalú injekciós helyeit. E: az NTS injekciós helyeinek központjainak összetett feltérképezése 7 patkányon, a patkány farokvesszőjén keresztül rajzolt atlaszon ábrázolva (21).
KÖZZÉTÉTELEK
A szerzők nem jelentenek be pénzügyi vagy egyéb összeférhetetlenséget.
A SZERZŐ HOZZÁJÁRULÁSAI
C.J.M. és S.F.M. a kutatás megtervezése és megtervezése; C.J.M. elvégzett kísérletek; C.J.M. elemzett adatok; C.J.M. és S.F.M. értelmezett kísérletek eredményei; C.J.M. és S.F.M. elkészített figurák; C.J.M. megfogalmazott kézirat; C.J.M. és S.F.M. szerkesztett és átdolgozott kézirat; C.J.M. és S.F.M. a kézirat jóváhagyott végleges változata.
KÖSZÖNETNYILVÁNÍTÁS
Hálásak vagyunk a Rubing Xing-nek a kiváló technikai segítségért.
- Változások a zsírszövetraktárakban és az anyagcsere markerekben egyéves étrend és testmozgás után
- A ketogén étrend hatása a zsírszövet, a máj és a szérum biomarkerekre ülő patkányokban és
- A hosszan tartó magas zsírtartalmú étrend hatása a patkányvér és a máj zsírsavcseréjére
- Az étrend kritikus az elhúzódó glikémiás kontroll szempontjából a magas zsírtartalmú rövid távú inzulinkezelés után
- A korrelációs hálózat elemzése megmutatja a hosszú távú, magas zsírtartalmú étrend és a testmozgás eltérő hatásait