Az E * forma stabilizálása a trombint antikoagulánssá változtatja *
Alaji Bah
A Washington Egyetem Orvostudományi Karának Biokémiai és Molekuláris Biofizikai Tanszékéről, St. Louis, Missouri 63110
Christopher J. Carrell
A Washington Egyetem Orvostudományi Karának Biokémiai és Molekuláris Biofizikai Tanszékéről, St. Louis, Missouri 63110
Zhiwei Chen
A Washington Egyetem Orvostudományi Karának Biokémiai és Molekuláris Biofizikai Tanszékéről, St. Louis, Missouri 63110
Prafull S. Gandhi
A Washington Egyetem Orvostudományi Karának Biokémiai és Molekuláris Biofizikai Tanszékéről, St. Louis, Missouri 63110
Enrico Di Cera
A Washington Egyetem Orvostudományi Karának Biokémiai és Molekuláris Biofizikai Tanszékéről, St. Louis, Missouri 63110
Absztrakt
Korábbi tanulmányok kimutatták, hogy kilenc maradék törlése a trombin autolízis hurokjában potenciális klinikai jelentőségű antikoaguláns hajlamú mutánst eredményez, de a hatás molekuláris eredete megoldatlan maradt. Ennek a mutánsnak a szabad formában, 1,55 Å felbontás mellett megoldott röntgenkristályszerkezete egy inaktív konformációt mutat, amely gyakorlatilag megegyezik (0,154 Å négyzet négyzetes alapeltéréssel) a nemrégiben azonosított E * formával. A Trp 215 oldallánca beomlik az aktív helyre azáltal, hogy> 10 Å-t eltol az aktív E formában lévő helyzetéből, és az oxianion lyukat megszakítja a Glu 192 – Gly 193 peptidkötés megfordulása. Ez a megállapítás megerősíti az inaktív E * forma létezését lényegében ugyanabban az inkarnációban, mint amelyet először a D102N trombinmutáns szerkezetében azonosítottak. Ezenkívül bemutatja, hogy a trombin állvány mutációja által gyakran okozott antikoaguláns profil valószínűleg molekuláris eredetét az inaktív E * forma stabilizálásában találja meg, amely a trombomodulin és a protein C kötődésekor szelektíven eltolódik az aktív E formához.
A tripszin család szerin proteázai felelősek az emésztésért, a véralvadásért, a fibrinolízisért, a fejlődésért, a megtermékenyülésért, az apoptózisért és az immunitásért (1). A proteáz aktiválásához átmenetre van szükség a (2) zimogén formától és egy ionpár képződésétől a katalitikus lánc újonnan kialakult aminoterminusa és az erősen konzervált Asp 194 (kimotripszinogén számozású) maradék között a katalitikus Ser mellett. 195. Ez biztosítja a szubsztrát hozzáférését az aktív helyhez és az oxianion lyuk megfelelő képződését, amelyet Ser 195 és Gly 193 gerinc N atomjai járulnak hozzá (3). A zimogén → proteáz konverzió klasszikusan kapcsolódik a katalitikus aktivitás megjelenéséhez (3, 4), és hasznos paradigmát kínál a proteáz működésének és szabályozásának főbb jellemzőinek megértéséhez.
ASZTAL 1
Kristallográfiai adatok a trombin mutánshoz Δ146–149e (Protein Data Bank kód 3GIC)
| Adatgyűjtés | |
| Hullámhossz | 0,9 Å |
| Űrcsoport | P43 |
| Egységdimenzió | a = b = 58,23, c = 119,56 Å |
| Molekulák/aszimmetrikus egység | 1 |
| Felbontási tartomány | 40,0–1,55 Å |
| Megfigyelések | 220,618 |
| Egyedi megfigyelések | 54,240 |
| Teljesség | 94,3% (76,1%) |
| Rsym (%) | 3,7% (27,9%) |
| I/σ (I) | 27,7 (2,3) |
| Finomítás | |
| Felbontás | 40,0–1,55 Å |
| | F |/σ (| F |) | > 0 |
| Rcryst, Rfree | 0,188, 0,224 |
| Gondolatok (munka/teszt) | 51,479/2747 |
| Fehérje atomok | 2295 |
| Oldószer molekulák | 257 |
| r.m.s.d. kötéshosszak a | 0,012 Å |
| r.m.s.d. szögek a | 1,4 ° |
| r.m.s.d. ΔB (Å 2) (mm/ms/ss) b | 0,86/0,67/2,21 |
| 〈B〉 fehérje | 18,6 Å 2 |
| 〈B〉 oldószer | 28,6 Å2 |
| Ramachandran telek | |
| Legkedveltebb | 98,3% |
| Nagyvonalúan megengedett | 1,3% |
| Nem engedélyezett | 0,4% |
a Gyökér négyzeteltérés az ideális kötéshosszaktól és szögektől, valamint az r.m.s.d. a kötött atomok B-tényezőinek értékeit mutatjuk be.
b mm a fő lánc-fő láncot jelöli; ms jelzi a fő láncoldali láncot; és ss az oldallánc oldalsó oldalláncát jelöli.
EREDMÉNYEK
Miután a vérben előállt inaktív prekurzor protrombinjából, a trombin prokoagulánsként működik, amikor a fibrinogént oldhatatlan fibrin alvadékká alakítja (45), és protrombotikumként működik, amikor hasítja a proteáz-aktivált receptorokat (PAR) (46, 47). Az endothelsejt-receptor trombomodulinnal való kölcsönhatás során azonban a trombin elveszíti mind a prokoaguláns, mind a protrombotikus funkciókat, és> 1000-szeresére növeli aktivitását az antikoaguláns C-fehérjével szemben (48). Az E * formában stabilizált trombin mutánsnak alig vagy egyáltalán nincs aktivitása a fiziológiai szubsztrátokkal szemben. Ha ez a mutáns átalakítható E formává a trombomodulin megkötésekor, akkor szelektív antikoaguláns válasz vált ki a C fehérje aktiválásakor az érrendszeri endotheliumban, ahol trombomodulin van jelen.
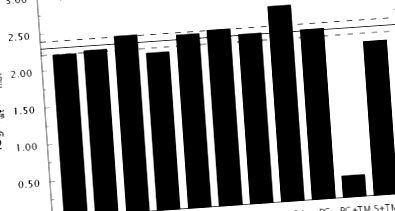
Bizonyíték arra, hogy az Δ146–149e trombinmutáns az oldatban E * formában stabilizálódott, a kcat/Km értékének kromogén és természetes szubsztrátokra történő vizsgálatából származik. Az 1. ábrán szereplő adatok figyelemre méltó hasonlóságot mutatnak a fibrinogén, PAR1, PAR3 és protein C elleni aktivitásvesztésben az Δ146–149e mutáns esetében a vad típushoz képest. Hasonlóképpen összehasonlítható aktivitásvesztés figyelhető meg számos kromogén szubsztráttal szemben, amelyek P1 vagy P2 helyzetben helyettesítéseket hordoznak (54). Átlagosan a veszteség körülbelül 200-szoros. Egy olyan mutáció esetén, amely az E * -E egyensúlyt szelektíven elmozdítja az E * javára, anélkül, hogy további hatásokat tenne a szubsztrátra vagy az inhibitorok felismerésére, az 1–2. Egyenletben szereplő s és K értékeknek ugyanannyival kell csökkenniük. Pontosabban, a 3. egyenletben bemutatott aránynak a vad típusú (WT), valamint s és K mutáns értéke között minden szubsztrát és inhibitor esetében azonosnak kell lennie.
Az 1. ábra adatai összhangban vannak a 3. egyenletből származó előrejelzéssel. A PAR4-felismerés perturbációja lényegesen hangsúlyosabb az összes többi szubsztrátumhoz képest, de ez összhangban áll azzal a közvetlen kölcsönhatással, amelyet ez a szubsztrát az autolízishurok maradványaival folytat (55) . Az E * stabilizálásának további támogatása az Δ146–149e mutánsban az argatroban (39) inhibitor aktív helyhez való kötődésének kalorimetrikus mérésével jár. A K értéke (lásd a 2. egyenletet) a mutánsban 135-szeresére csökken a vad típushoz képest (2. ábra), amint az a 3. egyenletből várható.
Argatrobán kötődése a vad típusú trombinhoz (balra) és Δ146–149e (jobbra) izotermális titráló kalorimetriával mérve. A felső panel az egyes titrálások során a trombinminta (alsó nyom) és az argatroban puffer kontroll (felső nyom) hőcseréjét mutatja. Az alsó panel az adatok integrálása, hogy a ligandum/fehérje mólarány függvényében a teljes hőcserét megkapja. A kísérleti körülmények: 5 m m Tris, 0,1% polietilénglikol, 145 m m NaCl, pH 7,4, 37 ° C. Az enzim és az argatroban koncentrációja a következő: 13,44 és 140 μm (vad trombin); 52,5 és 777 μ m (Δ146–149e). A titrálási görbéket az iTC200 Origin szoftverével illesztettük be, a legjobb illeszkedési paraméterértékekkel a következők szerint: vad trombin, K = 1,0 ± 0,1 10 8 m -1, ΔG = −11,3 ± 0,1 kcal/mol, ΔH = −15,2 ± 0,1 kcal/mol, és TΔS = -3,9 ± 0,1 kcal/mol; Δ146–149e, K = 7,4 ± 0,4 10 5 m -1, ΔG = −8,3 ± 0,1 kcal/mol, ΔH = −13,8 ± 0,1 kcal/mol és TΔS = −5,5 ± 0,1 kcal/mol. Az N sztöchiometriai állandó értéke 1,01 ± 0,01 volt a vad trombin és az Δ146–149e mutáns esetében.
A trombomodulin hozzáadása visszaállítja a mutáns aktivitását a C fehérje irányában (1. ábra), jelezve, hogy bár a mutáció stabilizálja az E * -ot, az E aktív forma még mindig jelen van az oldatban, és a kofaktor jelenlétében a protein C aktiválásához be lehet tölteni. A közelmúltban bizonyítékot szolgáltattak arra, hogy az I exozithoz, a trombomodulin felismerésének fő trombinepitópjához (56, 57) történő kötődés képes átalakítani E * -t E-vé, a közelmúltban a D102N trombinmutáns szerkezete a PAR1 thrombocyta receptor fragmenséhez kötött (6) . Ezért a trombin mutáns Δ146–149e valószínűleg úgy működik, mint egy alloszterikus kapcsoló, amely inaktív E * formává stabilizálódik, amíg a trombomodulin és a C-fehérje együttes kötődése elmozdítja az E * -t E-be és visszaállítja az aktivitást.
Az Δ146–149e (arany) trombin-mutáns szerkezetének szalagos ábrázolása az E-konformációban a trombin szerkezetével (35) (cián). A Lys 145 és a Gly 150 közötti újonnan kialakult peptidkötés piros színnel van jelölve az Δ146–149e rövidített autolízis hurokjában (lásd még a 4. ábrát), és az E konformációban lévő hurok nem látható a Trp 148 és a Lys 149e maradékok között. A mutánsban lévő 215–217 β-szál összeomlik az elsődleges specificitás zsebében (piros nyitott nyílhegyek), a Trp 215 oldalsó lánca (pálcamodell) az aktív helyre kerül (a katalitikus triád maradékai: His 57, Asp 102, és pálcamodellként bemutatott Ser 195) hidrofób kölcsönhatásban Trp 60d, Tyr 60a, Leu 99 és His 57-vel. Ez drasztikus változást jelent (r.m.s.d. 0,384 Å) az E konformációjától, ahol a Trp 215 oldallánca 10,5 Å távolságra helyezkedik el, és az aktív helyet hozzáférhetővé teszi a szubsztrát számára. A Δ146–149e konformációja figyelemre méltóan hasonló (r.m.s.d. 0,154 Å), mint az E * közelmúltban meghatározott (6, 7).
Balra a Trp 215 aktív helybe történő összeomlásának és az Δ146–149e trombinmutáns (CPK, sárga) oxianion lyukának megszakadásának részletei láthatók. Ugyanezen maradékok konformációját E formában összehasonlítással mutatjuk be (CPK, cián). A Glu 192 és a Gly 193 közötti peptidkötés megfordul az Δ146–149e mutánsban (piros nyitott nyílhegy), amint az az E * formában látható (6, 7, 9), ami megszakítja az oxianion lyukat, amelyet az N Gly 193 és Ser 195. A 2Fo - Fc elektronsűrűség-térkép (zöld háló) kontúrozása 2.0σ-on történik. Jobbra, a 146-os ETWTANVGK 149e maradékok törlése a Δ146–149e mutáns autolízis hurokjában új peptidkötést eredményez a Lys 145 és a Gly 150 között (CPK, sárga). Az autolízishurkot ritkán látják teljes egészében a trombinszerkezetekben, és jelentős rendellenességek maradnak a Δ146–149e mutánsban, ahol a 144F LKGQ 151 szekvenciát 0,5σ-on kell kontúrozni a 2Fo - Fc elektronsűrűség térképen (zöld háló).
VITA
Az új paradigma a tripszinszerű proteázok legújabb kristályszerkezeteinek elemzéséből (6, 7, 15–23) jött létre, amely az E * -E egyensúly létezését támasztja alá, mint a tripszinredő kritikus jellemzőjét (9). Ez az alloszterikus egyensúly a proteázbiológia számos fontos szempontját magyarázza. A kofaktorral való kölcsönhatásig gyengén aktív proteázok esetében, amint azt egyes alvadási és komplement faktoroknál megfigyelték (29), a katalitikus aktivitás megindulása az E * → E konverziónak tulajdonítható. Az E * forma ebben az esetben az enzim nyugalmi állapotaként és rugós mechanizmusként működik, amely bekapcsolható, ha a biológiai összefüggések megkövetelik. Az E * -E egyensúly kontextust biztosít a biológiai aktivitás elvesztésével járó mutációk hatásának értelmezéséhez a nagyon aktív proteázokban is. Bizonyos esetekben, amint azt a trombin dokumentálja (8, 58), a hatás molekuláris eredete nem világos, mivel a mutáció nem befolyásolja a szubsztráttal közvetlenül érintkező maradványokat. Az E * stabilizálása olyan molekuláris vezetékek révén, amelyek nem feltétlenül vesznek részt a szubsztrátfelismerésben, hihető magyarázatot kínálhat.
* Ezt a munkát részben vagy egészben a HL49413, HL58141 és a HL73813 egészségügyi intézmények támogatták (E. D. C. részére).
- Izomdisztrófia típusai és az egyes formák okai
- Légzőszervi acidózis anorexia nervosában szenvedő serdülőknél, akik orvosi stabilizáció miatt kórházba kerültek a
- Közel 100 font már le, a sofőr a közösségi médiához fordul, hogy ösztönözze a fogyás célját
- Taylor Swift 30 dologgal kapcsolatban, amit 30. születésnapja előtt tanult - Taylor Swift 30 éves lesz
- Támogatja a test zsírkiválasztási folyamatait ✅ Lean Form 24 Reviews 💊 - TheCGBros