Az egerekben előforduló herpesz szimplex vírus encephalitisre adott immunválaszt az étrendi E 1, 2 vitamin modulálja.
Absztrakt
Bevezetés
A herpes simplex vírus encephalitis (HSE) 3 a leggyakoribb halálos sporadikus encephalitis emberben (1–3). Az összes HSE-eset kilencven százalékát herpes simplex vírus (HSV) -1 okozza (4). Kezelés nélkül a HSE halálozási aránya 70%. Vírusellenes gyógyszerekkel, például aciklovirral történő kezelés 20% -ra csökkenti a HSE-vel összefüggő mortalitást; azonban a HSE-betegek csak 38% -a tér vissza normális működéséhez (4,5). A HSE jelentős problémát jelent az immunszuppresszív betegek számára, beleértve a HIV-fertőzötteket és a kemoterápiát.
Intranazálisan (i.n.) beadva a HSV-1 a szagló és a trigeminus idegek neuronális útvonalai mentén jut be a központi idegrendszerbe (CNS) (6). Ez a fertőzés útja akut nekrotizáló encephalitist eredményez, amely magában foglalja a szaglási és a limbikus rendszereket, beleértve a szaglóhagymát, a hipotalamust, a talamuszt, az amygdalát, a hippocampust, valamint a szagló és entorinalis kéregeket. Ebben a modellben a HSV-1 elsősorban az idegsejteket és a gliasejteket fertőzi meg (7,8). Az idegsejtek és a glia fertőzése a mikroglia és az infiltráló makrofágok által előállított proinflammatorikus citokinek termelését, valamint kemokinek és antivirális citokinek termelését indukálja (9,10). Amint a vírus replikációja folytatódik, a CD4 + és a CD8 + T limfociták egyaránt beszivárognak az agyba (11–13). Az intranazális fertőzés útja utánozza az emberi HSE feltételezett útját, ahol úgy gondolják, hogy a vírus a szaglás útján vagy a trigeminális ganglionon keresztül jut be a központi idegrendszerbe (1,14,15). A HSV-1 fertőzés intranazális modelljét jól jellemezték egerekben (8,13,16–19).
Az E-vitamin (VE) a tokoferolok és tokotrienolok családja, amelyek közül az α-tokoferol (α-TOC) biológiailag a legaktívabb és a második leggyakoribb az ételekben (20). Ezek a lipidben oldódó antioxidáns vitaminok megtalálhatók a sejtmembránokban, és a szabad gyökök eltávolításával megakadályozzák a lipidek peroxidációját (21). A VE hiánya megnövekedett oxidatív stresszel, központi és perifériás neuropátiákkal és károsodott immunfunkcióval társul (22–24). A VE-hiány növeli a parazita terhelést és a patológiát azokban az egerekben, amelyek kísérletileg fertőzöttek Heligmosomoides polygyrus-szal (23). A VE-hiány szintén csökkenti a T- és B-sejtek számát a Trypanosoma cruzi-val fertőzött patkányokban (24).
Kimutatták, hogy a VE-vel történő kiegészítés csökkenti az immunszenszcenciát, javítja az immunfunkciót, és neuroprotektív lehet. A VE-kiegészítés képes T-sejtes citokinek, beleértve az interferon (IFN) -γ (25,26) modulálására. Rövid idejű, nagy dózisú VE-kiegészítés vastagbélrákos betegeknél mind az IFNγ, mind az interleukin (IL) -2 termelését növeli (25). A magas étrendi VE növeli az IFNγ és IL-2 termelést idős egerekben influenzafertőzés után (26). Egy nemrégiben készült tanulmányban Han és mtsai. (27) megállapította, hogy a VE az immunrendszerrel összefüggő gének széles skáláját érinti idős, de nem fiatal egerekben. Ezenkívül a VE kimutatta, hogy megállítja az életkorral összefüggő csökkenést a CD4 T-sejt szinapszisok kialakulásában (28). Fiatal, visszafogástól stresszes egerekben a VE kimutatták, hogy növeli az IFNγ és az IL-2 termelését a concanavalin A-stimulált lépsejtekben (29).
Laboratóriumunk tanulmányai rámutattak az antioxidáns mikrotápanyagok, köztük a VE kulcsfontosságú szerepére a fertőző betegségek patogenezisében (30–34). Pontosabban kimutattuk, hogy a VE-kiegészítés képes csökkenteni a coxsackievirus által kiváltott szívizomgyulladást szelénhiányos egerekben. VE hiányában a vassal töltött egerek jelentősen megnövelték a coxsackievirus által kiváltott szívizomgyulladást a vassal töltött, VE-megfelelő (VE-A) egerekhez képest. Laboratóriumunk és mások tanulmányai együttesen azt mutatják, hogy a VE képes módosítani az immunválaszt egy vírusos kórokozóra.
Mivel az agy lipidekben gazdag, feltételeztük, hogy a VE hiánya növeli az egerek HSE patológiáját, és a VE pótlása csökkenti a HSV-1 encephalitis tüneteit.
Anyagok és metódusok
Egerek, diéták és fertőzés
Az elválasztott BALB/cByJ hím egereket (Jackson Labs) 3 étrendből ad libitum etették: 1) VE-hiányos (VE-D) étrendet (TD 88163), 2) VE-A (dl-α-tokoferil-acetátot) diéta (38,4 mg/kg), vagy 3) VE-vel kiegészített (VE-S) étrend (384 mg/kg) (Harlan Teklad) (1. táblázat). A táplálkozás után 4 hét múlva az egereket enyhén altattuk ketamin (0,6 mg/kg) és xilazin (0,35 mg/kg) oldattal, és megfertőztük iv. 1,5 × 106 plakkképző egységgel (PFU) HSV-1 10 μl össztérfogatban. Az összes egeret ketrecenként 4-en tartották az Észak-Karolinai Egyetem Állattartó Intézetében, amelyet az Amerikai Laboratóriumi Állattenyésztési Akkreditáció Egyesülete teljes mértékben akkreditált. Az állatokat az Intézményi Állathasználati és Gondozási Bizottság által jóváhagyott protokollok szerint tartották fenn.
ASZTAL 1
A kísérleti étrendek összetétele 1
| g/kg | |||
| Kazein, „vitaminmentes” | 200,0 | 200,0 | 200,0 |
| DL-metionin | 3.0 | 3.0 | 3.0 |
| Dextróz, monohidrát | 674.3 | 674.3 | 674.3 |
| Kukoricaolaj, tokoferollal lecsupaszítva | 50,0 | 50,0 | 50,0 |
| Cellulóz | 30.0 | 30.0 | 30.0 |
| Ásványi keverék, AIN-76 | 35.0 | 35.0 | 35.0 |
| DL-α-tokoferil-acetát (500 NE/g) | 0 | 0,077 | 0,77 |
HSV-1 vírusállományok és vírus inaktiválás
A HSV-1 McIntyre (ATCC) törzseket Vero sejtekben (ATCC) szaporítottuk, összegyűjtöttük, centrifugáltuk (750 × g; 5 perc) és -80 ° C-on tároltuk. A Vero sejteket 2 mmol/l glutaminnal kiegészített DMEM-ben tartottuk, majd 1,5 g/l nátrium-hidrogén-karbonáttal, 0,1 mmol/l nem esszenciális aminosavakkal, 1,0 mmol/l nátrium-piruváttal és 10% marhahús magzati szérummal állítottuk be.
A HSV-1-et inaktiváltuk 1 ml-es alikvot részek elhelyezésével 30 mm-es szövetkultúra-csészékbe (Becton-Dickinson) 2,5 cm-re egy baktériumölő UV-fényforrástól 6 percig. Az inaktiválást az inaktivált vírus Vero-sejtekhez történő hozzáadásával igazoltuk, hogy ellenőrizzük a vírus replikációjának hiányát.
Patológia és szövetgyűjtés
A fertőzés után az egereket lemértük, naponta megvizsgáltuk, és a következő skálán értékeltük: 0, nincs tünet; 1, fodros szőr, ataxia; 2, hátsó végtag bénulás/mellső csattanás; 3, a hátsó végtag bénulása az elülső kar gyengeségével; 4, halandó; 5, halott. A PCR és a vírustiter kísérleteihez a nem fertőzött (UNI, d0), a d 3 és a 7 posztinfekciós (p.i.) egereket gyors méhnyak diszlokációval leöltük, az agyat eltávolítottuk, és jégen gyorsan flash-fagyasztva boncoltuk.
Máj és agy α-TOC mérések
Az α-TOC szinteket HPLC-vel mértük standard módszerekkel (35).
Agy-citokin mérések
Az mRNS szintjét úgy határoztuk meg, hogy a teljes RNS-t izoláltuk az előagy régiójából (thalamus és hypothalamus) TRIzol módszerrel (Invitrogen). A reverz transzkripciót Superscript II First Strand Synthesis kit (Invitrogen) alkalmazásával, oligo (dT) primerekkel hajtottuk végre. A citokin és kemokin mRNS expresszióját kvantitatív RT-PCR-rel határoztuk meg (34). A glicerinaldehid-3-foszfát-dehidrogenáz mRNS-szintjét minden mintához meghatároztuk, és a génexpresszió normalizálására használtuk.
Az agytörzseket (BS) összegyűjtöttük 0,5 ml jéghideg DMEM-be, majd homogenizáltuk, centrifugálással tisztítottuk (2500xg; 3 perc), és -80 ° C-on tároltuk, amíg az aktiválódás után nem vizsgáltuk, a normál T-sejt expresszálódott. és szekretált (RANTES) és IFNγ által indukálható protein-10 Luminex-alapú multiplex ELISA készlettel (Biosource) és IL-1β és tumor nekrózis faktor (TNF) -α ELISA-val (BD Pharmingen) a gyártó utasításait követve.
HSV-1 titerek az agyban
Az egész agy HSV-1 vírustiterét homogenizált agyszövetből Vero sejteken végzett standard plakk-vizsgálattal határoztuk meg. A szaglógumóból és az agytörzs genomi DNS -éből származó vírustitereknél a PCR-t a korábban leírt módon hajtottuk végre (36). Az UNI szövetéből származó DNS-t párhuzamosan extraháltuk, és negatív kontrollként szolgált.
Statisztika
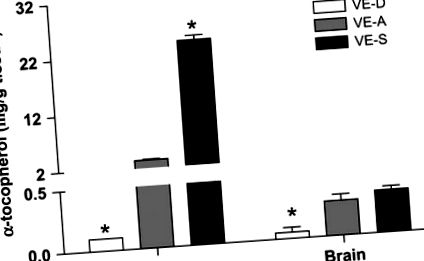
4 hétig VE-D, VE-A és VE-S diétával táplált egerek májában és agyában a-TOC koncentráció. Az adatok az átlag ± SEM, n = 4. * Különbözik a VE-A-tól abban az időpontban, a HSV-1 P6 PFU-jától és követik a HSE tüneteit. A VE-D egereknél a HSE tünetei, valamint a 28,6% -os mortalitás d 7 p.i. volt, míg egyetlen VE-A egér sem halt meg d 7 p.i. (P = 0,03). A VE-A egereknek kevesebb encephalitis tünete volt (és nem volt mortalitás), mint a VE-D egerekben (2. táblázat).
2. TÁBLÁZAT
Fokozott mortalitás és HSE tünetek a VE-D egerekben 1
| % | ||
| VE-D | 28.60 | 2,00 ± 0,44 |
| VE-A | 0,00 | 1,00 ± 0,26 |
| VE-S | 0,00 | 1,58 ± 0,45 |
Vita
A VE-t HSV-fertőzések kezelésére javasolták (39). Ugyanakkor kevés olyan tanulmány létezik, amely megvizsgálta a VE hatását a HSV fertőzésekre (40–42). Míg a VE-vel való kiegészítés vitatottá vált (43,44), az Egyesült Államokban a férfiak 93% -a és a nők 96% -a nem fogyasztja a VE ajánlott napi adagját (45,46), és az NHANES III adatai azt mutatják, hogy sokan alacsony szérum α-TOC szint (47).
Ebben a tanulmányban a VE-hiány növelte a HSE patológiáját, de a VE-kiegészítés nem javította a tüneteket a VE-A egerekhez képest. Amint azt korábban bemutattuk, a VE-A egerekben a HSV-1 fertőzés fokozta a pro- és gyulladáscsökkentő citokinek, antivirális citokinek és kemokinek expresszióját az agyban (37,38). A VE-hiány szignifikánsan növelte ezen mediátorok expresszióját d 7 p.i. összehasonlítva a VE-A egerekkel. Érdekes módon a VE-kiegészítés nem tudta csökkenteni a gyulladást. Noha a VE-kiegészítés egyértelműen növelte a máj α-TOC szintjét, a 10x-es pótlás nem növelte az agy α-TOC szintjét, ami arra utal, hogy az agy szorosan ellenőrzi a sejtmembrán összetételét. Az a tény, hogy a VE-kiegészítéssel nem sikerült növelni a VE agyszintjét, oka annak, hogy a VE-kiegészítés nem befolyásolja az agy citokin- és kemokinszintjét.
A nitrogén-oxid immunközvetítőként működhet, amely idegsejtkárosodáshoz vezet (48). Az iNOS, a nitrogén-oxidot termelő enzim a HSV-1 fertőzés során felfelé szabályozódik. Termelése kettős szerepet játszik a HSV-re adott válaszban, mert az iNOS fontos a fertőzés megszüntetésében (49), de a túl sok káros. Az iNOS-t a HSV-1 fertőzés során időbeli és térbeli mintázatban, a vírus replikációját követően szabályozzák (50). iNOS-gátlók, amelyeket i.n. a HSV-1-vel végzett vizsgálatok kimutatták, hogy jelentősen csökkentik a bénulást és a mortalitást (50). Ez azt sugallja, hogy az iNOS kritikus szerepet játszik a HSV-1 patogenezisében, és hogy a VE-D egerek megnövekedett szintje hozzájárulhat az egerek mortalitásához vezető tényezőhöz.
A mikroglia sejteket a proinflammatorikus citokintermelés forrásaként azonosítják a HSV-1 fertőzés során mind emberben, mind egérben (37,51,52). A HSV-1 fertőzés során a BALB/c egerekből származó mikroglia erőteljes, de nem védő választ vált ki a HSV-1-re (37). A VE-D egerekben a gyulladásos válasz még erőteljesebb volt, mint a VE-A egerekben. Ezen citokinek neurotoxikus természetének fényében (53,54) valószínűleg a VE-D egerek fokozott patogenezise kapcsolódik ehhez a túlságosan robusztus válaszhoz.
A glutamátot a mikroglia szabadítja fel gyulladásgátló ingerek, köztük a citokinek által történő aktiválás után (55). A túlzott glutamát felszabadulás neurotoxikus, idegsejtkárosodást és ideggyulladást eredményez. In vitro a HSV-1-fertőzött mikroglia sejtek neurotoxikus faktorokat szabadítanak fel, amelyek neuronhalált eredményeznek, amikor a felülúszókat neuronkultúrákba viszik át. Ezen anyagok neurotoxikus hatásait részben gátolják az iNOS inhibitorok és az N-metil-D-aszpartát (NMDA) receptor antagonisták (54). Ezért az NMDA receptorokon keresztül az iNOS és a glutamát által kiváltott neurotoxicitás részben felelős lehet a HSV-1-hez kapcsolódó idegsejtek károsodásáért. In vivo, egy NMDA-receptor antagonista beadása a fékezettséggel stresszelt HSV-1 egereknek csökkenti a HSE patológiáját és mortalitását (19). Az agyban a VE-hiány megnövekedett glutamáttermelést eredményez (56). A glutamát növekedésével együtt a VE-D egerekben termelődő proinflammatorikus citokinek magas szintje valószínűleg neurotoxicitáshoz vezetett, amelyet az aktivált mikroglia növekedése felerősíthetett.
A kemokineket és az adhéziós molekulákat a HSV-1 fertőzést követően a VE-A egerekben szabályozzák (10,37,57,58). Ez a válasz még kifejezettebb volt a VE-D egereknél. Kemokinekre és adhéziós molekula expresszióra van szükség ahhoz, hogy a T-sejtek átlépjék a vér-agy gátat és az HSV-1 fertőzés során belépjenek az agyba (57,59). A jövőbeni vizsgálatok a megnövekedett kemokin és adhéziós molekulák hatását vizsgálják a VE-D egerek T-sejt-kereskedelmére. Ezenkívül a periféria magas α-TOC koncentrációja megváltoztathatja a T-sejt működését vagy a VE-S egerek kereskedelmét.
A központi idegrendszeri HSV-1 fertőzés oxidatív stresszt és lipidperoxidációt eredményez (60,61). Mivel a VE-D önmagában növeli az oxidatív stresszt és a lipidperoxidációt (22,62), és a VE-D egerek ebben a vizsgálatban megnövelték a HSV-1 vírusreplikációját, nem volt meglepő, hogy megnőtt a citokin/kemokin termelés p.i. Korábbi tanulmányok bizonyítják, hogy a VE hatékonyan képes szabályozni mind a perifériás, mind a központi gyulladást, valamint csökkenti a betegség viselkedését az LPS-sel kezelt egerekben (63–65). A VE-t nagyon jó jelöltnek tartották a HSE tüneteinek csökkentésére. A 10 × VE-kiegészítés azonban nem tudta növelni az agy α-TOC szintjét a VE-A szint fölé. Ezért a VE-S egerek agyában a citokin és kemokin szintre gyakorolt hatás hiánya nem volt váratlan. Lehetséges, hogy egy hosszabb, 10 × VE-vel történő kiegészítés eléggé megnövelheti az agy α-TOC szintjét ahhoz, hogy védő legyen, ehhez további tanulmányokra lesz szükség.
A citokin és kemokin termelés mellett a HSE tünetei a különböző agyi régiók vírusterhelésének következményei. Kevés tanulmány vizsgálja az antioxidáns hiány hatását a vírus replikációjára. Az elvégzett vizsgálatok közül a szelénhiány fokozott coxsackievirus replikációt eredményez; ez azonban nem befolyásolja az influenza A/PR8 replikációját (66,67). Mind a rezveratrol, egy antioxidáns, mind a helyileg alkalmazott VE csökkentette a HSV-1 replikációját (40,68). Ebben a vizsgálatban a VE-D egereknek az előagyban és az agytörzsben szignifikánsan nagyobb volt a vírusterhelés, mint a VE-A vagy VE-S egerekben. Ez azért fontos, mert ezek a régiók létfontosságúak az egész test homeosztázisának fenntartásához. A hipotalamusz (az elülső agy része) felelős a homeosztázis fenntartásáért a szomjúság, az éhség, a cirkadián ritmus és az autonóm idegrendszer szabályozásának szabályozásával. Az agytörzs szabályozza a légzést, a pulzusszámot és a vérnyomást. Ezekben a régiókban a magas vírustiterek és a gyulladásos citokinek, amelyek neuronkárosodást okoznak, várhatóan megnövekedett mortalitást eredményeznek a VE-D egereknél. Az a megállapítás, hogy a VE-A és a VE-S egerek hasonló titerekkel rendelkeznek, nem meglepő, mivel a 10x-es kiegészítés nem volt hatásos az α-TOC agyszintjének megváltoztatásában.
Összességében ezek az adatok azt jelzik, hogy a VE-D egerek globálisan nem képesek megfelelő immunválaszt kialakítani egy központi HSV-1 fertőzésre, és a 10 × VE-S nem képes csökkenteni a HSE tüneteit. Ezek a megállapítások azért fontosak, mert az Egyesült Államokban az emberek többsége nem fogyaszt elegendő mennyiségű VE-t étrendjében, ami arra utal, hogy a HSV encephalitis és talán más vírusfertőzések elleni immunvédelem sem lehet optimális.
Köszönetnyilvánítás
A szerzők köszönetet mondanak Dr. Allen Smith-nek, az USDA-nak a VE-elemzés elvégzéséért, valamint Dr. Orville Levander-nek és Alexia Smith-nek az éleslátó beszélgetésért.
Lábjegyzetek
1 Részben az Országos Környezetegészségügyi Tudományok Intézetének támogatásával (P30ES10126) és az NIH támogatásával az Észak-Karolinai Egyetem Klinikai Táplálkozási Kutatási Egységéhez (DK56350).
2 A szerző nyilvánosságra hozatala: P. A. Sheridan és M. A. Beck, nincsenek összeférhetetlenségek.
- A. VITAMIN, FERTŐZÉS ÉS IMMUN FUNKCIÓ A táplálkozás éves áttekintése
- A D-vitamin-hiány elősegíti a prosztata hiperpláziát a középkorú egerekben, súlyosbítva a lokális
- Az étrendi sokféleség szerepe a nem szövődményes súlyos akut kezelésre adott válaszban
- A C-vitamin hatása az I. és III. Típusú kollagén arányára az egerek periprosthesis területén
- A bél zsírsavkötő fehérje nem elengedhetetlen az étrend zsírfelszívódásához egerekben -