Az elhízás hatása a zsírraktárakban és az adipokinekben a csont homeosztázisra
Jiewen Jin 1, Yicun Wang 1, Hui Jiang 1, Nikolaos Kourkoumelis 2, Yves Renaudineau 3, Zhantao Deng 1 *
Hozzászólások: (I) Koncepció és tervezés: J Jin, Z Deng; (II) Igazgatási támogatás: Z Deng, Y Wang; (III) Tananyag vagy betegek biztosítása: Y Wang, H Jiang; (IV) Adatok gyűjtése és összegyűjtése: J Jin, Y Wang; (V) Adatok elemzése és értelmezése: J Jin, H Jiang, N Kourkoumelis, Y Renaudineau; (VI) Kéziratírás: Minden szerző; (VII) A kézirat végleges jóváhagyása: Minden szerző.
* Az AME Ortopédiai Sebészeti és Endokrin Betegség Együttműködő Csoport nevében írták.
Kulcsszavak: Zsírszövet; csont homeosztázis; velő adipozitás; adipokinek
Beérkezett: 2017. július 03 .; Elfogadva: 2017. november 28 .; Publikálva: 2018. január 11.
Bevezetés
Az elmúlt 4 évtizedben az elhízás világszerte komoly veszélyt jelent a közegészségügyre (1). A krónikus betegségek anyagcsere-kockázati tényezőinek globális terhe Együttműködő Csoport 9,1 millió felnőttet vizsgált 1980 és 2008 között, és arról számolt be, hogy az elhízás globális előfordulása csaknem megduplázódott, és körülbelül 1,5 milliárd felnőtt testtömeg-indexe (BMI) legalább 25 (34%) volt. és 500 millió elhízottnak minősített felnőtt 2008-ban (2). Egy újabb elemzésben a Global Burden of Disease 2013 azt mutatta ki, hogy a 25-ös vagy annál nagyobb BMI-vel rendelkező felnőttek aránya a férfiaknál 29% -ról 37% -ra, a nőknél 30% -ról 38% -ra nőtt 1980 és 2013 között (3). ).
Ez a paradoxon részben az elhízás és a csontanyagcsere károsodásának kölcsönhatásával magyarázható, amelyet nagymértékben befolyásol a rendellenes helyi zsírlerakódás és a váladék. Ennek következményeként a szubkután és a zsigeri térségbe történő regionális zsírlerakódás mintázata a betegség kockázatának erősebb előrejelzőjét mutatja, mint a teljes zsírtömeg (13,14). Nemrégiben megjelent egy új patofiziológiai mechanizmus, amely leírja, hogy a csontvelőben megnövekedett zsír hogyan befolyásolja az oszteoblaszt differenciálódását és működését, növeli-e az oszteoklasztikus aktivitást és zavarja a mineralizációt (15). Továbbá, mivel a zsírszövet rendkívül dinamikus szerv, amelynek döntő szerepet játszik az endokrin és az anyagcsere szerepe, a citokinek (általában adipokinek), beleértve a leptint (16), az adiponektint (17), az omentint (18) stb., Így a zsírszövet által ilyen termelés igen feltételezhetően befolyásolja a csont és a zsír közötti homeosztázist.
Itt a zsírszövet és a csont egészségének kölcsönhatását tekintjük át a zsírszövet eltérő lerakódásának és az adipokinek csontanyagcserében gyakorolt hatásának felmérésével.
A zsírszövet különböző lerakódásának szerepe kölcsönhatásban a csont homeosztázissal
A zsírfunkció a zsírlerakódás helyétől függően változik, és általában a zsírszövet két fő helyét veszik figyelembe: a szubkután és a zsigeri lerakódást. A szubkután zsírszövethez (SAT) képest a zsigeri zsírszövet (VAT) sejtesebb, vaszkulárisabb, beidegzettebb, és több gyulladásos és immunsejtet alkalmaz, kisebb az adipocita előtti differenciálóképesség és nagyobb a nagy zsírsejtek aránya (19). Nemrégiben megvitatták a velő zsírszövetének (MAT) a csontanyagcserében betöltött szerepét (20). Számos vizsgálatban fordított összefüggést figyeltek meg a MAT és a csont ásványi sűrűsége között (21–23).
Szubkután vs. ÁFA
Az elhízást kezdetben feltételezték a törés elleni védelmi tényezőként, miközben a klinikai bizonyítékok nem voltak következetesek. Travison és mtsai. (24) 1171, 30–79 éves férfit vettek be keresztmetszeti vizsgálatba, és a BMD-t, a keresztmetszetben lévő csontanyagot, a hajlítószilárdságot és a kompressziós csatra való hajlandóságot kettős energiájú röntgenabszorpciós (DXA) módszerrel tesztelték. A zsírtömeg és a BMI negatív kapcsolatban állt a csípő erejével a sovány tömeg monitorozása után. A BMI védőhatása a törések megelőzésében a megemelkedett BMI-vel járó megnövekedett izomtömegnek tulajdonítható, nem pedig a zsírszövetnek. Hasonló következtetéseket vontak le ivarérett serdülőkkel és 13–21 éves fiatal felnőttekkel (25). A tanulmányok azt sugallták, hogy a zsírtömeg negatív kapcsolatban áll az afrikai és kínai nők csonttömegével (26,27). Zhang és mtsai. (28) 347 kínai elhízott nőt és 339 kínai elhízott férfit vett fel, és megállapította, hogy a megnövekedett központi testzsír inverz összefüggésben van a teljes és a láb BMD-vel nőknél, de nem a férfiaknál.
MAT - új nézet és célpont
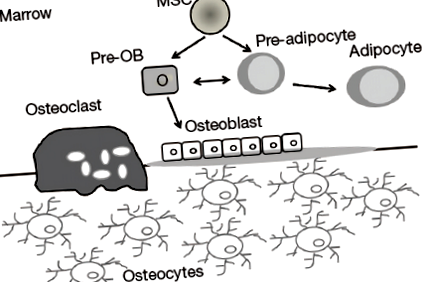
A közelmúltban a MAT nagy figyelmet szentelt a csont homeosztázisát felmérő kutatóknak. A csontvelő az egyetlen hely, ahol a csont és a zsír egymás mellett fekszik (21). Ezenkívül egy mesenchymalis progenitor található a velőben, amely képes osteoblastokat, adipocitákat és myocytákat létrehozni (35). Széles körűen alátámasztják azt a hipotézist, miszerint a csontvelő mesenchymális stromális sejtek (BMSC-k) csak egy nemzetségbe kerülnek egymást kizáró módon, és hogy ezt a „választást” az érés során rendezett módon határozzák meg, amelyet specifikus transzkripciós faktorok és hormonok vezéreltek ( 36). Az alacsony csonttömegű anyagcsere-rendellenességekben a MAT növekedése és annak megfigyelése, hogy az oszteoblasztok és az adipociták a mesenchymalis progenitorok közös készletéből származnak, kiegyensúlyozott kompromisszumot jelent a csont- és zsírtömeg között, az adipociták fokozott képződése pedig az oszteoblasztok kárára vezet a csonttömeg csökkentésére (1. ábra) (4).
1-es típusú cukorbetegségben magas MAT-t figyeltek meg, amely rendellenes kortikális csontgeometriával és magas törési kockázattal járt (37,38). A spontán és indukált 1-es típusú cukorbetegség két egérmodelljében a proximális sípcsont mind az adipocita mRNS markerek MAT-számának, mind a szintjének jelentős növekedését mutatta, mint például a peroxiszóma proliferátor-aktivált gamma receptor (PPARG) és a zsírsavat kötő fehérje (FABP) 4 mRNS, az ásványi sűrűség és a csonttérfogat-frakció csökkenésével együtt, főleg trabekulárisan és kisebb mértékben a kortikális csontban, valamint az osteocalcin mRNS-ben (39). A PPARG egy ligandumfüggő transzkripciós faktor, amely szabályozza a lipid- és glükóz homeosztázisban szerepet játszó géneket, beleértve az FABP4-et is. Viszont a FABP4 megköti a zsírsavakat, és a FABP4/zsírsav komplex pozitív visszacsatolási hurok alatt aktiválja a magban a PPARG-t. A PPARG antagonistával, a biszfenol-A-diglicidil-éterrel (BADGE) végzett kezelés megakadályozta a velő adipozitásának felhalmozódását, de nem a csontvesztést a cukorbetegségben (40), míg a vad típusú felnőtt egerek BADGE kezelése fokozott csontképződést és csökkent csontvelő adipogenezist eredményezett (41).
Osteoporosisban szenvedő betegeknél a megnövekedett MAT-t jelentették először Meunier és mtsai. (46) Az Age Gene/Environment Supceptibility-Reykjavik kohorsz egy nemrégiben készült keresztmetszeti vizsgálata azt mutatta, hogy a magas MAT negatívan korrelált a nőknél a trabecularis BMD-vel, és pozitívan korrelált a férfiak gyakori csigolyatöréseivel (47). Mind az osteoporosis, mind az osteopenia a telítetlen lipidek alacsony arányához kapcsolódott, proton mágneses rezonancia spektroszkópiával (1H-MRS) értékelve (48). Rágcsálómodellekben az öregedés jelentős velőadipozitással járt, és ezt a megállapítást összekötötték a rágcsálók (49), valamint az emberek (47) alacsony trabecularis csontásványsűrűségével, ami kölcsönösen kizáró folyamatra utal.
Adipokin - kapcsolat a zsírszövet és a csont homeosztázis között
A zsírszövet dinamikus és összetett szervet képvisel, endokrin, metabolikus és immunszabályozó szerepekkel. Szekréciós szervként a zsírszövet jellemzői a zsírraktáraktól (zsigeri, szubkután vagy velő) és a sejtösszetételtől (érett adipociták, stroma-vaszkuláris sejtek és nem zsíros immunsejtek, beleértve a makrofágokat is) függenek (50). A hipertrófiás adipociták a szabályozatlan adipokin és kemokin termeléssel függtek össze (51). Elhízott egyéneknél az adipokinek szerepet játszanak a gyulladás és az inzulinrezisztencia patogenezisében. Így a leptin, a rezisztin, a kemerin és a visfatin-1 túlexpresszálódott, míg a gyulladáscsökkentő tulajdonságokkal rendelkező adipokinek, mint például az adiponektin és az omentin, csökkentek (52,53).
A leptin szerepe a csontanyagcserében
A leptin az egyik legfontosabb citokin, amely a zsírszövetből kiválasztódik, és szerepét széles körben emlegetik az energia homeosztázisában és az energiafelhasználás szabályozásában. Az elmúlt években rájöttünk, hogy a leptin szintén fontos szerepet játszik a neuroendokrin szabályozásban és a csontanyagcserében (54,55). A leptin termelés pozitív korrelációt mutatott a BMI-vel és a zsírtömeggel (56). Azokban az egerekben, amelyek kettős null mutációval rendelkeznek a leptin génben (ob/ob egerek) és a leptin receptorokban (db/db), magas csonttömegű fenotípust figyeltek meg a vad típusú egerekhez képest (57,58). Ezenkívül a leptin génterápiájának központi beadása képes volt korrigálni az ob/ob egerek csontrendszeri rendellenességeit (59), ami arra utal, hogy a hipotalamusz leptinnek meghatározó szerepe van a csontnövekedés normalizálásában. A legújabb tanulmányok kimutatták, hogy a leptinnek eltérő hatása van a csontváz különböző részeire. Ob/ob egerekben fokozott csontképződést figyeltek meg a csigolya hosszában, az ágyéki csont ásványi sűrűségében, valamint a megnövekedett trabecularis csontmennyiségben (60). Az apendikuláris régió csontképződése azonban csökkent, rövidebb a combcsont, alacsonyabb BMD, csökkent kortikális vastagság és trabecularis csontmennyiség, összehasonlítva a vad típusú egerekkel (61).
Az adiponektin szerepe a csontanyagcserében
A keringő adiponektin szint negatívan korrelál az elhízott alanyok BMI csökkenésével (79). Az adiponektin megakadályozza a zsírszövet gyulladását, oxidációját és fibrózisát az NF-kB útvonal gátlásán keresztül (80), amely szabályozza a tumor nekrózis faktor- (TNF-), interleukin-6 (IL-6), monocita kemoattraktáns fehérje - expresszióját. 1 (MCP-1), vaszkuláris sejt-adhéziós molekula-1 (VCAM-1), intercelluláris adhéziós molekula-1 (ICAM-1) és endothel-leukocita adhéziós molekula 1 (ELAM-1) expressziója (50). Ezenkívül az adiponektin az emberi monocitát gyulladásgátló M2 makrofágokká, valamint a „káros” Th1/17-ből „hasznos” Th2/Treg-vé alakítja a TLR4 által közvetített NF-kB aktiváció gátlásával (81).
A csontanyagcserében részt vevő egyéb adipokinek
A rezisztint elsősorban az ízületi fehér zsírszövet állítja elő, és részt vesz az adipogenezisben, az inzulinrezisztenciában és a gyulladásos folyamatokban. Az éhomi rezisztin plazmaszintje szignifikánsan korrelált a combcsont BMD-vel osteoporosisban szenvedő betegeknél (84). A plazma visfatin szintje pozitív korrelációban volt a BMD L2 – L4-vel metabolikus szindrómás férfiaknál (85). A viszfatin underexpresszáló tényezők, például az SOX9 és a II. Típusú kollagén magas koncentrációja, amelyet elengedhetetlennek tartanak a kondrocita fenotípus fenntartása szempontjából (86). Az Omentin-1 humán oszteoblaszt-proliferációt indukál a PI3K/Akt jelátviteli úton (87). A synovialis folyadékban található Omentin-1 potenciális biomarkerként bizonyítható a térd osteoarthritisének degeneratív folyamatában és tüneti súlyosságában (88).
Következtetések
A zsír és a csont komplex kapcsolata szisztémás és lokális interakcióvá bontható (89). A zsír és a csont közötti szisztémás kölcsönhatás a perifériás zsírszövet által felszabadított adipokinekre (például szubkután és viscerális) utal, és negatív vagy pozitív módon befolyásolja a csontanyagcserét (90,91). Ezzel szemben a helyi kölcsönhatás a csontvelőben lévő zsírsejtekre vonatkozik (20,92).
Az adipokinek szerepe a csontanyagcsere szabályozásában nem teljesen egyértelmű. A leptin, az egyik legfontosabb csont-adipokin, központi jelzéssel szabályozza a csont homeosztázisát, míg perifériás úton közvetlenül szabályozhatja az oszteoblasztogenezist és a velő adipogenezist. Másrészt az adiponektin inverz hatással van a leptinre a csontanyagcserére, de központi és perifériás utakon keresztül is működik. Egyes adipokinek (például rezisztin, visfatin és omentin-1) szerepét a csontanyagcserében azonban még nem vizsgálták teljes mértékben. A különböző adipokinek közötti kölcsönhatásokat szintén rosszul értik.
Ezenkívül a helyi zsírszövet szerepe számos okból továbbra is kihívást jelentő kérdés: egyrészt a MAT osztályozása és funkciója nem egyértelmű, mivel a magas velő-zsírosodás és az alacsony csonttömeg negatív összefüggése összezavarodott és az életkor függvényében változik. Másodszor, a MAT és a fehér zsírraktárak (köztük a SAT és az VAT) kapcsolata nagyon összetett, mivel a csontvelő adipociták általában felhalmozódnak, amikor a fehér zsírraktárak kimerülnek. Mindazonáltal a SAT/VAT és a MAT pontos hatását a csontanyagcserére még vizsgálják. Harmadszor, a MAT eredete és az, hogy ezek a sejtek hogyan lépnek kölcsönhatásba az oszteoblasztokkal és a vérképző elemekkel, nagyrészt nem ismert.
Összegzésként elmondható, hogy bár az elhízás és a különböző zsírraktárak egyértelműen befolyásolják a csont homeosztázisát számos részletes útvonalon keresztül, a pontos mechanizmusok további vizsgálatra szorulnak.
Köszönetnyilvánítás
Lábjegyzet
Érdekkonfliktusok: A szerzőknek nem jelentenek be összeférhetetlenséget.
- Az elhízás környezeti hatása longitudinális bizonyíték az Egyesült Államoktól - ScienceDirect
- Az NL Times tanulmánya a gyermekkori elhízás eseteinek ötöde mögött álló orvosi problémák mögött áll
- Az elhízás és az anyagcsere-szindróma hatása az oltási sikerre - összefoglaló - vakcinák idősebbeknek
- Az elhízás és a szív- és érrendszeri betegségek családi hajlamának hatása a gyermekkori elhízásra
- Az elhízás betegségként való felvétele American Veterinary Medical Association