Az étrendi koleszterin nem roncsolja a szívét, de megöli a máját
Absztrakt
Egyre elfogadottabb, hogy az étrendi koleszterin sokkal alacsonyabb hatással van a szív- és érrendszeri betegségek progressziójára, mint azt korábban feltételezték. Úgy tűnik azonban, hogy mind az állatkísérletek, mind az emberi vizsgálatok alátámasztják azt a nézetet, hogy az étrendi koleszterin hozzájárulhat a jóindulatú steatosisról a potenciálisan végzetes alkoholmentes steatohepatitisre való áttéréshez. A koleszterin-észterek és a koleszterin felhalmozódnak a májsejtekben, és rontják annak működését. Ez oxidatív stresszhez és endoplazmatikus retikulum stresszhez vezet, amely kiváltja a gyulladásgátló citokinek felszabadulását, és a hepatocitát hajlamosabbá teszi az apoptotikus vagy nekrotikus sejtpusztulásra. A Kupffer-sejtek a haldokló hepatociták köré csoportosulnak, és fagocitálják a hepatocita-törmeléket és a lipideket. Ezenkívül májsejtekből felszabaduló lipidperoxidációs termékeknek vannak kitéve. Az így aktivált Kupffer-sejtek gyulladást és fibrózist elősegítő gyulladáscsökkentő, kemotaktikus és profibrotikus citokineket szabadítanak fel. Ezért az étkezési koleszterin káros lehet a májra, különösen többszörösen telítetlen zsírsavakkal együtt alkalmazva, amelyek elősegítik a lipidperoxidációt.
Ateroszklerózis és étrendi koleszterin: történelmi áttekintés
Az étrendi koleszterin és a szív- és érrendszeri betegségek jelenlegi nézete
A régebbi adatok kritikus átértékelése, valamint az esetleges zavaró tényezőkre korrigált új tanulmányok, amelyeket a korai epidemiológiai vizsgálatok nem vettek figyelembe, cáfolta azt a hipotézist, miszerint az étrendi koleszterin jelentős hatással van a szív- és érrendszeri betegségek kialakulására, 10 bár ez a nézet nem egyértelmű - ellentmondanak. 11 Maga az étkezési koleszterin helyett relevánsnak tűnik egyéb táplálkozási tényezők, amelyek egybeesnek az étrendi koleszterin felvételével az állati fehérjében gazdag étrendben. 12 Ezért a jelenlegi táplálkozási ajánlások tartalmazzák az állati termékek bevitelének csökkentését és a teljes kiőrlésű gabona bevitelének növelését. Különösen a telített zsírsavak helyettesítése mono- és többszörösen telítetlen zsírsavakkal az étrendben a jelenlegi ajánlások része (pl. Lásd az egészséges táplálkozást a http://www.heart.org oldalon). 13–15
A máj fiziológiai szerepe a koleszterin anyagcserében
A bélhámsejtek mellett valószínűleg a hepatocita az egyetlen hely, ahol jelentős mennyiségű koleszterin távolítható el a szervezetből, akár szabad koleszterin formájában történő kiválasztással, akár epesavvá történő átalakulás után. Ha a koleszterinellátás meghaladja a hepatocita epesav szintézis és koleszterin szekréció képességét, a koleszterin eldobásának egyetlen biztonságos módja a hepatocitában átmenetileg tárolt koleszterin észterek képződése.
Bizonyíték az étrendi koleszterin NASH fejlődésére gyakorolt hatásáról
Az alkoholmentes zsírmájbetegség (NAFLD) a metabolikus szindróma máj megnyilvánulása. 16 Elterjedtsége növekszik a túlsúlyos és elhízott betegek populációban való növekvő arányának eredményeként. Míg az egyszerű steatosis, bár klinikai jelentőségű, teljesen reverzibilisnek tűnik, a betegség súlyosabb formái, az alkoholmentes steatohepatitis (NASH) krónikusan progresszív betegség, amely fibrózishoz, cirrhosishoz és végül hepatocelluláris carcinomához vezet. Jelenleg a NASH a terminális májelégtelenség leggyakoribb oka a nyugati társadalmakban. 17 Az intenzív kutatások ellenére nem világos (1), hogy a NAFLD és a NASH ugyanazon betegségnek különböznek-e az időbeli szakaszai, és ha igen (2) melyek azok a molekuláris mechanizmusok, amelyek kiváltják a progressziót. A legfrissebb bizonyítékok szerint az étrendi koleszterin kritikus szerepet játszhat ebben a folyamatban.
Az étrendi koleszterin májpatológiára gyakorolt hatását tulajdonképpen már az ateroszklerózis kialakulásában betöltött szerepe előtt leírták. 1 Az ateroszklerózisról szóló alapművében Anitschkow leírja azokat a korábbi munkákat, amelyekben a tojássárgája nyulakkal történő táplálása a máj parenchymájának zsírszerű anyagokkal való rendkívül gazdag beszivárgását eredményezte, amelyet mindig „a parenchymás degeneráció erősen kifejezett területei” kísértek. . Az étrendi koleszterin ezen aspektusa azonban jórészt feledésbe merült. Csak a NASH nemrégiben bekövetkezett megugrása és a NASH megfelelő rágcsáló-modell felkutatása után vált fel az érdeklődés az étrendi koleszterin máj steatosisra és gyulladásra gyakorolt hatása iránt. Míg számos, a metabolikus szindrómához hasonló állapotot kiváltó étrenden alapuló állatmodell májrákot okoz a rágcsálóknál, ezeknek a diétáknak a többsége nem okoz májgyulladást és fibrózist állatokban. Másrészt a májgyulladást és fibrózist reprodukálhatóan kiváltó étrendi beavatkozások, például kolin-metioninhiányos étrend, nem képesek reprodukálni a metabolikus szindróma tüneteit, ami azt jelzi, hogy a fibrózis kialakulását kiváltó mechanizmusok eltérnek az emberi NASH-tól. 18.
Ezen megállapítások élettani relevanciájának alátámasztása emberekben is, a dylipidémiás betegek sztatinok kombinációjával történő kezelése, amelyek gátolják az endogén koleszterinszintézist, és az ezetimib, egy koleszterinfelvétel-gátló, a plazma LDL-koleszterinszintjének csökkentése, a máj steatosisának javulása és a valamint az AST, az ALT és a γGT plazmaszintje számos tanulmányban. 35 Jelenleg azonban nem világos, hogy ezek a hatások kizárólag az enterális koleszterinfelvétel ezetimib általi gátlásának tulajdoníthatók-e. 36 Az étrendi koleszterin relevanciájának további alátámasztása a NASH kialakulása szempontjából nemrégiben bebizonyosodott, hogy a tojásfogyasztás pozitívan kapcsolódott a NAFLD kockázatához. 37 Míg tehát egyre inkább elismerik, hogy a korábbi feltételezésekkel ellentétben az étrendi koleszterin csak csekély jelentőséggel bír a szív- és érrendszeri betegségek kialakulásában, a 38–40 diétás koleszterin releváns szereplőnek tűnik a NASH fejlődésében. A mögöttes mechanizmusok azonban még nem tisztázottak.
A koleszterin által okozott NASH-indukció mögött álló potenciális molekuláris mechanizmusok
Koleszterin felhalmozódás a hepatocytában
Asztal 1
Az étrend hatása a szérum lipidekre, a máj lipid felhalmozódására, a máj gyulladására és a máj fibrózisára.
Oxidatív stressz
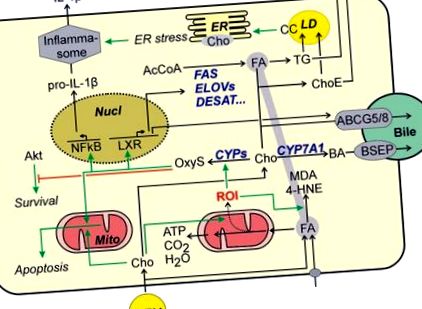
Maga a koleszterin is oxidatív módosításoknak van kitéve. Az oxysterolok szintje megemelkedik a NAFLD-ben szenvedő betegeknél 53, és úgy tűnik, hogy okozói a NASH fejlődésében. Míg az LXR-en keresztüli oxiszterolok olyan utakat indukálnak, amelyek eltávolítják a koleszterint a sejtből, és ezáltal csökkentik a sejt koleszterinterhelését (1. ábra, 1. ábra), a fajtól függően az oxiszteroloknak is lehetnek káros hatásai. Így a 25-hidroxi-koleszterinről kimutatták, hogy fokozza a hepatociták gyulladásos válaszát az NFκB aktiválása révén 54, míg konjugációs terméke, a 25-hidroxi-koleszterin-3-szulfát gyengíti a gyulladást. Számos oxiszterol indukálhatja az apoptózist azáltal, hogy kiváltja a mitokondriális apoptotikus útvonalat 55 hepatoma sejtekben vagy primer patkány hepatocitákban, ha a sejteket oxiszterolok és zsírsavak kombinációjának teszik ki. Ezenkívül úgy tűnik, hogy az oxiszterolok hozzájárulnak a sejthalálhoz az Akt-függő túlélési utak antagonizálásával (1. ábra: 1. ábra) .56 Bár egy másik vizsgálatban az oxiszterolok nyilvánvalóan nem csökkentették a májsejtek életképességét, 57 mégis hozzájárulhatnak a NASH fejlődéséhez a nem parenchymás májsejteken keresztül (lásd alább).
A szabad koleszterin a hepatocita apoptózis és nekrózis kiváltó tényezőjeként
A koleszterin biztonságosan tárolható a koleszterin-észterekben. Ez a tárolás azonban csökkent a NASH betegeknél. A koleszterinszintézis visszacsatolt gátlásán kívül (lásd fent) a koleszterin-észter-hidroláz aktivitásának növekedése hozzájárulhat a szabad koleszterinszint növekedéséhez. 58 A szabad koleszterin koncentrációja a májkárosodás előrehaladtával növekszik. 59
A szabad koleszterinszint változása ER stresszt okozhat. Az IRE1α-XBP-1 út 42,60 ER stressz által indukált aktiválása tovább ösztönözheti a steatózist azáltal, hogy a triglicerid bioszintézis kulcsfontosságú enzimeit indukálja. Ezenkívül az ER stressz a gyulladásos sejt aktiválódását eredményezheti (1. ábra (1) ábra) és az azt követő növekedést az IL-1β termelésben a hepatocitákban, 61 amely közvetlenül összekapcsolja a koleszterin felhalmozódását a gyulladásos válasz kiváltásával. Ezenkívül a koleszterin által kiváltott ER stressz kiválthatja a hepatocita apoptózist, vagy szenzibilizálhatja a hepatocytákat más proapoptotikus jelekre. Egy másik vizsgálatban nem figyeltek meg apoptotikus utak ER stressz-közvetített aktiválódását. Ehelyett a szabad koleszterin felhalmozódása a mitokondriumokban a mitokondriális redukált glutation kimerülését és a TNFα vagy FAS által indukált apoptózis és nekrózis ellen szenzibilizált hepatocitákat okozta, elősegítve ezzel a NASH fejlődését. 62
A legfrissebb bizonyítékok arra utalnak, hogy az intracelluláris szabad koleszterinszint növekedése befolyásolhatja a lipidforgalom szabályozását azáltal, hogy zavarja a lipidcseppek bevonatában lévő fehérjék működését. Megfigyelték a koleszterin kristályok képződését a lipidcseppeket körülvevő foszfolipid monorétegben 63, és korreláltak a steatosis NASH-val való előrehaladásával. Míg a májsejtben a koleszterin kristályok kezdeti képződése elősegítette a hepatocita pusztulását, az elhalt hepatociták maradék lipidcseppjeit Kupffer-sejtek koronaszerű struktúrákban vették körül. Míg a koleszterin kristályok csak a májsejtekben található lipidcseppek külső rétegében voltak megtalálhatók, feltehetően a koleszterin-észterek további hidrolízise miatt a Kupffer-sejtek lizoszmális enzimjei a koronaszerű struktúrákon belüli lipidcseppmaradványok nem csak a lipidcseppek bevonatában, hanem a magjukban is. 27 A koleszterin kristályokat fagocitáló Kupffer-sejtek habsejtekké fejlődnek és gyulladásos reakcióval reagálnak (2. ábra (2. ábra)).
A nem parenchymás májsejtek koleszterinfüggő aktiválása. A Kupffer-sejtek koronaszerű struktúrákat képeznek a hepatocita törmelék és a lipidcseppek körül. A lizoszomális enzimek hasítják a koleszterin-észtereket, lehetővé téve a koleszterin kristályok képződését. A Kupffer-sejtek fagocitálják a hepatocita törmeléket, a lipideket és a koleszterin kristályokat, és ezáltal aktiválódnak, hogy gyulladásgátló és pro-fibrotikus citokineket állítsanak elő. Végül a Kupffer-sejtek lipiddel terhelt habsejtekké alakulnak. A hepatocitákból felszabaduló oxiszterolok és lipid-peroxidációs termékek tovább stimulálhatják a gyulladásgátló és pro-fibrotikus citokinek felszabadulását a Kupffer-sejtekből, valamint metalloproteinázok szöveti inhibitorainak termelését, amelyek gátolják az extracelluláris mátrixfehérjék lebomlását. A koleszterin és a Kupffer-sejtekből származó TGFβ elősegíti a sztellátsejtek myofibroblasztokká való transzdifferenciálódását, amelyek túlzott mennyiségű extracelluláris mátrixfehérjét termelnek, elősegítve a fibrózis kialakulását. 4-HNE = 4-hidroxinonenal, IL = interleukin, MCP1 = monocita kemoattraktáns fehérje 1, TGFβ = transzformáló növekedési faktor β, TIMP = metalloproteinázok szöveti inhibitora.
A Kupffer-sejt és a csillagsejt-aktiváció
A koleszterin-kristályok kiválthatják a gyulladásos választ a THP 27-es makrofágokban vagy az elsődleges Kupffer-sejtekben, 26 fagocitázó apoptotikus vagy nekrotikus hepatocita lipidcseppekben. A gyulladás zónájában felszabaduló lipolitikus enzimek felszabadíthatják a koleszterint a koleszterin-észterekből, és ezáltal fokozhatják a koleszterin kristályképződést (2. ábra. 2. ábra). A Transwell-kísérletek azt mutatták, hogy a kristályok közvetlen érintkezése és fagocitózisa kötelező. A koleszterin kristályok aktiválhatják az NLRP3 gyulladást és ezáltal elősegíthetik az IL-1β és IL-18 aktiválódását prekurzoraikból. Következésképpen az NLRP3 gyulladás gátlása csökkentette a májgyulladás és a fibrózis súlyosságát a NASH genetikai vagy étrend által kiváltott egérmodelljeiben. A koleszterinről kimutatták, hogy elősegíti a máj sztellátsejtjeinek myofibroblastokká történő transzdifferenciálódását (2. ábra (2. ábra) 2), és ezáltal hozzájárulhat a májfibrózis kialakulásához. 65
Mint fentebb említettük, az oxidatív stressz döntő tényező a NASH kialakulásában. A hepatocita közvetlen károsodásán kívül a lipid oxidációs termékek aktiválhatják a gyulladásos reakciót a Kupffer-sejtekben. Így a 27-hidroxi-koleszterin 4-hidroxinonénnel kombinálva, mindkettő lipid oxidáció terméke, aktiválhatja a TLR4 jelátvitelt és NFκB aktivációt okozhat az érelmeszesedés állatmodelljeiben. Hasonló mechanizmust javasoltak a NASH gyulladásához hozzájáruló potenciális mechanizmusként (2. ábra (2. ábra). 48 Ezenkívül az oxiszterolok fokozták a TGFβ és MCP1 expressziót a Kupffer sejtekben, valamint az IL-8 és a TIMP májkiválasztását. stellátus sejtek, és ezáltal hozzájárulhatnak a gyulladáshoz és a fibrózishoz
Záró megjegyzés
Míg az étrendi koleszterin nyilvánvalóan jóval alacsonyabb hatással van a szív- és érrendszeri betegségek progressziójára, mint azt korábban feltételeztük, mind az állatkísérletek, mind az emberi vizsgálatok alátámasztják azt a nézetet, hogy az étrendi koleszterin hozzájárulhat a jóindulatú steatosisról a potenciálisan halálos NASH-ra való áttéréshez. Az étrendi koleszterin káros lehet a májra, különösen többszörösen telítetlen zsírsavakkal együtt alkalmazva, amelyek elősegítik a lipidperoxidációt. Ez a megállapítás különösen releváns, figyelembe véve a telített zsírok többszörösen telítetlen zsírokkal történő helyettesítésére vonatkozó legújabb ajánlásokat a szív- és érrendszeri betegségek megelőzése érdekében, anélkül, hogy kifejezetten javasolnánk a koleszterin bevitel egyidejű csökkentését. 66
Köszönetnyilvánítás
A rövid áttekintés irodalmi felsorolása korántsem teljes körű. Sok szerző releváns munkájára nem hivatkoztak. Kérjük, fogadja őszinte bocsánatkérésünket.
Finanszírozás
A szerzők kutatását részben a DFG HE 7032/1-1 támogatása finanszírozta.
Összeférhetetlenség
A szerzőknek nem jelentenek összeférhetetlenséget.
- Zsíros májbetegség és a szíved - Harvard Health
- Szüksége van-e a pajzsmirigy étrendi szénhidrátokra
- A hús a szívbetegséget okozza-e a legjobb (és legrosszabb) hús a szívének
- Egyél a koleszterinszint csökkentése érdekében Szív és Stroke Alapítvány
- Az étrendi koleszterin a bél mikrobiotájának és a