Az LTβR hiánya növeli az IPEC-J2 sejtek érzékenységét a sertés járványos hasmenés vírusra
Tawfeek Altawaty
1 Állattudományi Intézet, Kínai Agrártudományi Akadémia, Peking 100193, Kína; moc.liamxof@keefwat (T.A.); moc.621@0902ululuil (L.L.); nc.saac@gnocoat (C. T.); nc.saac@auhoahsuoh (S.H.); nc.saac@iukil (K.L.)
Lulu Liu
1 Állattudományi Intézet, Kínai Mezőgazdasági Tudományos Akadémia, Peking 100193, Kína; moc.liamxof@keefwat (T.A.); moc.621@0902ululuil (L.L.); nc.saac@gnocoat (C. T.); nc.saac@auhoahsuoh (S.H.); nc.saac@iukil (K.L.)
2 Állattudományi Tanszék, Kínai Mezőgazdasági Egyetem, Peking 100193, Kína
Hongyong Zhang
3 Állami kulcsfontosságú reproduktív biológiai laboratórium, Állattani Intézet, Kínai Tudományos Akadémia, Peking 100101, Kína; moc.361@648gnoygnohgnahz
Cong Tao
1 Állattudományi Intézet, Kínai Mezőgazdasági Tudományos Akadémia, Peking 100193, Kína; moc.liamxof@keefwat (T.A.); moc.621@0902ululuil (L.L.); nc.saac@gnocoat (C. T.); nc.saac@auhoahsuoh (S.H.); nc.saac@iukil (K.L.)
Shaohua Hou
1 Állattudományi Intézet, Kínai Mezőgazdasági Tudományos Akadémia, Peking 100193, Kína; moc.liamxof@keefwat (T.A.); moc.621@0902ululuil (L.L.); nc.saac@gnocoat (C. T.); nc.saac@auhoahsuoh (S.H.); nc.saac@iukil (K.L.)
Kui Li
1 Állattudományi Intézet, Kínai Agrártudományi Akadémia, Peking 100193, Kína; moc.liamxof@keefwat (T.A.); moc.621@0902ululuil (L.L.); nc.saac@gnocoat (C. T.); nc.saac@auhoahsuoh (S.H.); nc.saac@iukil (K.L.)
Yanfang Wang
1 Állattudományi Intézet, Kínai Mezőgazdasági Tudományos Akadémia, Peking 100193, Kína; moc.liamxof@keefwat (T.A.); moc.621@0902ululuil (L.L.); nc.saac@gnocoat (C. T.); nc.saac@auhoahsuoh (S.H.); nc.saac@iukil (K.L.)
Társított adatok
Absztrakt
1. Bemutatkozás
A limfotoxin béta-receptor (LTβR) a tumor nekrózis faktor (TNF) receptor szupercsaládjába (TNFRSF) tartozik, amely több mint 25 olyan receptort tartalmaz, amelyek közel 20 ligandummal lépnek kölcsönhatásba az immunválasz szabályozása érdekében, és amelyet a proinflammatorikus citokinek aktiválnak, a limfotoxin α1β2 vagy TNF 14. szupercsaládtag (TNFSF14, más néven LIGHT) [1]. Az LTβR a legtöbb sejttípus felületén expresszálódik, a legnagyobb expresszió az epitheliális és mieloid vonalak sejtjein történik [2].
A közelmúltban feltételes knockout egérmodelleket alkalmaztak az LTβR új sejtfunkcióinak feltárására. Az LTβR hatását a nyirokcsomó (LN) fejlődésére és a vaszkuláris LN mikrokörnyezetre endoteliális sejtspecifikus LTβR knockout egerek tárták fel, és ez a tanulmány az endoteliális sejteket azonosította fontos LTβR-függő nyirokszövet szervezőként [9]. Ezenkívül bebizonyosodott, hogy az LTβR szignalizáció a bél hámsejtjeiben elengedhetetlen az epitheliális IL-23 termeléséhez és a hám károsodásával szembeni védelemhez [10]. A flox/LysM-cre rendszer által létrehozott makrofág/neutrofil LTβR-specifikus knockout egerek vizsgálata azt sugallta, hogy a T-sejtből származó limfotoxin α1β2 makrofágokon végzett LTβR aktiváció a tripartit-motívum fehérje 30α (TRIM30α ) útvonal a súlyosbodó gyulladásos reakciók ellen [11].
A sertés járványos hasmenés vírus (PEDV) hatékonyan replikálódik a vékonybélben [12], és a PEDV fertőzés akut, súlyos atrófiás enteritist okoz, beleértve az enyhe vagy súlyos vizes hasmenést, kiszáradást és hányást a sertéseknél. Kínában 2010-ben [13] és 2013-ban Észak-Amerikában [14] súlyos PEDV-fertőzésekről számoltak be, ami a fertőzött malacok magas halálozásához és hatalmas gazdasági veszteségekhez vezetett. A hámsejtek biztosítják az első védelmi vonalat a nyálkahártya-kórokozókkal szemben, és a bélhámsejtekben az IPEC-J2 sejtekre és az LTβR-jelzésre van szükség a neutrofilek toborzásához a fertőzés helyére a korai fertőzés során a kemokin (CXC motívum) ligandum termelésével. 1 (CXCL1) és CXCL2 [15]. Az LTβR jelentősége azonban a PEDV-fertőzés szabályozásában az IPEC-J2 sejtekben jelenleg ismeretlen. Ebben a tanulmányban a CRISPR/Cas9 technikával készítettünk LTβR knockout sejteket, és megvizsgáltuk az LTβR hatását az IPEC-J2 sejtproliferációra, a sejtciklusra és az apoptózisra. Pontosabban az LTβR hatását a PEDV fertőzésre IPEC-J2 sejtekben is vizsgálták.
2. Anyagok és módszerek
2.1. Sertés bélminták
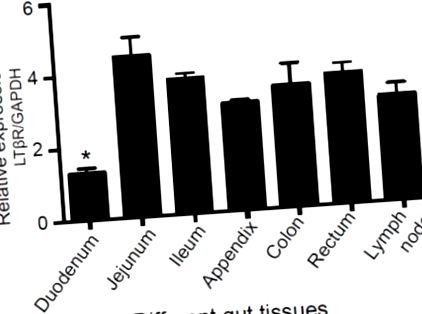
A sertés bélszöveteit, beleértve a duodenumot, a jejunumot, az ileumot, a vakbélet, a vastagbelet, a végbelet és a nyirokcsomókat, négy felnőtt hím nagy fehér sertésből (n = 4) gyűjtöttük össze. Minden állatkísérletet a Kínai Tudományos Akadémia (CAS) Állattani Intézetének Intézményi Állattenyésztési és Felhasználási Bizottsága által jóváhagyott eljárások szerint hajtottak végre (etikai jóváhagyási szám: IOZ20160047).
2.2. Sejtkultúra
Az afrikai zöld majom vesesejteket (Vero E6) Shaohua Hou laboratóriumában, az Állattudományi Intézet (IAS), a Kínai Agrártudományi Akadémia (Peking, Kína) laboratóriumában tartották, az IPEC-J2 sejteket pedig a Jennio Biotech Co., Ltd. (Guangzhou, Kína). Mindkét sejtet 15% magzati szarvasmarha-szérummal (FBS, HyClone, Logan, UT, USA) és 1% penicillin – sztreptomicinnel kiegészített Dulbecco's Modified Eagle's Medium-ban (DMEM, Gibco BRL, Grand Island, NY, USA) tenyésztettük. Mindkét sejttípust 37 ° C-on inkubáltuk 5% CO2-val. Az IAS által Hou laborjában tartott Vero sejtekhez adaptált PEDV CV777 törzset a korábban leírtak szerint szaporítottuk [16].
2.3. Géncélzás a CRISPR/CAS9 rendszer által
2.4. Fordított transzkripciós PCR (RT-PCR)
Két különböző RT-PCR-t használtunk ebben a vizsgálatban, a valós idejű és a félig kvantitatív PCR-t. A szövetekből és sejtekből származó teljes RNS-t TRIzol-reagenssel izoláltuk, és az RNS-koncentrációkat NanoDrop készülékkel (NanoDrop Technologies, Wilmington, DE, USA) határoztuk meg. Két milligramm teljes RNS-t fordítottunk át az első szál cDNS-szintézis készlet segítségével (Thermo Fisher Scientific, Waltham, MA, USA). A valós idejű PCR-t SYBR Green master mix (Applied Biosystems, Foster City, Kalifornia, USA) és 7500 Fast Real Time PCR rendszer (Applied Biosystems, Foster City, CA, USA) felhasználásával hajtottuk végre. Az expressziós szinteket a háztartási gén, a glicerinaldehid-3-foszfát-dehidrogenáz (GAPDH) szintjére normalizáltuk. A valós idejű PCR-hez használt primereket az 1. táblázat mutatja. A relatív génexpressziót az összehasonlító ciklusküszöb (2 -DDCt) módszerrel számítottuk. A szemikvantitatív PCR paramétere 4 perc volt 94 ° C-on, majd 26 ciklus 45 másodpercet 94 ° C-on, 30 másodperc 60 ° C-on, 45 másodperc 72 ° C-on és 5 perc végső meghosszabbítás 72 ° C-on. . Az expresszió kimutatásához PCR termékeket (10 ul) használtunk.
Asztal 1
A tanulmányban használt alapozók.
| Lymphotoxin béta receptor (LTβR) | CACTCATGCTGGGCCTCT | GAGCAGCAGACGTGATGTTT |
| 1. vaszkuláris sejtadhéziós molekula (VCAM1) | ATCCAAGCTGCTCCAAAAGA | GGCCCTGTGGATGGTATATG |
| Interleukin-22 (IL-22) | TTGCTCAAGTTCGTGTCGTC | GGTCAAGCTTGCAGTGATGA |
| Interleukin-23 (IL-23) | TAGGGGTCGAGTCAGAGGTG | GAGTGCCATCCTTGAGCTGT |
| Interleukin-6 (IL-6) | CCACCGGTCTTGTGGAGTTT | AGTCGGGTTGTCTAGGCTGA |
| Interleukin-8 (IL-8) | TGCAAGCTTTGTTATGCAGTG | GCCTGGTGAATTTTTGCTGT |
| Proliferáló sejtmag antigén (PCNA) | GATTCCACCACCATGTTCGAG | GATTCCACCACCATGTTCGAG |
| Caspase 3 (CASP3) | GCCATGGTGAAGAAGGAAAA | GTCCGTCTCAATCCCACAGT |
| Tumor nekrózis faktor 10. szupercsalád tag (TNFSF10) | ACCCAAAGGCTCAACAC | CCCACCTGAGATGGATCACT |
| Gliceraldehid-3-foszfát-dehidrogenáz (GAPDH) | GTGAAGGTCGGAGTGAACG | CTCGCTCCTGGAAGATGGTG |
| Sertés járványos hasmenés vírus (PEDV) | GCACTTATTGGCAGGCTTTGT | CCATTGAGAAAAGAAAGTGTCGTAG |
2.5. Western Blotting
A sejteket kétszer mostuk hideg foszfáttal pufferolt sóoldattal (PBS), és a lizátummintákat előállítottuk 350 μl T-PER szövetfehérje extrakciós reagensben (Thermo Scientific Pierce, Rockford, IL, USA) proteáz inhibitor koktél jelenlétében (Roche (Indianapolis, IN, USA), és 20 000xg sebességgel 20 percig 4 ° C-on centrifugáltuk.
A fehérjéket (20–50 μg) és a fehérjemarkereket SDS-poliakrilamid elektroforézissel elválasztottuk 10% -os poliakrilamid lemezgéleken, és polivinilidén-difluorid (PVDF) membránokra vittük át (Millipore, Madison, WI, USA). A blotokat 5% tejben, 0,1% Tris-pufferolt sóoldat-Tween 20-ban (TBST) blokkoltuk 1 órán át szobahőmérsékleten. Ezután a blotokat LTβR (1: 1000, Abcam, Cambridge, MA, USA) és β-aktin (1: 2000, CST, Danvers, MA, USA) elleni antitestekkel inkubáltuk egy éjszakán át 4 ° C-on. Az immunreaktív sávokat Pierce-fokozott kemilumineszcencia (ECL) Western Blotting Substrate (Thermo Scientific Pierce, Rockford, IL, USA) alkalmazásával detektáltuk.
2.6. Sejtproliferáció
A sejtproliferáció vizsgálatához az LTβR +/+ és az LTβR -/- sejteket 96 lyukú lemezekre szélesztettük 5x103 sejt/üreg 100 µl sejttenyésztő táptalajban, és 37 ° C-on tartottuk 5% CO2-ot tartalmazó párásított inkubátorban. . A szaporodást 24 óránként elemeztük a Cell Counting Kit-8 (CCK-8 kit, Beyotime Biotechnology, Shanghai, Kína) gyártói protokoll szerint.
2.7. Sejtciklus elemzés
Az LTβR +/+ és az LTβR -/- sejteket 6-lyukú lemezekre szélesztettük, és szinkronizálás céljából egy éjszakán át szérumban éheztettük. Másnap szérumot adunk a sejtekhez, és 24 órás stimuláció után a sejteket tripszinezzük és hideg 70% -os etanolban rögzítjük. A sejteket ezután 4 ° C-on inkubáltuk legalább 45 percig, maximum egy éjszakán át. Ezt követően 1500 x g-vel 10 percig 4 ° C-on centrifugáltuk, és 0,4% -os propidium-jodidban (PI: 50 μg/ml propidum-jodidot és 100 μg/ml RNáz A-t tartalmazva) szuszpendáltunk festés céljából. A sejteket ezután LSR II citométerrel (BD Biosciences, San Diego, CA, USA) elemeztük, és a PI festés intenzitását a ModFit szoftverrel (BD Biosciences, San Diego, CA, USA) határoztuk meg. Ez az elemzés megadta a sejtek százalékos arányát a G1, S és G2 fázisban.
2.8. Digitális HoloMonitor mikroszkópia
A HoloMonitor M4 Microscopy (Phase Holographic Imaging AB, Lund, Svédország) egy holografikus mikroszkópián alapuló képalkotó időintervallum citométer, amely közvetlenül a tenyészedényeikben biztosítja a festetlen élő sejtek képalkotását és mennyiségi meghatározását. Az LTβR +/+ és az LTβR -/- sejteket 6 lyukú lemezekre oltottuk és 72 órán át figyeltük. Az apoptózist a Hstudio M4 Tracking szoftver (Scheelevägen, Svédország) elemezte.
2.9. Statisztikai analízis
A limfotoxin béta receptor (LTβR) expressziója a sertés különböző bélszöveteiben. A szöveteket, beleértve a duodenumot, a jejunumot, az ileumot, a vakbélet, a vastagbelet, a végbelet és a nyirokcsomókat, felnőtt hím nagy fehér sertésekből (n = 4) gyűjtöttük, és valós idejű PCR-t használtunk az LTβR expressziós szintjének mérésére. * p -/- Cellák a CRISPR/Cas9 használatával
Az LTβR knockout IPEC-J2 sejtek előállításához két különböző sgRNS-t (L1 és L3) terveztünk, amelyek a sertés LTβR gén 2. exonjában 32 bp-os régiókat céloznak meg (2. A ábra). A pCAG-GFP plazmidot együtt transzfektáltuk a pX330-L1 és pX330-L3 plazmidokkal, és az egyes sejteket áramlásos citometriával rendeztük 96 lyukú lemezekre. A CRISPR-CAS9 által közvetített mutációk meghatározásához 96 telepet választottunk ki, és RFLP elemzésnek vetettük alá (2. B ábra). Adataink azt mutatták, hogy 10 sejtklón bialélikusan mutálódott, és a célzás hatékonysága 10,4% volt (2. B, C ábra). A bialélikus mutáció további érvényesítéséhez véletlenszerűen kiválasztottak öt sejtklónt, 1-10 #, 1-19 #, 1-22 #, 2-3 # és 6-18 # számú DNS-szekvenálást (S1. Kiegészítő ábra), és eredmények megerősítették az RFLP eredményeit. Továbbá összehasonlítottuk a vad típusú 1-10 # sejtklónból származó aminosav-szekvenciákat, és eredményeink mindkét allélben eltolódott mutációt mutattak (S2. Kiegészítő ábra).
3.3. Az LTβR Knockout gátolja az IPEC-J2 sejtproliferációt
Az LTβR sejtproliferációra gyakorolt potenciális hatásának vizsgálatához CCK-8 kitet alkalmaztunk a sejtproliferáció elemzésére mind az LTβR +/+, mind az LTβR -/- sejtekben. Amint a 3A. Ábra mutatja, az LTβR -/- sejtek in vitro proliferációja 48 óra múlva szignifikánsan gátolt volt (0,387 ± 0,023 vs. 0,189 ± 0,018 az LTβR +/+ és az LTβR -/- sejtek esetében, p +/+ és LTβR -/- sejtek, illetve p -/- sejtek (3. B ábra). Ezek az eredmények arra utalnak, hogy az LTβR kiütése csökkenti a sejtek növekedését in vitro.
3.4. Az LTβR Knockout IPEC-J2 sejt apoptózist vált ki
A digitális holografikus mikroszkópia előnyt nyújt a kritikus események valós idejű megfigyelésének tanulmányozásában, mivel folyamatos kétdimenziós (2D) és 3D vizuális képet mutat a sejttevékenységről második időközönként. A kvantitatív morfológiai paraméterek nagy portfóliója rögzíthető és elemezhető, ideértve az optikai cellatérfogatot, vastagságot, területet, szabálytalanságot, excentricitást és az egysejtű követést [20]. Itt digitális holografikus mikroszkóppal figyeltük az LTβR +/+ és az LTβR -/- sejtek dinamikus aktivitásait és morfológiai változásait valós időben, akár 72 órán keresztül. Az eredmények azt mutatták, hogy ezek a sejtek eltérő növekedési jellemzőkkel rendelkeznek. Pontosabban, sokkal több LTβR null sejt, mint LTβR +/+ sejt, megnövekedett sejttérfogattal (függőleges tengely) és csökkent sejthártya vastagsággal (vízszintes tengely) (4. A. ábra, sejtek a vörös vonalak között). A 4B. Ábra a megfigyelt élő LTβR +/+ sejtek (4. ábra B, bal oldalon) és az LTβR -/- sejtek (4. ábra B, jobb oldalon) 3D szerkezetét mutatja. Nyilvánvaló, hogy a fehér színű LTβR -/- sejtek apoptotikusak, mivel a folyadékok apoptotikus sejtmembránokon keresztüli áramlása (permeabilitási zavar) megnövekedett sejttérfogathoz vezet, és a megvilágosodott sejtmembránok ezért különböző színeket tükröznek.
Az LTβR hatása az IPEC-J2 apoptózisra. Az LTβR +/+ és az LTβR -/- sejteket 6 lyukú lemezekre oltottuk, és az apoptózist 72 órán át HoloMonitor®M4 mikroszkóppal követtük nyomon. (A) Az LTβR +/+ és az LTβR -/- IPEC-J2 sejtek pontdiagramja 72 óra tenyésztés után. Az x tengely a sejtek átlagos vastagsága (µM), az y tengely pedig a sejtek felületét mutatja (µM 2). Kisebb vastagságú és nagyobb felületű apoptotikus sejtek vannak a vörös vonalak között. Megjegyzendő, hogy az LTβR +/+ csoport (balra) vörös vonalai között szinte nincsenek apoptotikus sejtek, míg az LTβR -/- sejtpopulációban (jobbra) lényegesen több apoptotikus sejt található. (B) Az élő LTβR +/+ (balra) és LTβR -/- (jobbra) sejtek háromdimenziós struktúrái 72 óra elteltével. A magas sejtek száma észrevehetően megnőtt az LTβR -/- sejtekben. (C) A 10. TNF szupercsaládtag (TNFSF10) és a Caspase 3 (CASP3) valós idejű PCR-adatai LTβR +/+ és LTβR -/- sejtekben, * p -/- sejtekben (4. ábra C).
3.5. Az LTβR Knockout IPEC-J2 sejtek fogékonyak a PEDV-re
Összefoglalva, ez a tanulmány feltárta az LTβR hatását az IPEC-J2 proliferációra és apoptózisra, valamint a PEDV fertőzésben betöltött szerepét. Az LTβR hiánya fokozta a PEDV-fertőzés iránti érzékenységet az IPEC-J2 sejtekben, amit jelentősen elnyomott NFκB célgének (IL-6 és IL-8) és a nyálkahártya-gáttal integritással kapcsolatos gének (VCAM1 és IL-22) okozhatnak. In vitro sejtmodellünk hasznos lesz az LTβR biológiai funkciójának és a PEDV fertőzésre adott sejtes válaszok jobb megértéséhez.
- JC vírus, amit tudnia kell erről az agyfertőzésről
- Ha úgy gondolja, hogy egy kövér nő boncolása a tévében megoldja az elhízás járványát, akkor; újra téved a
- Lé a sejtek tisztítására FOOD MATTERS®
- Magas hemoglobin, fehérvérsejtek és elhízás a szudáni nők körében a korai terhességben a
- Hallgasd meg a beled hasmenését Needham Gastroenterology Associates