Az NFIB transzkripciós faktor a kissejtes tüdőrák előrehaladásának mozgatórugója és a betegek metasztatikus betegségei
Jekatyerina A. Szemenova
1 Molekuláris genetika osztály, Holland Rákkutató Intézet, Amszterdam 1066 CX, Hollandia
Min-chul Kwon
1 Molekuláris genetika osztály, Holland Rákkutató Intézet, Amszterdam 1066 CX, Hollandia
Kim Monkhorst
2 Patológiai osztály, Holland Rákkutató Intézet, Amszterdam 1066 CX, Hollandia
Ji-Ying Song
3 A kísérleti állatpatológia osztálya, Holland Rákkutató Intézet, Amszterdam 1066 CX, Hollandia
Rajith Bhaskaran
1 Molekuláris genetika osztály, Holland Rákkutató Intézet, Amszterdam 1066 CX, Hollandia
8 Genomics Core Facility, Holland Cancer Institute, Amszterdam 1066 CX, Hollandia
Oscar Krijgsman
5 Molekuláris Onkológiai Osztály, Holland Cancer Institute, Amszterdam 1066 CX, Hollandia
Thomas Kuilman
5 Molekuláris Onkológiai Osztály, Holland Cancer Institute, Amszterdam 1066 CX, Hollandia
Dennis Peters
4 alapvető létesítmény a molekuláris patológiához és a biobankoláshoz, Holland Rákkutató Intézet, Amszterdam 1066 CX, Hollandia
Wieneke A. Buikhuisen
6 A mellkasi onkológia részlege, Holland Rákkutató Intézet, Amszterdam 1066 CX, Hollandia
Egbert F. Smit
6 A mellkasi onkológia részlege, Holland Rákkutató Intézet, Amszterdam 1066 CX, Hollandia
Colin Pritchard
7 egérklinika a rák és az öregedés kutatásához Transgenic Core Facility, Holland Rákkutató Intézet, Amszterdam 1066 CX, Hollandia
Miranda Cozijnsen
1 Molekuláris genetika osztály, Holland Rákkutató Intézet, Amszterdam 1066 CX, Hollandia
Jan van der Vliet
1 Molekuláris genetika osztály, Holland Rákkutató Intézet, Amszterdam 1066 CX, Hollandia
John Zevenhoven
1 Molekuláris genetika osztály, Holland Rákkutató Intézet, Amszterdam 1066 CX, Hollandia
Jan-Paul Lambooij
1 Molekuláris genetika osztály, Holland Rákkutató Intézet, Amszterdam 1066 CX, Hollandia
Natalie Proost
1 Molekuláris genetika osztály, Holland Cancer Institute, Amszterdam 1066 CX, Hollandia
Erwin van Montfort
1 Molekuláris genetika osztály, Holland Rákkutató Intézet, Amszterdam 1066 CX, Hollandia
Arno Velds
8 Genomics Core Facility, Holland Cancer Institute, Amszterdam 1066 CX, Hollandia
Ivo J. Huijbers
7 egérklinika a rák és az öregedés kutatásához Transgenic Core Facility, Holland Rákkutató Intézet, Amszterdam 1066 CX, Hollandia
Anton Berns
1 Molekuláris genetika osztály, Holland Cancer Institute, Amszterdam 1066 CX, Hollandia
9 Skolkovo Tudományos és Technológiai Intézet, Moszkva 143026, Oroszország
Társított adatok
Összegzés
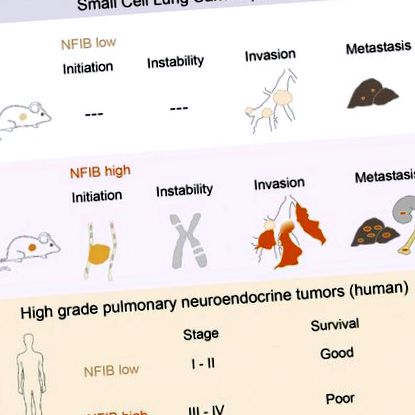
A kissejtes tüdőrák (SCLC) agresszív neuroendokrin daganat, és a mai napig nem áll rendelkezésre hatékony kezelés. Az RLC1 és Trp53 inaktiválásán alapuló SCLC egérmodellek az Nfib és Mycl gének gyakori amplifikációját mutatják. Itt arról számolunk be, hogy bár bármelyik transzkripciós faktor túlzott expressziója felgyorsítja a tumor növekedését, az NFIB kifejezetten elősegíti a metasztatikus terjedést. A magas NFIB-szint a rosszul differenciált és szinte kizárólag E-kadherin (CDH1) -negatív invazív tumorsejt-populáció expanziós növekedésével jár. Az egéradatokkal összhangban azt találjuk, hogy az NFIB szinte minden vizsgált humán metasztatikus, magas fokú neuroendokrin tüdődaganatban túlzottan expresszálódik, ami indokolja az NFIB mint tumor progressziós marker további értékelését klinikai körülmények között.
Grafikai absztrakt
Bevezetés
A kissejtes tüdőrák (SCLC) a tüdőrák legagresszívebb altípusa, és korai metasztatikus terjedés jellemzi több szervre (Byers és Rudin, 2015). Leggyakrabban a betegség előrehaladott stádiumában diagnosztizálják, és kezelés nélkül 4 hónapon belül végzetes. Az SCLC másik szembetűnő jellemzője a standard első vonalbeli kemoterápiás kezelésekre adott kivételes kezdeti válasz, amelyet kemorezisztens tumorok gyors visszaesése követ, korlátozva az SCLC-betegek túlélési előnyeit (Byers és Rudin, 2015). Számos olyan klinikai vizsgálat eredménye, amely különféle terápiás megközelítéseket tesztelt az SCLC számára, csalódást okozott, és a kezelési programok az elmúlt három évtizedben nem változtak (Byers és Rudin, 2015). A bemutatáskor áttétes jellege miatt az SCLC-t ritkán reszektálják, ami az elemzéshez szükséges tumoros anyag hiányához vezet. Ebben az összefüggésben az SCLC egérmodelljei hatékony eszközt jelentenek az SCLC iniciációjának, progressziójának és a rezisztencia mechanizmusainak biológiájának tanulmányozásához (Kwon és Berns, 2013).
Korábban készítettünk egy SCLC egérmodellt, amely a tumor szuppresszor gének (Trp53 és Rb1) feltételes inaktiválásán alapult, és mindkettő szinte minden humán SCLC esetben törlődik (George és mtsai, 2015, Meuwissen és mtsai, 2003). A modell összefoglalja az SCLC számos kiemelkedő jellemzőjét, beleértve lokalizációját, metasztatikus progresszióját és hisztopatológiai jellemzőit (Gazdar et al., 2015, Meuwissen et al., 2003). Ebben a modellben a visszatérő genetikai változások a 8., 12., 14., 16. és 19. kromoszómán bekövetkezett veszteségeket, valamint a 4. kromoszóma nyereségeit és veszteségeit egyaránt magukban foglalták (Dooley és mtsai., 2011, McFadden és mtsai, 2014). Valószínűleg szelektív előnyt biztosítanak a tumorsejtek számára a tumor evolúciója során, és gén amplifikáció esetén hordozhatják a vezető géneket. Különösen a 4. kromoszóma mutat sok genomiális változást, például a miR200a/miR200b-t, a transzkripciós faktorok (Hes2, Hes3 és Hes5) hasított családjának szőrös fokozóját, a Trp73-t tartalmazó fokális deléciókat, valamint két fokális amplifikációt, az egyik a Mycl-t és a másik a Nfib (Calbo et al., 2011, McFadden et al., 2014).
A MYCL egy bázis-spirál-hurok-spirál transzkripciós faktor, amelyről beszámoltak, hogy onkogén az SCLC-ben. Számos exom és teljes genom szekvenálást alkalmazó tanulmány a MYC onkogének családjának ismétlődő amplifikációjáról számolt be, ideértve a MYCL-t SCLC-ben (6,9% –9%) (Calbo et al., 2011, George et al., 2015, Iwakawa et al., 2013 ). Ennek a megfigyelésnek megfelelően a Mycl célzott túlzott expressziója egérmodellben jelentősen felgyorsította a tumor fejlődését (Huijbers et al., 2014).
Az NFIB az 1-es nukleáris faktor (NFI) transzkripciós faktorok családjába tartozik. Megállapították, hogy az adenovírus replikációjához elengedhetetlen tényezők, de ma már ismert, hogy számos sejt gén expresszióját kontrollálják (Gronostajski, 2000, Harris et al., 2015). A gerinces állatok négy tagja, az NFIA, az NFIB, az NFIC és az NFIX hetero- és homodimerként képes megkötni a TTGGC (N5) GCCAA dióda szimmetrikus konszenzus szekvenciáját, és a kontextustól függően vagy aktiválja, vagy visszaszorítja a transzkripciót (Harris et al., 2015) . Több szervrendszerben fejeződnek ki részben átfedő mintákban, és fontos szerepet játszanak a szövet-specifikus expressziós programok szabályozásában (Harris et al., 2015). Az NFIB szabályozza a proliferációt és a hámdifferenciálódást a tüdő érése során, az NFIB knockout állatoknál pedig súlyos tüdőhipoplazia és fejlődési rendellenességek vannak az agyban (Hsu et al., 2011, Steele-Perkins et al., 2005). Ezenkívül beszámoltak arról, hogy koordinálja az epitheliális-melanocita őssejtek proliferációját és differenciálódását a szőrtüszőkben, ahol kimutatták, hogy 1449 célgén expresszióját szabályozza (Chang és mtsai, 2013). Az agyban az NFIB szabályozza az idegi progenitor sejtek differenciálódását (Piper és mtsai, 2014).
Számos jelentés meghatározta az NFIB onkogént (Dooley et al., 2011, Zhang et al., 2015). Az NFIB-t kódoló kromoszóma régió amplifikálódik hármas-negatív emlőrákban (Han és mtsai., 2008), nyelőcső laphámsejtes karcinómájában (Yang és mtsai., 2001) és submandibularis mirigy-karcinómában (Andreasen et. al., 2016). A megnövekedett NFIB szint megtalálható a csont metasztatikus óriássejtes daganataiban is, és a metasztázis megnövekedett kockázatával jár (Mosakhani et al., 2013, Quattrini et al., 2015). A betegek és az egér modelljeiből származó SCLC sejtvonalakat használva az NFIB kimutatta, hogy szabályozza az apoptózist, az öregedést és a proliferációt, és lehetővé teszi a fibroblasztok rögzítésétől független növekedését (Dooley és mtsai, 2011).
A MYC család génjeivel ellentétben az NFIB nagyon korlátozott számú emberi SCLC esetben amplifikálódik (George és mtsai, 2015, Iwakawa és mtsai, 2013). Figyelembe véve az egér fokális amplifikációjának nagy gyakoriságát és in vitro onkogén potenciálját, úgy döntöttünk, hogy teszteljük, hogyan befolyásolja az NFIB expresszió az SCLC fejlődését in vivo, és megvizsgáljuk annak potenciális szerepét az emberi SCLC-ben.
Eredmények
Az NFIB felgyorsítja az SCLC kezdeményezést és a haladást
- A fogyás és az emlőrák megismétlődése kis lépésekkel nagy különbséget jelenthet az emlőrákban
- A vizsgálatok után visszahívott súlycsökkentő gyógyszer kapcsolatot talál a vastagbél-, hasnyálmirigy- és tüdőrákban
- Az α tumor nekrózis faktor meghatározó tényezője a patogenezisnek és a betegség progressziójának a mycobacteriumokban
- A tumorsejtek „karcsúsítása” szabályozza a tumor progresszióját a PLCL1UCP1-közvetített lipidbarnulás révén - Xiong
- Fogyás - Hogyan lehet fogyni és karcsú maradni a homeopátia és a Schuessler-sók (sejtsók) segítségével