Az SH2B1 fokozza az inzulinérzékenységet az inzulinreceptor stimulálásával és az inzulinreceptor szubsztrát fehérjék tirozin-defoszforilációjának gátlásával
David L. Morris
A Michigani Egyetem Orvostudományi Molekuláris és Integratív Élettani Tanszékéről, Ann Arbor, Michigan.
Kae Won Cho
A Michigani Egyetem Orvostudományi Molekuláris és Integratív Élettani Tanszékéről, Ann Arbor, Michigan.
Yingjiang Zhou
A Michigani Egyetem Orvostudományi Molekuláris és Integratív Élettani Tanszékéről, Ann Arbor, Michigan.
Liangyou Rui
A Michigani Egyetem Orvostudományi Molekuláris és Integratív Élettani Tanszékéről, Ann Arbor, Michigan.
Absztrakt
CÉLKITŰZÉS
Az SH2B1 egy SH2 doméntartalmú adapterfehérje, amelyet mind a központi idegrendszer, mind a perifériás szövetek expresszálnak. A neuronális SH2B1 szabályozza a testtömeget; a perifériás SH2B1 funkciói azonban ismeretlenek. Itt az inzulinérzékenység és a glükóz metabolizmus perifériás SH2B1-szabályozását vizsgáltuk.
KUTATÁSI TERVEZÉS ÉS MÓDSZEREK
Generáltunk TgKO egereket, amelyek SH2B1-et expresszáltak az agyban, de nem perifériás szöveteket. Különböző anyagcsere-paramétereket és inzulinjelzést vizsgáltak a magas zsírtartalmú étrenddel táplált TgKO egerekben. Az SH2B1 inzulinreceptor katalitikus aktivitására és inzulinreceptor szubsztrátra (IRS) -1/IRS-2 defoszforilezésre gyakorolt hatását in vitro kináz és in vitro defoszforilációs vizsgálatokkal vizsgáltuk. Az SH2B1-et együtt expresszálták a PTP1B-vel, és megvizsgálták az IRS-1 inzulinreceptor által közvetített foszforilációját.
EREDMÉNYEK
A perifériás SH2B1 törlése jelentősen súlyosbította a HFD által kiváltott hiperglikémiát, hiperinsulinémiát és glükóz intoleranciát a TgKO egerekben. Az inzulinjelzés drámai mértékben károsodott az izom-, a máj- és a zsírszövetben a TgKO egerekben. Az SH2B1 törlése károsította az inzulin jelátvitelt az elsődleges májsejtekben, míg az SH2B1 túlzott expressziója stimulálta az IRS inzulinreceptorok autofoszforilációját és tirozin foszforilációját. A tisztított SH2B1 stimulálta az inzulinreceptor katalitikus aktivitását in vitro. Az SH2B1 SH2 doménje szükséges és elegendő az inzulinreceptor aktiválásának elősegítéséhez. Az inzulin stimulálta az SH2B1 IRS-1 vagy IRS-2 kötődését. Ez a fizikai interakció gátolta az IRS-1 vagy az IRS-2 tirozin defoszforilációját, és növelte az IRS fehérjék azon képességét, hogy aktiválják a foszfatidil-inozitol-3-kináz útvonalat.
KÖVETKEZTETÉSEK
Az SH2B1 egy endogén inzulinérzékenyítő. Közvetlenül kötődik az inzulinreceptorokhoz, az IRS-1 és az IRS-2-hez, és fokozza az inzulinérzékenységet az inzulinreceptor katalitikus aktivitásának elősegítésével és az IRS fehérjék tirozin-defoszforilezésének gátlásával.
Az inzulin csökkenti a vércukorszintet, mind a vázizomzatba és a zsírszövetbe történő felvétel elősegítésével, mind a máj glükóztermelésének elnyomásával. A 2-es típusú cukorbetegségben az inzulin csökkent vércukorszint-csökkentő képessége (inzulinrezisztencia) genetikai és környezeti tényezők kombinációja miatt hiperglikémiát eredményez. Az inzulinrezisztencia nemcsak a 2-es típusú cukorbetegség jellemzője, hanem meghatározó tényezője is.
Az inzulin kötődik és aktiválja az inzulinreceptort. Az inzulin receptor tirozil foszforilálja az inzulin receptor szubsztrátumokat (IRS-1, -2, -3 és -4). Az IRS fehérjék, különösen az IRS-1 és az IRS-2, számos downstream útvonalat kezdeményeznek és koordinálnak, beleértve a foszfatidil-inozitol-3-kináz/Akt útvonalat is (1). Az IRS-1, IRS-2 vagy Akt2 genetikai törlése inzulinrezisztenciát okoz egerekben, jelezve, hogy az IRS fehérje/foszfatidil-inozitol-3-kináz/Akt2 útvonal szükséges a glükóz homeosztázis inzulin általi szabályozásához (2–5). Az inzulinreceptorokat és az IRS fehérjéket negatívan szabályozzák különféle intracelluláris molekulák, beleértve a PTP1B, Grb10, Grb14, SOCS1, SOCS3, JNK, PKCθ, S6K és IKKβ (6–23). E negatív szabályozók relatív hozzájárulását az inzulinrezisztencia progressziójához alaposan tanulmányozták (6–24). Az inzulin jelátvitelt azonban valószínűleg pozitív szabályozók is modulálják. Ebben a tanulmányban bebizonyítottuk, hogy az SH2B1 egy új endogén inzulinérzékenyítő.
Generáltunk egy egérmodellt, amelyben a rekombináns SH2B1 specifikusan expresszálódik az SH2B1-null egerek (TgKO) agyában transzgénikus megközelítések alkalmazásával (31). Az SH2B1 neuron-specifikus helyreállítása korrigálja mind a leptinrezisztenciát, mind az elhízást, ami arra utal, hogy az idegsejtek SH2B1 szabályozza az energiaegyensúlyt és a testtömeget a leptin érzékenységének fokozásával (31). Ezekkel a következtetésekkel összhangban az SH2B1 lókuszok polimorfizmusai összefüggenek a leptinrezisztenciával és az emberek elhízásával (34–36). Ebben a munkában bemutatjuk, hogy az SH2B1 deléciója a perifériás szövetekben károsítja az inzulinérzékenységet a TgKO egerek elhízásától függetlenül. Ezenkívül bebizonyítjuk, hogy az SH2B1 közvetlenül elősegíti az inzulinválaszokat az inzulinreceptor katalitikus aktivitásának stimulálásával és az IRS fehérjék megvédésével a tirozin defoszforilációjától.
KUTATÁSI TERVEZÉS ÉS MÓDSZEREK
Állatkísérletek.
Sejtvonalak és transzfekció.
A COS7 és HEK293 sejteket 5% szarvasmarha szérummal kiegészített DMEM-ben tenyésztettük, és a jelzett plazmidokkal transzfektáltuk Lipofectamine 2000 (Invitrogen) alkalmazásával. Kínai hörcsög petefészek (CHO IR és CHO IR/IRS-1) sejteket tenyésztettünk 8% FBS-sel kiegészített Ham F-12 táptalajban. A sejtek kezelése előtt 16 órán át 16 órán át nélkülöztük a szérumot DMEM-ben (COS7 és HEK293) vagy F-12-ben (CHO), amely 0,6% BSA-t tartalmazott. Az elsődleges májsejteket hím egerekből (8 hét) izoláltuk a máj II. Típusú kollagenázzal (Worthington Biochem) végzett perfúziójával, és 10% FBS-t, 100 egység/ml penicillint és 100 μg/ml-t tartalmazó M199-es kollagénnel bevont lemezekre szélesztettük. sztreptomicin. 2 óra elteltével az elsődleges sejteket PBS-ben öblítettük, és további 16 órán át tenyésztettük Williams-táptalajban (Sigma), kiegészítve 0,6% BSA-val, 100 egység/ml penicillinnel és 100 μg/ml streptomicinnel.
Immuncsapás és immunblottolás.
Az immuncsapást és az immunblottot a korábban leírtak szerint hajtottuk végre (29,37). A fehérjéket az Odyssey infravörös képalkotó rendszer (Li-Cor Biosciences) vagy az ECL (Amersham) segítségével vizualizáltuk, és az Odyssey 1.2 szoftver (Li-Cor) segítségével számszerűsítettük. Az aktin, a foszfoAkt (Thr 308), az Akt, a p-inzulin-receptor, a Myc, az Shc és a tubulin antitestek a Santa Cruz-tól voltak. A foszfotirozin-specifikus antitest Upstate származású volt. Az AS160 antitest a Millipore, a foszfo Akt szubsztrát antitest pedig a Cell Signaling. A Phospho Akt (Ser 473) a BioSource cégtől származott. SH2B1 és IRS-1 antitesteket írtak le (14,37).
Inzulinreceptor-kináz vizsgálat.
A sejteket 16 órán át szérumtól megvontuk, inzulinnal kezeltük és kináz-lízis pufferben (50 mmol/l Tris HCl [pH 7,5], 0,1% Triton X-100, 150 mmol/l NaCl, 1 mmol/l EDTA, 1 mmol) oldottuk. mmol/l Na3VO4, 1 mmol/l PMSF, 10 μg/ml aprotinin, 10 μg/ml leupeptin). Az inzulinreceptort búzacsíra-agglutinin (WGA) konjugált agarózgyöngyökkel kicsapjuk, háromszor mossuk mosópufferben (50 mmol/l Tris HCl [pH 7,5], 0,5 mol/l NaCl, 0,1% Triton X-100) és kétszer kináz reakció pufferben (20 mmol/l HEPES [pH 7,6], 0,1% Triton X-100, 5 mmol/l MgCl2, 100 μmol/l Na3VO4). A WGA-val immobilizált fehérjéket 37 ° C-on inkubáltuk kizárólag oldható glutation S-transzferázzal (GST), GST-SH2B1 vagy GST-SH2 fúziós fehérjékkel kiegészített kináz reakciópufferben. GST-IRS-1-t (5-10 μg) és ATP-t (50 μmol/l) adtunk hozzá, hogy 37 ° C-on megindítsuk a kináz reakciókat. A reakciókat SDS-PAGE töltőpuffer hozzáadásával leállítottuk, és a reakcióelegyeket azonnal felforraltuk. A fehérjéket SDS-PAGE-val elválasztottuk és immunoblotoltuk jelzett antitestekkel.
Defoszforilezési vizsgálatok.
Az immunitiszta fehérjéket lízispufferben mostuk, és GST-SH2B1 vagy GST (2 μg) foszfatáz reakciópufferben (50 mmol/l Tris-HCl [pH 8,2], 100 nmol/l NaCl, 10 mmol/l MgCl2, 1 mmol) inkubáltuk./l DTT) 15 percig szobahőmérsékleten, állandó keverés mellett. Alkalikus foszfatázt (New England Biolabs) adtunk a megadott koncentrációban, és a keverékeket további 30 percig szobahőmérsékleten inkubáltuk. A reakciókat SDS-PAGE töltőpuffer hozzáadásával leállítottuk, és az elegyeket azonnal felforraltuk. A fehérjéket SDS-PAGE-val elválasztottuk és immunoblotoltuk jelzett antitestekkel.
Statisztikai analízis.
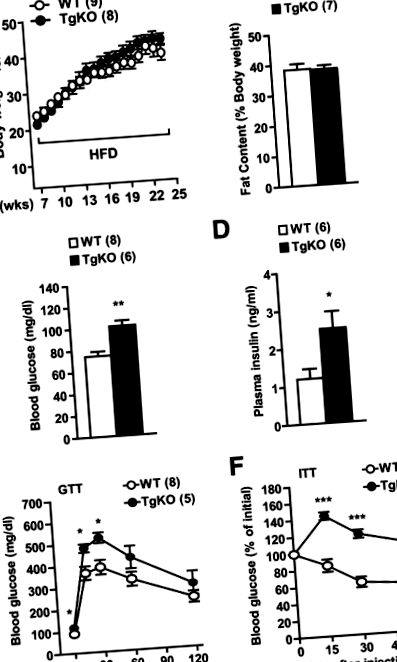
Az adatokat átlag ± SE értékként adjuk meg. A csoportok közötti különbségeket kétfarkú Student t tesztekkel vagy ANOVA-val határoztuk meg. P 1. ábra A és B). Az éhomi (16 órás) vércukorszint azonban 1,3-szor magasabb volt a TgKO egerekben, mint a vad típusú egerekben, amelyeket 16 hétig tápláltak HFD-vel (1. ábra C). Az éhomi plazma inzulinszintje kétszer magasabb volt a TgKO egerekben, mint a vad típusú egerekben (1. ábra D). Az inzulinérzékenység vizsgálatához GTT-t és ITT-t végeztek. A vércukorszint 23-26% -kal magasabb volt a TgKO egerekben, mint a vad típusú egerekben 15 és 30 perccel a d-glükóz injekciója után (1. ábra E). Az exogén inzulin jelentősen csökkentette a vércukorszintet a vad típusú, de a TgKO egerekben nem az ITT során (1. F ábra). Ezek az eredmények azt mutatják, hogy a perifériás SH2B1 elvesztése súlyosbítja az elhízástól független HFD által kiváltott inzulinrezisztenciát, hiperglikémiát és glükóz intoleranciát.
Az SH2B1 sejt autonóm módon elősegíti az inzulin szignalizációt az SH2 doménjén keresztül.
Az SH2B1 stimulálja az inzulinreceptor katalitikus aktivitását azáltal, hogy SH2 doménjét az inzulinreceptorban lévő Tyr 1158-hoz köti.
Az SH2B1 megvédi az IRS fehérjéit a tirozin defoszforilációjától.
Az SH2B1 in vitro közvetlenül kötődik az IRS-1-hez és az IRS-2-hez (37), és az inzulin stimulálta az SH2B1 és az IRS-1 együttes stimulálását a sejtekben (5. ábra A). Annak megállapítására, hogy ez a fizikai interakció gátolja-e az IRS-1 foszfatázok általi defoszforilezését, az inzulinreceptort és az IRS-1-t stabilan expresszáló CHO IR/IRS-1 sejteket inzulinnal stimulálták az IRS-1 tirozin-foszforilációjának elősegítésére. A foszforilezett IRS-1-t immuntisztítottuk, GST-vel vagy GST-SH2B1-vel előinkubáltuk, és in vitro defoszforilezési vizsgálatoknak vetettük alá. Az IRS-1 a GST-SH2B1-hez kötődik, a GST-hez azonban nem (az adatok nem láthatók). Az alkalikus foszfatáz dózisfüggően defoszforilálta az IRS-1-et a tirozinokon a GST-vel előkezelt mintákban; ezzel szemben az alkalikus foszfatáz nem tudta defoszforilálni az SH2B1-hez kötött IRS-1-t (5. ábra B). Az inzulin elősegítette az SH2B1 és az IRS-2 kapcsolatát, és az SH2B1 hasonlóan gátolta az IRS-2 tirozin-defoszforilezését (az adatokat nem közöljük).
Annak megállapításához, hogy az SH2B1 gátolja-e az IRS-1 defoszforilációját a sejtekben, az IRS-1-et együtt expresszálták PTP1B-vel (fehérjetirozin-foszfatáz) SH2B1 hiányában vagy jelenlétében. A PTP1B defoszforilezett IRS-1-et és az SH2B1 dózisfüggően gyengítette a PTP1B azon képességét, hogy defoszforilálja az IRS-1-t (5. ábra C). Annak megállapításához, hogy az SH2B1 képes-e elősegíteni az IRS-1 foszforilezését az inzulinreceptor kináz aktivitás stimulálása nélkül, az Y1158F-et együtt expresszálták az SH2B1-gyel. Bár az SH2B1 nem tudta stimulálni az Y1158F kináz aktivitást (4. ábra E), az SH2B1 még mindig jelentősen fokozta az IRS-1 tirozin-foszforilációját az Y1158F-et expresszáló sejtekben (5. ábra D). Így az SH2B1 valószínűleg fokozza az IRS-1 Y1158F által közvetített foszforilezését azáltal, hogy gátolja az IRS-1 defoszforilációját endogén fehérje foszfatáz (ok).
Annak megállapításához, hogy az SH2B1-IRS kölcsönhatás szterikusan gátolja-e az IRS fehérjék foszfatidil-inozitol-3-kinázhoz való kötődését, az IRS-1-et és az Y1158F-et együtt expresszálták SH2B1-gyel vagy anélkül HEK293 sejtekben, és az IRS-1-p85 asszociációt koimmunoprecipitációs vizsgálatokkal vizsgálták. Az inzulin stimulálta az IRS-1 koimmunoprecipitációját a p85-sel, a foszfatidil-inozitol-3-kináz szabályozó alegységével; ami fontos, hogy az SH2B1 jelentősen fokozta az inzulinnal stimulált p85 kötődését az IRS-1-hez (5. ábra E). Ezek az adatok azt mutatják, hogy az SH2B1-IRS kölcsönhatás nem zavarja az IRS-foszfatidil-inozitol-3-kináz interakciót, hanem inkább növeli az IRS-foszfatidil-inozitol-3-kináz asszociációt az IRS defoszforilezésének gátlásával. Ezekkel a megfigyelésekkel összhangban az SH2B1 az inzulinnal stimulált, Y1158F által közvetített Akt foszforilezést is fokozta (5. F ábra). Ezek az adatok együttesen arra engednek következtetni, hogy az inzulinreceptor katalitikus aktivitásának fokozása mellett a Tyr 1158-hoz való kötődés révén az SH2B1 elősegíti az IRS fehérje/foszfatidil-inozitol-3-kináz/Akt útvonal aktiválódását az IRS defoszforilezésének gátlásával.
VITA
Az inzulinrezisztencia az elsődleges kockázati tényező a különböző anyagcsere-betegségeknél, beleértve a 2-es típusú cukorbetegséget, az alkoholmentes zsírmáj betegségeket, a diszlipidémiát és a szív- és érrendszeri betegségeket. Az inzulinrezisztencia hátterében álló molekuláris mechanizmusok rendkívül összetettek és nem teljesen értettek. Általánosan elfogadott, hogy az inzulin szignál transzdukciójának zavarai kulcsszerepet játszanak az inzulinrezisztencia kialakulásában. Korábban megfigyeltük, hogy az inzulin jelátvitelt fokozza az SH2B1 (29). Az SH2B1 túlzott expressziója növeli az inzulin receptor autofoszforilációját és az IRS-1 és az IRS-2 tirozin-foszforilációját tenyésztett sejtekben (29,43). Hasonló megfigyelésekről két másik csoport is függetlenül számolt be (44,45). Ezenkívül megmutattuk, hogy az SH2B1 genetikai deléciója súlyos inzulinrezisztenciát és 2-es típusú cukorbetegséget eredményez egerekben (29). Az SH2B1-null egerek azonban súlyosan elhíznak a leptinrezisztencia miatt (30–32), felvetve annak lehetőségét, hogy az inzulinrezisztencia másodlagos lehet az SH2B1-null egerek elhízása szempontjából. Ezért nem volt világos, hogy a perifériás SH2B1 közvetlenül szabályozza-e inzulinérzékenységet az inzulin célszövetekben in vivo.
Összegzésképpen elmondható, hogy az SH2B1 több mechanizmus révén elősegíti az állatok inzulinérzékenységét (6. ábra). A neuronális SH2B1 közvetett módon növeli az inzulinérzékenységet az adipozitás csökkentésével (31). Az izom-, a máj- és a zsírszövetben az SH2B1 az inzulinreceptorhoz kötődik és stimulálja az inzulinreceptor katalitikus aktivitását, hogy globálisan aktiválja az inzulinreceptortól lefelé vezető utakat. Az SH2B1 mind az IRS-1-hez, mind az IRS-2-hez kötődik, és megvédi az IRS fehérjéit a tirozin defoszforilációjától, az IRS fehérje által közvetített útjainak növelésétől és/vagy meghosszabbításától. Ezenkívül az SH2B1 dimereket képez, és az SH2B1 dimerekben lévő egyes SH2B1 molekulák egyidejűleg kötődhetnek az inzulinreceptorhoz és az IRS-1 (vagy IRS-2), stabilizálva ezáltal az inzulinreceptor/IRS-1 (vagy inzulinreceptor/IRS-2) komplexeket . Ezért az SH2B1 és az SH2B1 ezen funkcióit utánzó molekulák potenciális terápiás célpontok az elhízás és/vagy a 2-es típusú cukorbetegség kezelésében.
Az inzulinjelzés SH2B1 szabályozásának modellje. Az inzulinra reagálva az SH2B1 SH2 doménján keresztül közvetlenül kötődik az inzulinreceptorban lévő foszfo-Tyr 1158-hoz, és stimulálja az inzulinreceptor kináz aktivitást, ezáltal fokozva az inzulinreceptortól lefelé irányuló több jelátviteli út aktiválódását (pl. Az Shc/MAPK és az IRS/foszfatidil-inozitol-3-kináz útvonalak). Az SH2B1 az IRS-1-hez vagy az IRS-2-hez is kötődik, és gátolja tirozinokon történő defoszforilezésüket, hogy specifikusan elősegítse az IRS fehérje által közvetített útvonalak aktiválódását. Mivel az SH2B1 dimerizációs doménjén keresztül dimerizál, a dimerizált SH2B1 tovább javíthatja az inzulinjelet azáltal, hogy egyszerre kötődik mind az inzulinreceptorhoz, mind az IRS-1-hez, hogy stabilizálja az aktív inzulinreceptort az IRS-1-gyel, vagy az IRS-1-et toborozza az inzulinreceptorhoz. PTP: fehérje tirozin-foszfatáz; P: foszfátcsoport.
Köszönetnyilvánítás
Ezt a tanulmányt a National Institutes of Health Grants RO1 DK-065122, RO1 DK-073601 (L.R.-ig) és az F31NS056575 (D.L.M.-nek) és az American Diabetes Association 1-09-RA-156 Award (L.R.) támogatásával támogatta. Ez a munka felhasználta a Michigani Diabetes Kutató és Képző Központ (a Nemzeti Egészségügyi Intézetek 5P60 DK-20572 finanszírozásával), a Michigani Egyetem Rákközpontja (a Nemzeti Egészségügyi Intézetek 5 P30 CA-46592 támogatásával), a University of Michigan által támogatott magokat. Michigan Nathan Shock Center (a Nemzeti Egészségügyi Intézetek P30AG013283 finanszírozásával) és a Michigani Egyetem Bélpeptid Kutatóközpontja (a National Health Institute of Health DK-34933 finanszírozásával).
A cikk szempontjából lényeges összeférhetetlenségről nem számoltak be.
Köszönetet mondunk Xiao Jian Sun-nak (Chicagói Egyetem) a GST-IRS-1 plazmidok biztosításáért és Liang Sheng-nek az elsődleges hepatocita-kultúrákban nyújtott segítségéért.
- 14 éves lányomnak nincs cukorbetegsége, de inzulinrezisztenciát és
- Természetes kezelés PCOS 30 módja a hormonok, az inzulin és így tovább
- Pro) A renin receptor az elhízás okozta antinatriuresist és az emelkedett vérnyomást közvetíti
- A szubkután zsírszövet szerepe az inzulinrezisztencia patogenezisében
- A β3-adrenerg receptor gén Trp64Arg variánsának nincs hatása a fogyásra diétával és