(Pro) A renin receptor az elhízás által kiváltott antinatriuresist és az emelkedett vérnyomást közvetíti a vese epitheliális nátriumcsatornájának felpörgetésével.
Syed S. Quadri
1 DeBusk Osteopátiás Orvostudományi Főiskola, Lincoln Memorial University, Harrogate, Tennessee, Amerikai Egyesült Államok
Silas Culver
2 Orvostudományi Tanszék, Virginia Egyetem Egészségügyi Rendszere, Charlottesville, Virginia, Amerikai Egyesült Államok
Nrupama Ramkumar
3 Nefrológiai és magas vérnyomás osztály, Utah Egyetem Egészségtudományi Központ, Salt Lake City, Utah, Amerikai Egyesült Államok
Donald E. Kohan
3 Nefrológiai és magas vérnyomás osztály, Utah Egyetem Egészségtudományi Központ, Salt Lake City, Utah, Amerikai Egyesült Államok
Helmy M. Siragy
2 Orvostudományi Tanszék, Virginia Egyetem Egészségügyi Rendszere, Charlottesville, Virginia, Amerikai Egyesült Államok
Társított adatok
Minden lényeges adat a cikkben található.
Absztrakt
Bevezetés
Az elhízás olyan nemzeti és globális járvány, amely nagyobb kockázatot jelent az egyén számára a szívbetegségek, agyvérzés, a cukorbetegség és a magas vérnyomás (BP) szempontjából. Az esszenciális magas vérnyomás 75% -a a megnövekedett testsúlynak tulajdonítható [1], és az a tény, hogy a testsúly csökkenése jelentősen csökkenti a vérnyomást, alátámasztja ezt az ok-okozati összefüggést. [2–4] Az elhízás és az a megnövekedett nátrium-visszatartás, amely az emelkedett BP-hez vezet, nem teljesen ismert.
Az elhízás során az emelkedett BP egyik ismert oka a károsodott vese natriuresis, amely fokozza a vese nátrium-visszatartását az elhízásban. [5] Az elhízás által kiváltott nátrium-visszatartás egyéb tényezői a fokozott szimpatikus idegrendszeri aktivitás, a megnövekedett renin-angiotenzin-aldoszteron rendszer (RAS) aktivitása, a natriuretikus peptidek szintjének csökkenése, a vese zsírsűrítése és a gyulladásos citokinek növekedése. [6,7 ] Azonban az összes érintett tényező megértése korántsem teljes körű. Míg az elhízás növeli a nátrium-visszatartást a nephron különböző részein, [5] ezeket a változásokat szabályozó pontos mechanizmusokat nem magyarázták teljes mértékben.
Az amilorid-érzékeny hám-nátrium-csatorna (ENaC) fontos transzporter, amely kritikus szerepet játszik a Na + homoeostasis fenntartásában azáltal, hogy fokozza annak felszívódását. [8] Az ENaC három alegységből áll: α, β és γ; [9] amelyek nagy mértékben expresszálódnak a disztális tekercselt tubulustól a nephron gyűjtőcsatornájáig. [10,11] A három alegység közül az α-ENaC kritikus jelentőségű csatornaaktivitás [9], míg a β- és γ- ENaC alegységek kiegészítő szerepet játszanak az α-ENaC funkciójával. [9] Elhízás esetén az ENaC uregulációja fokozott nátrium-visszatartással jár, ami hozzájárul a megnövekedett BP kialakulásához [12,13], és nemrégiben bebizonyítottuk, hogy a csökkent vese α-ENaC expresszió növeli a vizelet nátrium kiválasztását. [14] Ezek az eredmények rávilágítanak az α-ENaC szabályozásának megértésének fontosságára az elhízás okozta magas vérnyomásban.
Az RAS alapvető szerepet játszik a vérnyomás, a vese hemodinamikai és tubuláris nátrium-visszaszívódásának szabályozásában. A (Pro) reninreceptor (PRR) a RAS egyik olyan alkotóeleme, amely kötődik a reninhez és a proreninhez, és fokozza azok katalitikus aktivitását. [15] A PRR egyetlen transzmembrán fehérje, amely főleg a vese érrendszerében, a proximális és a disztális tubulusokban, valamint a gyűjtőcsatornákban lokalizálódik. [9,15,16] A PRR aktiválása számos jelátviteli utat stimulál, beleértve az ERK-t és a mitogén-aktivált protein-kinázt. [17, [18] Míg a PRR-t eredetileg a RAS alkotóelemeként írták le, a közelmúltban bebizonyították RAS-tól független szerepét az α-ENaC-n keresztüli nátriumkezelésben is. [14]
Eddig egyetlen tanulmány sem vizsgálta a PRR jelentőségét az elhízás által kiváltott antinatriuresisben. A jelenlegi ismeretek alapján feltételezzük, hogy a magas zsírtartalmú étrend (HFD) által kiváltott elhízás esetén a PRR az α-ENaC nátriumcsatorna felszabályozásával elősegíti a fokozott vese-nátrium-visszatartást és a magasabb BP-t. Jelen tanulmányunkban egy nemrégiben kifejlesztett, a PRR által indított, nefronon átívelő knockout modellt használtunk hipotézisünk tesztelésére. [19]
Anyagok és metódusok
Állatok előkészítése
A Virginia Egyetem Állattenyésztési és Felhasználási Bizottsága jóváhagyta az összes vizsgálati protokollt. Az egereknek egy hétig hagyták, hogy alkalmazkodjanak állattartó intézményünkhöz, és ad libitum és normál nátrium-diétával látták el a csapvizet (Harlan-Teklad, Madison, WI). A ketamin/xilazint altatásra alkalmazták a vese intersticiális folyadék összegyűjtése, a szervbeszedés és az eutanázia során.
Nephron-specifikus PRR KO kiváltása
Jelen tanulmányban nemrég kifejlesztett nephron-specifikus indukálható PRR KO egereket használtunk, amelyeket a korábban leírtak szerint állítottunk elő. [19] Ezeket az egereket dr. Donald E. Kohan és Nirupama Ramkumar, Utah Egyetem Egészségtudományi Központ, Salt Lake City, Utah. Röviden, ezeket az egereket C57BL/6J háttérrel tenyésztik, Pax8-rTA és LC1 esetén hemizigóták és egy floxolt PRR gén esetében homozigóták. A nephron-specifikus PRR-kiütést a doxiciklin ivóvízzel történő beadása indukálja, az alábbiakban leírtak szerint. Mind a hím, mind a nőstény egereket használtuk ezekben a vizsgálatokban. 10 hetes kortól kezdve a nephron-specifikus PRR KO egereket (n = 6) ad libitum csapvízzel látták el, és vagy rendszeres táplálékkal (RD, 12% zsír, 0,4% nátrium-klorid) (Harlan-Teklad) vagy magas zsírtartalmú táplálékkal látták el. diéta (HFD, 45% zsír zsírból, 0,3% nátrium-klorid) (Research Diets) összesen 10 hétig. A nefronon átívelő PRR KO kiváltása érdekében az első 4 hetes diétás kezelést követően az egereket 2 mg/ml doxiciklinnel, 2% szacharóz ivóvízben kezeltük 12 napig, míg a kontroll egerek (azok, akik nem estek át PRR kiütésen) 2% szacharóz vizet kaptak csak ugyanarra az időszakra. Ezután az összes egeret visszahelyeztük normál csapvízbe a 10 hetes diétás kezelés hátralévő részében.
Genotipizálás
A DNS-t extraháltuk az egérfarkakból, és a PCR-t a következő primerek alkalmazásával hajtottuk végre:
PAX-8-rtTA (600 bp), előre: 5’-CCATGTCTAGACTGGACA AGA-3 ’; hátra: 5’-CTCCAGGCC ACATATGAT TAG-3 ’ .
PRR (600 bp), előre: 5 ′ - GGGGGGTAAATTGTTGATGAGTCTTGGAGCATAGC-3 ′; hátramenet 5′-GAAGCCCATGGACAGTGCAGCTACGTCTGGGATTCGA-3 ′ .
LC-1 (480 bp), előre: 5′- TCGCTGCATTACCGGTCGATGC-3 ’; fordított 5′-CCATGAGTGAACGAACCTGGTCG-3 ” .
Szisztolés vérnyomás, testsúly, táplálékfelvétel, 24 órás vizelet
A BP-t a 0. napon (kiindulási érték) és a táplálkozás utáni 10. héten értékeltük a korábban leírtak szerint [20] nem érzéstelenített egerekben farok-mandzsetta nem invazív többcsatornás vérnyomásrendszerrel (IITC Life Sciences, Woodland Hills, CA). Röviden, az egereket egy kamrába helyeztük egy melegítő párnán 37 ° C-on 10 percig, és átadtuk őket a farok mandzsetta vérnyomásrendszerébe (IITC Life Sciences, Woodland Hills, CA). A farok mandzsetta a sűrített levegő hengeréhez csatlakozik a be- és kimeneti szelepek elrendezésén keresztül, amely állandó sebességgel lehetővé teszi a mandzsetta felfújását és leeresztését. A farok mandzsetta nyomását folyamatosan regisztráltuk. A pulzus- és nyomásérzékelők jeleit felerősítették, majd egy asztali számítógépbe szerelt analóg-digitális táblával digitalizálták. Az összes egeret a farok mandzsetta mérése előtt hozzáigazították a vérnyomásmérő készülékhez. A testtömeg, a táplálékfelvétel és a 24 órás vizeletgyűjtés egyedi metabolikus ketrecek felhasználásával történt. Meghatároztuk a teljes vizeletmennyiséget, és a vizelet alikvot részeit a vizsgálatig -80 ° C-on tároltuk.
RT-PCR elemzés
Kvantitatív valós idejű reverz transzkriptáz-polimeráz láncreakciót (RT-PCR) alkalmaztunk a PRR és az ENaC vese medulláris mRNS-expressziójának változásainak meghatározására. Az RNS-t (n = 4 csoportonként) Trizol (Invitrogen, Carlsbad, CA) alkalmazásával extraháltuk. Az RNS reverz transzkripcióját egy első szálú cDNS szintézis készlet segítségével hajtottuk végre (Bio-Rad, Hercules, CA). A PCR-t SYBR Green Supermix (Bio-Rad) alkalmazásával elemeztük. Az egér alapozó szekvenciái a következők voltak: PRR, előre szekvencia 5’-TCTCCGAACTGCAAGTGCTA-3 ’; fordított szekvencia 5’-CTGCAAACTTTTGGAGAGCA-3 ’; α –ENaC, előremenő szekvencia 5′-CTAATGATGCTGGACCACACC-3 ’; fordított szekvencia 5’-AAAGCGTCTGCTCCGTGATGC-3 ’; β-aktin, 5'-AGCCATGTACGTAGCCATCC-3 szekvencia; fordított szekvencia 5’-ACCCTCATAGATGGGCACAG-3 ’. A reakciókat három példányban hajtottuk végre, és a küszöbérték ciklusszámát átlagoltuk. A specifikus célgének mRNS-eredményeit β-aktin mRNS-re normalizálva számítottuk.
Western blot
PRR antitestek (1: 1000 hígítások, Abcam, Cambridge, MA, USA), p-SGK-1 (1: 1000 hígítások, Cell signaling, USA), SGK-1 (1: 1000 hígítások, Cell signaling, USA), α-ENaC-t (1: 500 hígítások; ASC-030, Alamone labs, Izrael) használtunk a vese medulláris fehérjének Western blotjában, a korábban leírtak szerint. [20,21] A fehérje expressziókat β-aktin fehérjére normalizáltuk (1: 1000). hígítások, Santa Cruz, Dallas, TX, USA) Az immunblotot 4-es n értékkel végeztük az összes kezelési csoportnál.
In vivo renális intersticiális folyadék (RIF) gyűjtései és az Ang II vizsgálata
Az Ang II mérésekhez az in vivo RIF-et mikrodialízissel gyűjtöttük a vizsgálat végén, a korábban leírtak szerint. [22] Az Ang II koncentrációkat a kereskedelemben kapható ELISA készlet segítségével határoztuk meg (Cayman Chemical, Ann Arbor, MI, USA). [23]
Statisztikai analízis
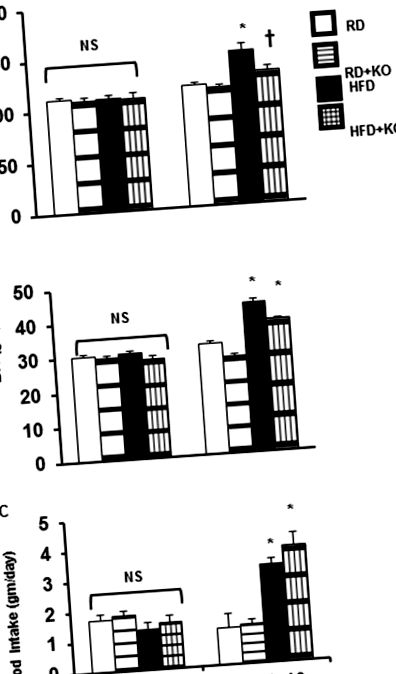
A különböző kezelési csoportok közötti összehasonlításokat adott esetben Student t teszttel vagy egyirányú ANOVA-val, majd Tukey teszttel értékeltük post-hoc összehasonlítás céljából. Az adatokat átlag ± SE-ként fejeztük ki. P 1A ábra), BW (HFD 43,2 ± 1,125 gm, szemben RD 31,9 ± 0,89654 gm, P 1B ábra) és 24 órás táplálékfelvétel (RD 1,2 ± 0,48 gm, szemben HFD 3,2 ± 0,21 g, P 1C ábra). A HFD kontrollokhoz képest a PRR KO indukció (HFD + PRR KO) jelentősen csökkentette az SBP-t (HFD 149,4 ± 6,04 Hgmm vs. HFD + PRR KO 129 ± 3,75 Hgmm P 1A ábra). A PRR KO nem változtatta meg a BW-t (HFD 43,2 ± 1,125 gm, szemben a HFD + PRR KO 38,0 ± 0,36 gm) (1B ábra) vagy a 24 órás táplálékfelvételt (HFD 3,2 ± 0,21 gm vs. HFD + PRR KO 3,8 ± 0,42 g) (1C. Ábra). A kiinduláskor (0. nap) nem volt szignifikáns különbség a vérnyomás, a testtömeg és a 24 órás táplálékfelvétel terén (1. ábra).
(A) Szisztolés vérnyomás (SBP), (B) Testtömeg (BW) és (C) 24 órás táplálékfelvétel a kiindulási értéken, valamint a rendszeres étrend (RD) és a magas zsírtartalmú étrend (HFD) után 10 hét múlva, vagy PRR KO nélkül. Az adatok átlag ± SEM, NS nincs szignifikáns különbség, * p 2A. És 2B. Ábra). 10 hét végén, az RD kontrollokkal összehasonlítva, a kontroll egerek HFD-vel táplálták (HFD 1,3 ± 0,08 ml/nap, szemben RD 2,54 ± 0,18 ml/nap, P 2A ábra). Az RD kontrollokkal összehasonlítva az RD + PRR KO szignifikánsan 62% -kal növelte az UV-fényt (RD + PRR KO 4,12 ± 0,37 ml/nap vs RD 2,54 ± 0,18 ml/nap, P 2A ábra).
PRR kifejezése HFD-re válaszul
A vese medulláris PRR mRNS és fehérje expresszióját a 3A. És 3B. Ábra mutatja. Az RD-vel összehasonlítva a vese medulláris mRNS és a PRR fehérje expressziója szignifikánsan növekedett a HFD-vel táplált egerekben 69% -kal, illetve 47% -kal (P 3E és 3F ábra), a p-SGK-1 foszforilációja 48% -kal (P 3C ábra). HFD-vel táplált egerekben. Egyedül az RD-vel összehasonlítva az RD + PRR KO szignifikánsan 55% -kal és 27% -kal gyengítette az α-ENaC vese mRNS- és fehérje-expresszióját (P 3E és 3F ábra). Egyedül a HFD-hez képest a HFD + PRR KO egerek szintén szignifikánsan gyengítették az α-ENaC vese mRNS- és fehérje-expresszióját 67% -kal, illetve 83% -kal (P 3E. Ábra és 3F), illetve a p-SGK-1-et 50% -kal, (P ábra 3C). Az SGK-1 teljes expressziójában nem történt változás (3D ábra).
Vese intersticiális folyadék angiotenzin II (Ang II)
Az angiotenzin II renalis intersticiális folyadék (RIF) expressziója RD és HFD egerek veséjében, PRR KO-val vagy anélkül. Átlag ± SEM, * p 4. ábra). Eredményeinknek jelentős terápiás vonatkozásaik vannak az elhízás hipertóniájának kezelésére, mivel potenciálisan új célt jelentenek a vese nátrium-kezelésének szabályozására a korábban kialakított mechanizmusokon túl. Az elhízás által kiváltott antinatriuresis és az emelkedett BP mindazonáltal összetett betegségállapot, és további tanulmányokra van szükség annak megértéséhez, hogy a PRR és az α-ENaC közötti kapcsolat hogyan illeszkedik az elhízás során bekövetkező veseelváltozások tágabb körébe.
Finanszírozási nyilatkozat
Ezt a tanulmányt a Nemzeti Egészségügyi Intézetek támogatták a DK114875, DK078757 és HL091535 támogatásokkal a HMS számára. A finanszírozóknak nem volt szerepük a tanulmányok tervezésében, adatgyűjtésben és elemzésben, a közzétételre vonatkozó döntésben vagy a kézirat elkészítésében.
- A 17 legjobb étel magas vérnyomás ellen
- A magas vérnyomás megelőzése
- Só és magas vérnyomás tény Vs
- Elhízás és vérnyomás; News-Medical
- Képek a vérnyomást csökkentő ételekről