Bróm
Szerkesztõink átnézik az Ön által beküldötteket, és megállapítják, hogy módosítják-e a cikket.
- Betegségmegelőzési és Megelőzési Központok - Bróm
- Hiperfizika - bróm
- Chemicool - bróm
- Webelemek - bróm
- Jefferson Lab - Bróm
- Los Alamos Nemzeti Laboratórium - Bróm
- Királyi Kémiai Társaság - Bróm
- Rader Chem4Kids.com - bróm
Bróm (Br), kémiai elem, mélyvörös mérgező folyadék és a halogén elemek egyik tagja, vagy a periódusos rendszer 17. csoportja (VIIa. csoport).
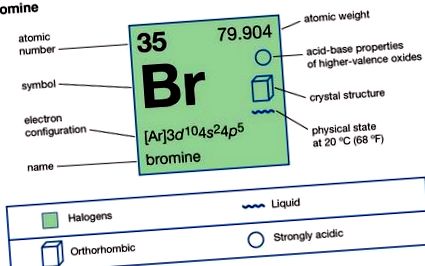
| 35 |
| [79.901, 79.907] |
| −7,2 ° C (19 ° F) |
| 59 ° C (138 ° F) |
| 3,12 20 ° C-on (68 ° F) |
| −1, +1, +3, +5, +7 |
| (Ar) 3d 10 4s 2 4p 5 |
Történelem
A brómot 1826-ban Antoine-Jérôme Balard francia vegyész fedezte fel a Montpellier-i tengeri só gyártásának maradványaiban (keserűjeiben). Az elemet úgy szabadította fel, hogy klórt vezetett át a maradékok vizes oldatán, amely magnézium-bromidot tartalmazott. Az anyag desztillálása mangán-dioxiddal és kénsavval vörös gőzöket eredményezett, amelyek sötét folyadékká kondenzálódtak. Ennek az eljárásnak a klórkészítéshez hasonlósága azt sugallta Balardnak, hogy a klórhoz hasonló új elemet kapott. (Úgy tűnik, hogy Justus von Liebig német vegyész Balard előtt szerezte meg az elemet, de tévesen jódkloridnak tekintette.) Az elem rossz szaga miatt a Francia Tudományos Akadémia a görög szóból a bróm nevet javasolta. bróm, ami „rossz szagot” vagy „bűzt” jelent.
Előfordulás és eloszlás
Ritka elem, a bróm a természetben a földkéregben diszpergálva csak oldható és oldhatatlan bromidokban található. Bizonyos dúsulás az óceán vizében (65 tömegrész/millió), a Holt-tengerben (kb. 5 gramm/liter [0,7 uncia/gallon]), egyes termálforrásokban és ritka oldhatatlan ezüst-bromid ásványi anyagokban (például bromirit, megtalálható Mexikóban és Chilében). A természetes sólerakódások és sóoldatok a bróm és vegyületeinek fő forrásai. Jordánia, Izrael, Kína és az Egyesült Államok vezette a világot a brómtermelésben a 21. század elején; A brómot termelő többi ország ebben az időszakban Japán, Ukrajna és India.
A természetes bróm két stabil izotóp keveréke: bróm-79 (50,54%) és bróm-81 (49,46%). Az elem 17 ismert radioaktív izotópja közül a bróm-77 felezési ideje a leghosszabb (57 óra).
Fizikai és kémiai tulajdonságok
A szabad bróm vörösesbarna folyadék, szobahőmérsékleten érezhető gőznyomással. A brómgőz borostyánszínű. A bróm szúrós szagú, irritálja a bőrt, a szemet és a légzőrendszert. Koncentrált brómgőzzel való érintkezés akár rövid ideig is végzetes lehet. A többi halogénhez hasonlóan a bróm is diatomiás molekulaként létezik minden aggregációs állapotban.
Körülbelül 3,41 g (0,12 uncia) bróm oldódik 100 ml (0,1 liter) vízben szobahőmérsékleten. Az oldat brómvíz néven ismert. A klórvízhez hasonlóan ez is jó oxidálószer, és hasznosabb, mert nem bomlik ilyen könnyen. Szabad jódot szabadít fel a jodidot tartalmazó oldatokból, a ként pedig a hidrogén-szulfidból. A kénsavat brómvíz kénsavvá oxidálja. Napfényben a bróm víz bomlik oxigén felszabadulásával, a következő egyenlet szerint:
Brómvízből egy hidrát (klatrát) különíthető el, amely 172 vízmolekulát és 20 üreget tartalmaz, amelyek alkalmasak a brómmolekulák befogadására. A bróm vizes alkáli-hidroxid-oldatokban oldódik, így bromidokat, hipobromitokat vagy bromátokat kap, a hőmérséklet függvényében. A brómot vízből könnyen extrahálhatjuk szerves oldószerekkel, például szén-tetrakloriddal, kloroformmal vagy szén-diszulfiddal, amelyekben nagyon jól oldódik. A szerves oldószerekben narancssárga oldatot kap.
A bróm elektron-affinitása magas, és hasonló a klóréhoz. Kevésbé erős oxidálószer, főleg a bromidionnak a kloridionhoz viszonyított gyengébb hidratációja miatt. Hasonlóképpen, a fém-bróm kötés gyengébb, mint a megfelelő fém-klór kötés, és ez a különbség a bróm kémiai reaktivitásában tükröződik, amely a klór és a jód között helyezkedik el. A szerves brómvegyület hasonlít a megfelelő klórszármazékra, de általában sűrűbb, kevésbé illékony, kevésbé éghető és kevésbé stabil.
A bróm hevesen keveredik az alkálifémekkel, valamint a foszforral, az arzénnal, az alumíniummal és az antimonnal, de kevésbé hevesen egyesül egyes más fémekkel. A bróm kiszorítja a hidrogént a telített szénhidrogénekből és hozzáad a telítetlen szénhidrogénekhez, bár nem olyan könnyen, mint a klór.
Az elem legstabilabb oxidációs állapota −1, amelyben a bróm természetesen előfordul. De 0 (elemi bróm, Br2), +1 (hipobromit, BrO -), +3 (bromit, BrO - 2), +5 (bromát, BrO - 3) és +7 (perbromát, BrO - 4) oxidációs állapotai ) szintén ismertek. A bróm első ionizációs energiája magas, és a pozitív oxidációs számú brómot tartalmazó vegyületeket megfelelő ligandumok, elsősorban oxigén és fluor stabilizálják. A +1, +3, +4, +5 és +7 oxidációs számmal rendelkező vegyületek kovalens kötéseket tartalmaznak.
Gyártás és felhasználás
A bróm legfőbb kereskedelmi forrása az óceánvíz, amelyből az elemet kémiai helyettesítéssel (oxidációval) extrahálják klórral kénsav jelenlétében a reakció során.
A reakció terméke egy híg brómoldat, amelyből az elemet levegő fújásával távolítják el. A szabad brómot ezután kén-dioxiddal összekeverjük, és az összekevert gázokat egy toronyba vezetjük, amelyen lefolyik a víz. A toronyban a következő reakció zajlik:
savkeveréket eredményez, amely bromid-ionban sokkal gazdagabb, mint a tengervíz. Egy második klórkezelés brómot szabadít fel, amely klórtól mentes és nedves vasreszelékeken történő átjárással tisztítható.
A kereskedelmi forgalomban kapható bróm általában legfeljebb 0,3% klórt tartalmaz. Általában üvegpalackokban vagy ólommal vagy Monel fémmel bevont hordókban tárolják.
A bróm ipari felhasználását az etilén-bromid (C2H4Br2) vegyület uralta, amelyet egyszer tetraetil-ólommal benzinhez adtak, hogy megakadályozzák az ólom lerakódását a motorban. Az ólmozott benzinről való lemondás óta a brómvegyületeket főleg égésgátlókban használják, de az etilén-bromid továbbra is fontos vegyület, mivel a fonálférgek és más talajban lévő kártevők elpusztítására használják. A brómot katalizátorok, például alumínium-bromid előállításához is használják.
A brómnak más felhasználási lehetőségei vannak, például a különféle színezékek és a tetrabróm-etán (C2H2Br4) és a brómforma (CHBr3) vegyületek előállításához, amelyeket folyadékként használnak a mérőeszközökben, nagy fajsúlyuk miatt. A 20. század eleji barbiturátok kifejlődéséig a kálium, nátrium, kalcium, stroncium, lítium és ammónium bromidjait nyugtató hatásuk miatt széles körben alkalmazták az orvostudományban. Az ezüst-bromid (AgBr), amely a fényképészeti film fontos eleme, az ezüst-kloridhoz és a jodidhoz hasonlóan fényérzékeny. A sütés javítása érdekében a búzaliszthez nyomokban kálium-bromátot (KBrO3) adunk. További jelentős brómvegyületek közé tartozik a hidrogén-bromid (HBr), a redukálószerként használt színtelen gáz és a szerves reakciók katalizátora. A gáz vizes oldatát hidrogén-bromidnak nevezzük, egy erős savnak, amely a fémek, oxidjaik és hidroxidjaikban kifejtett aktivitásában hasonlít a sósavra.
- Testtömegcsökkenés Pacsuli illóolaj felhasználás és gyógyító tulajdonságok
- 8 hihetetlen előnyök; A búzacsíraolaj felhasználása Szerves tények
- Aamchur por (nyers mangópor) Készítés, felhasználások, táplálkozási tények, kalóriák, egészségügyi előnyök, kockázatok
- Archimédész elve Leírás és tények Britannica
- Repülőgép meghatározása, típusai, mechanikája és tényei Britannica