Demadex
Találja meg a legalacsonyabb árakat a
DEMADEX
(torsemid) tabletta, szájon át történő alkalmazásra
LEÍRÁS
A DEMADEX® (torsemid) a piridin-szulfonil-karbamid osztályba tartozó vizelethajtó. Kémiai neve 1-izopropil-3 [(4-m-toluidino-3-piridil) szulfonil] karbamid és szerkezeti képlete:
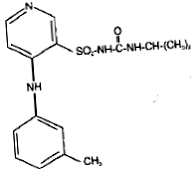 |
Empirikus képlete C16H20N4O3S, pKa 7,1 és molekulatömege 348,43.
A torsemid fehér vagy csaknem fehér kristályos por. Az orális alkalmazásra szánt tabletták tartalmaznak laktózt NF, kroszpovidont NF, povidont USP, mikrokristályos cellulóz NF és magnézium-sztearátot.
JELZÉSEK
Ödéma
A DEMADEX javallott szívelégtelenséggel, vesebetegséggel vagy májbetegséggel járó ödéma kezelésére.
Magas vérnyomás
A DEMADEX a magas vérnyomás kezelésére javallt, a vérnyomás csökkentésére. A vérnyomás csökkentése csökkenti a halálos és nem halálos kardiovaszkuláris események, elsősorban a stroke és a szívinfarktusok kockázatát. Ezeket az előnyöket a vérnyomáscsökkentő gyógyszerek kontrollált kísérleteiben figyelték meg a legkülönbözőbb farmakológiai osztályokból, beleértve azt az osztályt is, amelybe ez a gyógyszer elsősorban tartozik. Nincsenek olyan ellenőrzött vizsgálatok, amelyek igazolnák a kockázat csökkentését a DEMADEX alkalmazásával.
A magas vérnyomás kontrolljának részét kell képeznie az átfogó kardiovaszkuláris kockázatkezelésnek, ideértve adott esetben a lipidkontrollt, a cukorbetegség kezelését, az antitrombotikus terápiát, a dohányzásról való leszokást, a testmozgást és a korlátozott nátrium-bevitelt. Sok betegnek több gyógyszerre lesz szüksége a vérnyomás-célok eléréséhez. A célokkal és az irányítással kapcsolatos konkrét tanácsokért lásd a közzétett irányelveket, például az Országos Magas Vérnyomásos Oktatási Program magas vérnyomás megelőzésével, kimutatásával, értékelésével és kezelésével foglalkozó vegyes nemzeti bizottság (JNC) útmutatásait.
Számos antihipertenzív gyógyszer, különféle farmakológiai osztályokból és különböző hatásmechanizmusokkal, randomizált, kontrollált vizsgálatokban kimutatták, hogy csökkentik a kardiovaszkuláris morbiditást és mortalitást, és arra lehet következtetni, hogy ez vérnyomáscsökkentés, és nem a gyógyszer egyéb farmakológiai tulajdonsága. a gyógyszerek, ez nagyban felelős ezekért az előnyökért. A legnagyobb és következetes kardiovaszkuláris kimenetelű előny a stroke kockázatának csökkenése volt, de a szívizominfarktus és a kardiovaszkuláris mortalitás csökkenését is rendszeresen észlelték.
A megnövekedett szisztolés vagy diasztolés nyomás megnövekedett kardiovaszkuláris kockázatot okoz, és az abszolút kockázatnövekedés az Hgmm-re nagyobb nagyobb vérnyomás esetén, így a súlyos magas vérnyomás még mérsékelt csökkenése is jelentős előnyökkel járhat. A vérnyomáscsökkenésből származó relatív kockázatcsökkenés hasonló a változó abszolút kockázatú populációkban, így az abszolút előny nagyobb azokban a betegeknél, akiknek a kockázata nagyobb, függetlenül a magas vérnyomástól (például cukorbetegségben vagy hiperlipidémiában), és ilyen betegek várhatóan az agresszívebb kezelés előnyei az alacsonyabb vérnyomás elérése érdekében.
A DEMADEX vérnyomáscsökkentő hatása átlagosan nagyobb a fekete betegeknél, mint a nem fekete betegeknél [lásd KLINIKAI FARMAKOLÓGIA]. Egyes vérnyomáscsökkentő gyógyszereknek kisebb a vérnyomáshatása (monoterápiaként) a fekete betegeknél, és sok vérnyomáscsökkentőnek további jóváhagyott javallata és hatása van (például anginára, szívelégtelenségre vagy diabéteszes vesebetegségre). Ezek a szempontok irányíthatják a terápia kiválasztását.
A DEMADEX önmagában vagy más antihipertenzív szerekkel kombinálva alkalmazható.
DIABEMUTATÁS
ADAGOLÁS ÉS ADMINISZTRÁCIÓ
Az ödéma kezelése
Szívelégtelenséggel járó ödéma
Az ajánlott kezdő adag 10 mg vagy 20 mg orális DEMADEX naponta egyszer. Ha a vizelethajtó válasz nem megfelelő, titráljon felfelé körülbelül megduplázva, amíg a kívánt vízhajtó választ nem kapja meg. A 200 mg-nál magasabb dózisokat nem vizsgálták megfelelően.
Krónikus veseelégtelenséggel járó ödéma
Az ajánlott kezdő adag 20 mg orális DEMADEX naponta egyszer. Ha a vizelethajtó válasz nem megfelelő, titráljon felfelé körülbelül megduplázva, amíg a kívánt vízhajtó választ nem kapja meg. A 200 mg-nál magasabb dózisokat nem vizsgálták megfelelően.
Májcirrhosishoz kapcsolódó ödéma
Az ajánlott kezdő adag 5 mg vagy 10 mg orális DEMADEX naponta egyszer, aldoszteron antagonistával vagy kálium-megtakarító vizelethajtóval együtt alkalmazva. Ha a vizelethajtó válasz nem megfelelő, titráljon felfelé körülbelül megduplázva, amíg a kívánt vízhajtó választ nem kapja meg. A 40 mg-nál magasabb dózisokat ebben a populációban nem vizsgálták megfelelően.
A magas vérnyomás kezelése
Az ajánlott kezdő adag naponta egyszer 5 mg. Ha az 5 mg-os adag 4–6 héten belül nem biztosítja a vérnyomás megfelelő csökkenését, növelje napi 10 mg-ra. Ha a 10 mg-os válasz nem elegendő, adjon még egy vérnyomáscsökkentőt a kezelési rendbe.
HOGYAN KÍNÁLHATÓ
Adagolási formák és erősségek
A DEMADEX fehér színű, 5, 10, 20 és 100 mg-os tablettákban kapható.
Tárolás és kezelés
Az orális alkalmazásra szánt DEMADEX fehér, hasított tabletták formájában kapható az alábbiak szerint:
| Dózis | Alak | Debossing | NDC 0037-xxxx-xx | |
| 1. oldal | 2. oldal | Palack/100 | ||
| 5 mg | elliptikus | 5. | 5005 | 3505-01 |
| 10 mg | elliptikus | 10. | 5010 | 3510-01 |
| 20 mg | elliptikus | 20 | 5020 | 3520-01 |
| 100 mg | kapszula alakú | 100 | 5001 | 3500-01 |
15 ° C és 30 ° C közötti hőmérsékleten (59 ° C és 86 ° F között) tárolandó.
Gyártó: Meda Manufacturing GmbH, Köln, Németország: Meda Pharmaceuticals Meda Pharmaceuticals Inc. Somerset, NJ 08873-4120. Felülvizsgálva: 2017. február
MELLÉKHATÁSOK
A következő kockázatokat részletesebben tárgyaljuk más szakaszokban:
- A hipotenzió és a vesefunkció súlyosbodása [lásd FIGYELMEZTETÉSEK ÉS ÓVINTÉZKEDÉSEK]
- Elektrolit- és anyagcserezavarok [lásd FIGYELMEZTETÉSEK ÉS ÓVINTÉZKEDÉSEK]
- Ototoxicitás [lásd FIGYELMEZTETÉSEK ÉS ÓVINTÉZKEDÉSEK]
Klinikai vizsgálatok tapasztalatai
Mivel a klinikai vizsgálatokat nagyon eltérő körülmények között végzik, a gyógyszer klinikai vizsgálatai során megfigyelt mellékhatások aránya nem hasonlítható össze közvetlenül egy másik gyógyszer klinikai vizsgálatainak arányával, és nem feltétlenül tükrözi a gyakorlatban megfigyelt arányokat.
Az előzetes jóváhagyási vizsgálatok során a DEMADEX biztonságosságát körülbelül 4000 személynél értékelték; Ezen alanyok közül több mint 800 kapott DEMADEX-et legalább 6 hónapig, és több mint 380-at több mint 1 évig kezeltek. Ezen alanyok között 564 volt, akik DEMADEX-et kaptak az Egyesült Államokban végzett vizsgálatok során, amelyek során 274 másik alany kapott placebót.
A mellékhatások miatti terápia abbahagyása a DEMADEX-szel kezelt egyesült államokbeli betegek 3,5% -ánál és a placebóval kezelt betegek 4,4% -ánál történt.
Az Egyesült Államokban végzett placebo-kontrollos vizsgálatokban a túlzott vizelés a betegek 6,7% -ánál fordult elő, szemben a placebót kapó betegek 2,2% -ával. Az ezekben a vizsgálatokban alkalmazott DEMADEX napi dózisa 1,25 mg és 20 mg között volt, a betegek többsége 5-10 mg-ot kapott; a kezelés időtartama 1 és 52 nap között mozgott, mediánja 41 nap volt.
A placebo-kontrollos hipertóniás vizsgálatokban a túlzott vizelés dózistól függött; A placebót kapó betegek 1% -a, a napi 5 mg DEMADEX-rel kezelt betegek 4% -a és a 10 mg-mal kezelt betegek 15% -a. A túlzott vizeletürítést általában nem jelentették mellékhatásként azoknál a betegeknél, akik szív-, vese- vagy májelégtelenségben kapták a DEMADEX-et.
Az életkor vagy a nem befolyásolta a mellékhatások előfordulását.
Laboratóriumi paraméterek
Kálium
Az Egyesült Államokban végzett ellenőrzött vizsgálatok során a DEMADEX-et hipertóniás betegek számára napi 5 mg vagy 10 mg dózisban adták be. 6 hét elteltével ezeknél az adagoknál a szérum kálium átlagos csökkenése körülbelül 0,1 mEq/l volt. A vizsgálatok során bármikor a szérum káliumszintje 3,5 mEq/L alatt volt, 1,5% a DEMADEX-en és 3% a placebón. Az 1 éven át követett betegeknél az átlagos szérum káliumszint nem változott. Pangásos szívelégtelenségben, májcirrhosisban vagy vesebetegségben szenvedő betegeknél, akiket az Egyesült Államok vérnyomáscsökkentő vizsgálataiban alkalmazottnál magasabb dózisokkal kezeltek DEMADEX-sel, a hypokalaemiát nagyobb gyakorisággal, dózisfüggő módon figyelték meg.
Vér-karbamid-nitrogén (BUN), kreatinin és húgysav
A DEMADEX ezeknél a laboratóriumi értékeknél kis dózisfüggő növekedést eredményez. Hipertóniás betegeknél, akik 6 héten keresztül napi 10 mg DEMADEX-et kaptak, a vér karbamid-nitrogén átlagos növekedése 1,8 mg/dl (0,6 mmol/l), a szérum kreatininszint átlagos növekedése 0,05 mg/dl (4 mmol/l) volt és a szérum húgysav átlagos növekedése 1,2 mg/dl (70 mmol/l) volt. Kevés további változás történt a hosszú távú kezelés során, és minden változás megfordult, amikor a kezelést abbahagyták.
Szőlőcukor
A hipertóniás betegeknél, akik napi 10 mg DEMADEX-et kaptak, a szérum glükózkoncentrációja átlagosan 5,5 mg/dl (0,3 mmol/l) növekedést tapasztalt 6 hetes kezelés után, további 1,8 mg/dl (0,1 mmol/l) növekedéssel. a következő évben. Hosszú távú, cukorbetegeknél végzett vizsgálatok során az éhomi éhezés átlagos értéke nem változott szignifikánsan a kiindulási értékhez képest.
Szérum lipidek
A 20 mg DEMADEX kismértékű emelkedést okozott az összkoleszterin- és trigliceridszintekben rövid távú magas vérnyomás-vizsgálatokban. A változások a krónikus terápiával enyhültek.
Postmarketing tapasztalat
A DEMADEX jóváhagyása utáni alkalmazása során a következő mellékhatásokat azonosították. Mivel ezeket a reakciókat önként jelentik egy bizonytalan méretű populációból, nem mindig lehet megbízhatóan megbecsülni a gyakoriságukat, vagy ok-okozati összefüggést megállapítani a gyógyszer expozícióval.
Emésztőrendszer: Hasnyálmirigy-gyulladás, hasi fájdalom
Idegrendszer: Paresztézia, zavartság, látásromlás, étvágytalanság
Hepobiliaria: A máj transzaminázok, a gamma-glutamiltranszferáz szintjének emelkedése
Anyagcsere: Tiamin (B1-vitamin) hiány
- Goldthread használat, mellékhatások, kölcsönhatások, adagolás és figyelmeztetés
- Eltroxin - felhasználások, mellékhatások, kölcsönhatások
- Fenyő felhasználás, mellékhatások, kölcsönhatások, adagolás és figyelmeztetés
- Az Eltroxin orális felhasználása, mellékhatások, kölcsönhatások, képek, figyelmeztetések; Adagolás - WebMD
- Contrave (Bupropion és Naltrexone) - Mellékhatások, interakciók, felhasználások, adagolás, figyelmeztetések minden nap