Endotoxemia és májkárosodás rágcsáló modellben a hátsó végtag kirakodásakor
Absztrakt
Állati modell. Ebben a vizsgálatban hím Wistar patkányokat (250-300 g), C57BL/6 egereket és C3H/HEJ egereket (20-25 g) használtunk. Az állatokat standard laboratóriumi chow-vel etették, szabad hozzáférést biztosítottak a vízhez, és 12: 12-órás világos-sötét ciklusban tartották őket. HU (n = 8 állat/rágcsáló törzs) Wronski és Morey-Holton (53) adaptált modelljének felhasználásával végeztük el; egyedileg elhelyezett nem szuszpendált állatokat használtunk kontrollként (n = 6 állat/rágcsáló törzs). Röviden, az állatokat ketamin-xilazin koktél segítségével altattuk, és a farokra öntött készüléket alkalmaztunk. A ketrec körüli szabad mozgás megkönnyítése érdekében a gipszet egy, a ketrec tetejére rögzített forgórészhez rögzítették, lehetővé téve a 360 ° -os mozgástartományt. Az állatokat 30 ° -kal felfelé döntöttük. HU alatt a felfüggesztési szöget a testméret növekedésével módosították, hogy megakadályozzák a hátsó végtagok súlyának megterhelését. Mivel a felfüggesztett állatok mozgása korlátozott, az állatokat naponta ápolták, hogy megakadályozzák a szövődményeket, például a vizelet forrázását és a fertőzést. Ezt az állatkezelési protokollt a Baylor Orvostudományi Főiskola Állat-kutatási Bizottsága jóváhagyta a vizsgálat előtt.
Endotoxin mérés. 4 hét múlva heparinizált vérmintákat vettünk a portális vénából vagy a vena cava-ból. Korábban kifejlesztett továbbfejlesztett kimutatási módszert alkalmaztak az endotoxin mérésére (42). Röviden, a mintákat 50 ° C-on centrifugáltuk g 10 percig, és a vérlemezkékben gazdag plazmát (PRP) -80 ° C-on tároltuk. A plazmamintákat 1:10 arányban hígítottuk, és 10 percig 75 ° C-ra hevítettük, hogy denaturálják a vizsgálatot zavaró fehérjéket. Ezt követően az endotoxint kinetikai teszt alkalmazásával mértük kromogén szubsztráttal, a Limulus amebocita lizátum vizsgálaton (BioWhittaker) alapulva. Az endotoxin koncentrációját a kezeletlen állatok plazmájában minden egyes vizsgálathoz készített standard alapján számítottuk. Az exogén endotoxinnal történő szennyeződés megelőzése érdekében szigorú, nem pirogén technikát alkalmaztak a mintagyűjtéshez és a vizsgálati eljáráshoz.
Hisztopatológia. A kísérlet végén a máj egy kis részét boncoltuk és cinkkel pufferelt formalinban tartósítottuk. Ezt követően a szöveteket rutin hematoxilin- és eozinfestésre dolgozták fel, hogy értékeljék az általános felépítést és a sérüléseket. A máj neutrofil tartalmát immunhisztokémiai festéssel határoztuk meg anti/neutrofil antitest 7/4-es klónnal (serotec). Megszámoltuk a pozitívan festett neutrofilek számát egy 70 mm 2 -es területen.
Enzimaktivitás. Közvetlenül a halál előtt vérmintákat vettek az alsó vena cava-ból és a szérumból -80 ° C-on tárolták. Az ALT és AST aktivitást a sérülés markereként mértük a szokásos enzimatikus vizsgálati eljárásokkal (8).
Tumor nekrózis faktor-α. A tumor nekrózis faktor-α (TNF-α) mérését a kontroll és a HU rágcsálók vérmintáiban végeztük citoszképernyős immunvizsgálati készlet alkalmazásával (Bio-source International, Camarillo, CA).
Citokróm P-450 ELISA. A máj homogenizátumból mikroszóma frakciókat izoláltunk kalcium-kloridos kicsapási módszerrel (12). A mikroszómás frakció teljes fehérjetartalmát Bradford módszerrel határoztuk meg (9). Ezt követően a citokróm fehérje szintje P-450 2B-t és 3A-t 37 ° C-on mértünk mikrolemezeken, standard ELISA kit eljárással (Amersham Biosciences, Buckinghamshire, Egyesült Királyság).
Molekuláris szondák. Az akut fázisú reagens szérum amiloid A (SAA) specifikus cDNS-próbáját RT-PCR-rel állítottuk elő a következő primerek alkalmazásával: sense primer, 5′-TATGATGCTGCYMAAAGGGG-3′; antiszensz primer, 5′-CTCAGACAAATACTTCCATG-3 ’. A reverz transzkripciós protokollokat 5 μg teljes RNS-sel végeztük. A reverz transzkripciós reakció alikvotjait 5 U alkalmazásával amplifikáltuk Taq DNS-polimeráz (Promega, Madison, WI) 30 ciklus alatt 93 ° C-on 1 percig, 55 ° C-on 2 percig és 72 ° C-on 3 percig. A kapott 222 bázispár-fragmenst tisztítottuk, és a szekvenálás előtt a pGEM-T könnyű vektorba (Promega) klónoztuk. A haptoglobin és a lipopoliszacharid-kötő fehérje (LBP) cDNS-klónjait kereskedelemben kaptuk (ATCC, Manassas, VA).
RNS izolálás. A kontroll- és HU-állatokból nyert májokat folyékony nitrogénben azonnal lefagyasztották. Az összes RNS-t fagyasztott májból extraháltuk savas guanidium-tiocianát-fenol-kloroform módszerrel (11.). Ezt követően 10 μg teljes etidium-bromidot tartalmazó RNS-t elektroforézisre adtunk formaldehidet tartalmazó 1% -os agarózgélen, majd standard eljárásokkal nejlonmembránra (Gene Screen Plus; New England Nuclear, Boston, MA) vittük át.
Északi hibridizáció. A membránokat QuikHyb-ben (Stratagene, La Jolla, CA) hibridizáltuk 68 ° C-on 2 órán át 1 × 106 dpm véletlenszerű hexamer 32 P-jelölt cDNS-próbákkal, és a szűrőket a korábban leírtak szerint dolgoztuk fel (44). Az Northern hibridizációs eredmények számszerűsítését densitometriával végeztük. A sűrűséget a 18S riboszomális RNS alegység intenzitására normalizáltuk a korábban leírtak szerint (17).
Adatelemzés. Az itt bemutatott adatok statisztikai elemzését Student's segítségével végeztük t-teszt vagy kétirányú ANOVA, adott esetben Tukey többszörös összehasonlító tesztjével; P 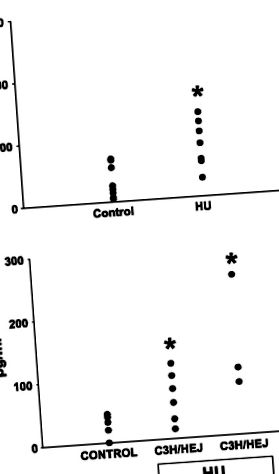
1. ábra.Patkányok portál vénájának endotoxinszintje (A) és egerek (B). HU, hátulsó szár kirakása. Közvetlenül a halál előtt vérmintákat gyűjtöttek a portális vénából, és az endotoxint vérlemezkékben gazdag plazmában mérték a limulus amebocita lizátum vizsgálattal. Az értékek csoportonként 4-6 megfigyelés átlagértékei ± SE; patkányok adatai (A) elemzéséhez Student's-t használtunk t-teszt; kétirányú ANOVA-t használtak az egerekből származó adatok elemzésére (B). * P
2. ábra.Májkárosodás HU után. A kontroll hematoxilin és eozinnal festett máj szakaszai (A-C) és 4 hetes HU (D-F). A reprezentatív szakaszok patkányokból származnak (A és D), C57BL/6 egerek (B és E) és C3H/HEJ egerek (C és F).
3. ábra.Patkányok szérumenzimjei (A) és egerek (B). Az aszpartát-aminotranszferáz (AST) és az alanin-aminotranszferáz (ALT) szérumszintjét standard spektrofotometriás vizsgálatokkal mértük a módszerekben leírtak szerint. Az értékek csoportonként 4 megfigyelés átlagértékei ± SE. Patkányok adatai (A) elemzéséhez Student's-t használtunk t-teszt; kétirányú ANOVA-t használtak az egerekből származó adatok elemzésére (B). * P
4. ábra.Plazma tumor nekrózis faktor-α (TNF-α) szintek vagy patkányok (A) és egerek (B). A TNF-α-t a halál idején összegyűjtött vérmintákból mértük. Az adatok csoportonként 4 megfigyelés átlagértékei ± SE patkányok esetében (A) és egerek (B). Az egerek adatait kétirányú ANOVA alkalmazásával elemeztük; * P
Az akut fázisú válasz bizonyítéka. Köztudott, hogy az endotoxémia stimulálhatja az akut fázisú reagensek expresszióját (7, 22); ezért elemeztük az SAA, a haptoglobin és az LBP reprezentatív reagensek mRNS-expresszióját. A kontroll patkányokban a haptoglobin és az LBP 1,06 ± 0,4, illetve 1,60 ± 0,05 volt (n = 4). Ezeknek a fehérjéknek az expressziója szignifikánsan ~ 50, illetve 60% -kal emelkedett 3 hetes HU után (n = 5; P
5. ábra.Akut fázisú fehérjék mRNS expressziója egerekben. A teljes mRNS-t a C57BL/6 májából izoláltuk (A) és C3H/HEJ egerek (B); A haptoglobin (HP), a szérum amiloid A (SAA) és a lipopoliszacharidkötő fehérje (LBP) mRNS-ét Northern blot analízissel detektáltuk. Az egyes sávok sűrűségét a 18S sávhoz viszonyítva határoztuk meg. Az egyes sávok feletti számok a kísérletben az egyes próbák sűrűségének növekedését mutatják a legkisebb sűrűséghez viszonyítva. Sávok 1-4 nem felfüggesztett kontrollokból származnak; sávok 5-7 és 8-10 a májminták 3, illetve 4 hét HU után gyűjtöttek.
Citokróm P-450 2B és 3A expresszió. A CYP 2B és a CYP 3A fehérje expressziója, a citokróm két reprezentatív izoformája P-450-et mértünk ELISA-val annak megállapítására, hogy a HU által indukált májkárosodás megváltoztatta-e a máj metabolikus kapacitását. A CYP 2B és a CYP 3A fehérje expressziója 231,0 ± 85, illetve 29,6 ± 1,7 μg/mg mikroszóma fehérje volt a kontroll patkányokban. 4 hetes HU után ezeknek az izoformáknak a fehérje expressziója 30-70% -kal csökkent (6. ábra). Egerekben viszont ezen enzimek fehérje expresszióját a HU nem befolyásolta (az adatokat nem közöltük).
6. ábra.A farokszuszpenzió hatása a citokróm fehérje szintjére P-450 2B (A) és 3A (B). A kontroll patkányok 4 héten át szuszpendált májját kivágtuk, folyékony nitrogénben lefagyasztottuk és -80 ° C-on tároltuk. A mikroszóma frakciót elkülönítettük, és a CYP3A és 2B tartalmat ELISA módszerrel mértük, a módszerek szerint. Az értékek csoportonként 4 megfigyelés átlagértékei ± SE. * P
HU portális véna endotoxémiát és akut fázisú választ eredményez. Az endotoxin (lipopoliszacharid) polimer a gram-negatív baktériumok külső membránjában, főleg az ileumban és a vastagbélben található. Normális esetben a bélfal védőgátat képez nagy mennyiségű endotoxin szisztémás keringésbe történő kibocsátása ellen. Kóros fiziológiai körülmények között azonban a béláteresztő képesség jelentősen megnőhet, lehetővé téve a baktériumok és a baktériumkomponensek szivárgását a keringésbe.
A portál endotoxémia hátterében álló mechanizmust nem sikerült azonosítani. A HU után vaszkuláris változásokról számoltak be, beleértve a gyomor-bél traktus fokozott véráramlását (14, 25). Úgy gondolják, hogy a bélmozgás lassabb a mikrogravitációnak való kitettség alatt (5). Ezek a változások a baktériumok és baktériumtermékek, például az endotoxin transzlokációját eredményezhetik a bél lumenéből a keringésbe.
A traumát és fertőzést követő homeosztatikus állapot helyreállításának mechanizmusaként a glükokortikoidok és a makrofágból származó citokinek elindítják az akut fázisú reagensek szintézisét és szekrécióját; ezen reagensek jelentős részét a máj termeli. Az endotoxémia az akut fázisú válasz erős induktora (7), ezt a jelenséget valószínűleg a Kupffer-sejtből származó citokinek közvetítik. A HU mint endotoxémia modelljének alátámasztása érdekében az I. osztályú akut fázisú fehérjék, a haptoglobin, az SAA és az LBP expressziója fokozódott a C57BL/6 egerekben, mindössze 3 hét hetes HU után (5. ábra). C3H/HEJ egerekben az SAA expresszió csak a 4 hetes idõpontban emelkedett. Az endotoxin-rezisztens egereknél az SAA megemelkedett expressziójának ez a késése azt mutatja, hogy az endotoxin szerepet játszik a HU utáni korai akut fázisú válaszban. A későbbi időpontokban azonban valószínűleg további tényezők járulnak hozzá az eredményezett akut fázisú válaszhoz.
A HU által kiváltott sérülés megváltozott májfunkciót eredményez. A gyulladásos citokinek, például a TNF-a májkárosodást és diszfunkciót váltanak ki (13). Valójában a TNF-α fontos szerepet játszik a májkárosodás hátterében álló mechanizmusokban, és közvetlenül csökkentheti a citokróm fehérje szintjét P-450 (34, 39). Mint arról itt beszámoltunk, a TNF-α növekedett a C57BL/6 egerekben HU után, és tendencia mutatkozott ennek a citokinnek a szérumszintjének növekedése felé a HU patkányokban a nem szuszpendált kontrollokhoz képest (4. ábra). Valószínű, hogy a megnövekedett keringő TNF-α hozzájárult a HU okozta sérülések és májműködési zavarok kialakulásához.
Ez az Egyesült Államok Mezőgazdasági Minisztériumának (USDA), az Agrárkutatási Szolgálat (ARS) Gyermektáplálkozási Kutatóközpontjának Gyermekgyógyászati Osztályának, a Baylor College of Medicine és a Texas Gyermekkórház kiadványa, Houston, Texas. Ezt a munkát az USDA/ARS szövetségi alapjai támogatták az USDA 6250-5100-037 támogatás, a Texas-öböl parti emésztőrendszeri központja (DK-56338 Nemzeti Egészségügyi Intézet támogatása) és a Nemzeti Űrbiomedikai Kutatóintézet (NCC9- 58). A kiadvány tartalma nem feltétlenül tükrözi az USDA nézeteit vagy politikáját, és a kereskedelmi nevek, kereskedelmi termékek vagy szervezetek említése sem jelenti az Egyesült Államok kormányának jóváhagyását.
LÁBJEGYZETEK
A cikk megjelenésének költségeit részben az oldaldíjak megfizetése fedezte. A cikket ezért ezennel fel kell tüntetni:hirdetés”Szerint a 18 U.S.C. Az 1734. § kizárólag ennek a ténynek a feltüntetésére.
Köszönjük Dr. Susan Bloomfieldnek (egyetemi docens, Egészségügyi és Kineziológiai Tanszék, Texas A & M Egyetem) a HU modellhez nyújtott segítségért.
- A 3 napos kirakodás hatása az izmok molekuláris szabályozóira emberben Journal of Applied
- Sejtek nélküli teljes szövegű hepatocita sérülés és máj őssejt-rése a sejtek progressziójában
- Diet and MicroRNA Expression A Systematic Review - McNaughton - 2017 - The FASEB Journal - Wiley
- Fókális noduláris hiperplázia és májadenoma epidemiológia és patológia - FullText - Emésztőrendszer
- Élelmiszer- és táplálkozási folyóirat (ISSN 2575-7091) - Gavin Publishers