A 3 napos kirakodás hatása az izmok molekuláris szabályozóira emberben
Laboratóriumi Orvosi Osztály, Klinikai Élettan, Karolinska Institutet, Karolinska Egyetemi Kórház;
Az újranyomtatási kérelmek és egyéb levelezések címe: T. Gustafsson, Laboratóriumi Orvostudományi Osztály, Klinikai Élettani Szakosztály, Karolinska Institutet, 141 86 Stockholm, Svédország (e-mail: [email protected]).
Laboratóriumi Orvosi Osztály, Klinikai Élettan, Karolinska Institutet, Karolinska Egyetemi Kórház;
Andrológiai és Molekuláris Endokrinológiai Egységek, Karolinska Institutet Orvostudományi Kar, Karolinska Egyetemi Kórház, Stockholm, Svédország;
Élettani és Farmakológiai Tanszék, Karolinska Institutet, Stockholm, Svédország; és
Humán teljesítmény laboratórium, Ball State University, Muncie, Indiana;
Nemzeti Repülési és Űrigazgatóság, Johnson Űrközpont, Houston, Texas;
Élettani és Farmakológiai Tanszék, Karolinska Institutet, Stockholm, Svédország; és
Egészségtudományi Tanszék, Közép-Svédországi Egyetem, Östersund, Svédország
Absztrakt
Az Ub-P útvonal három ubiquitin ligáz enzim, azaz az E1 – E3 összehangolt hatása, amelyek úgy működnek, hogy az ubiquitin kofaktorokat a fehérjékhez kötik, és így célpontokká teszik őket a proteaszóma lebontási útvonal felé (4). Kimutatták, hogy az atrogin-1 és a MuRF-1, két E3 ubiquitin ligáz altípus központi szerepet játszik az izomsorvadás folyamatában (6, 18, 26, 39, 42). Mindkettőt a FOXO család tagjai szabályozzák, és izomvesztést eredményező körülmények között szabályozzák őket (43). Tekintettel arra, hogy az Ub-P csak a monomer aktint és a miozint bontja le, más proteázok, például kaszpáz-3, kalpain-2 és kalpain-3 szükségesek ahhoz, hogy elősegítsék az Ub-P fehérje lebontását (4, 14, 20, 25).
A kép azonban összetettebb, és más útvonalakról is ismert, hogy befolyásolják az izomtömeget. Például a mitogén-aktivált protein-kináz (MAPK) útvonalak tagjai, például a p38, aktiválódnak és elindítják a fehérje lebontási folyamatokat az izomterhelés hatására (29). A miosztatin, a transzformáló növekedési faktor (TGF) -β szupercsalád tagja, szintén az izoméret fontos szabályozójaként jelent meg (21, 27). A miosztatin-funkció elvesztése elősegíti az emberi és az állati vázizomzat markáns hipertrófiáját (24, 41), és a miosztatin szisztémás beadása súlyos izommeresztést okoz (34, 49). Ezenkívül a miosztatin túlzott expresszálása egerekben cachexiát eredményez, amely egerekben fokozott atrogin-1 és MuRF-1 expresszióval jár (34). A rágcsálók vázizomzatával kapcsolatos legújabb vizsgálatok a myostatin aktivitást a PI3K-Akt1 útvonallal is összekötötték (3, 10).
Kutatásunk kimutatta, hogy az egyoldali alsó végtag-szuszpenzió (ULLS) 3 nap múlva kiváltja a proteolízist (45), és az ULLS után néhány héten belül nyilvánvaló a robusztus teljes izomsorvadás (5, 19, 44). Jelen vizsgálat feltárta az ULLS 3 napos hatásait az egészséges felnőtt férfiak súlyt viselő izmainak potenciális jelöltjelzési útvonalaira. Feltételeztük, hogy a 3 napos ULLS izomvesztést okoz a PI3K-Akt1 csökkent aktivációja és a miosztatin expresszió fokozása révén. Mivel a triceps surae nagyobb atrófiát mutat, mint a quadriceps izom, válaszul a hosszú távú ágynyugalomra (1, 46), a két súlyt viselő vastus lateralis (VL) és soleus (Sol) izmokban jelátviteli utakat és génexpressziót is tanulmányoztunk. 3 napos ULLS előtt és után. Feltételeztük, hogy az izom atrófiához vezető folyamatokat elindító jelátviteli utak hangsúlyosabbak Sol-ban.
Tárgyak.
Nyolc egészséges felnőtt férfit (átlag ± SD; 25 ± 5 év, 183 ± 3 cm, 76 ± 8 kg) toboroztak a stockholmi nagyvárosi területről. Az alany mintája a fizikailag aktívaktól a mozgásszegény egyedekig terjedt. A kísérletek előtt az alanyokat átvilágították az esetenként előforduló alsó végtagi patológiák, neuromuszkuláris rendellenességek vagy szív- és érrendszeri betegségek szempontjából. Minden kísérleti alany írásos beleegyezést kapott, miután tájékoztatták a kísérletekkel kapcsolatos eljárásokról, kockázatokról és lehetséges előnyökről. A vizsgálati protokollt az Etikai Bizottság hagyta jóvá a Karolinska Intézetben.
Kirakodás.
Az ULLS-t a korábban leírt módon hajtottuk végre (44, 45). Röviden, a függőleges vagy az ambuláns tevékenységeket rövid, kézifogással és alkarral ellátott mankók segítették a könyöktől távolabb (Swereco Rehab AB, Sollentuna, Svédország). A jobb lábat 10 cm vastag talppal ellátott cipővel szerelték fel, hogy eltávolítsák a terhelést a bal terheletlen végtagtól. A boka vagy a térdízület mozgását visszatartó cipő nem volt rögzítve. Az alanyok otthon éltek, és a kísérleti időszak alatt megtartották szokásos foglalkozási feladataikat. A megfelelést az egyik nyomozóval folytatott napi kapcsolat révén ösztönöztük. Két héttel az ULLS beavatkozás előtt minden alany négy ülésen esett át, hogy gyakorolják a mankóval járást és az ULLS beavatkozáshoz kapcsolódó napi feladatokat. Az alanyok az ULLS megjelenése előtt 3 nappal tartózkodtak minden megerőltető fizikai aktivitástól, ugyanakkor megtartották szokásos étkezési szokásaikat. Azonban 24 órával a mérések előtt a diétát standardizált étkezésként tésztából és zöldségből állították elő.
Izomminták gyűjtése.
Izombiopsziát nyertünk a jobb lábról az ULLS előtt, a bal lábról pedig az ULLS 3 napos (72 órás) befejezése után, mielőtt bármilyen súlyt viselő tevékenységet folytattunk volna. Egy éjszakán át tartó gyors böjtöt követően, helyi érzéstelenítő (Carbocain) és a bőr bemetszése után izombiopsziákat nyertünk a VL-től és a Sol-tól 5 mm-es Bergström tűvel (Bergström 1962). Az izommintákat megtisztítottuk a felesleges vértől, a kötőszövettől és a zsírtól, majd folyékony nitrogénben lefagyasztottuk, és további elemzésig -80 ° C-on tároltuk.
Fehérje extrakció és Western blot.
RNS izolálás, reverz transzkripció és valós idejű (RT) kvantitatív PCR.
Statisztika.
A normalitás tesztjét követően egy nem paraméteres Wilcoxon párosított mintát alkalmaztunk az idő (pre; poszt) és az izom (VL; Sol) fehérje foszforilációra és mRNS expressziójára gyakorolt hatásainak felmérésére (Statistica, StatSoft, Tulsa, OK). A VL post-post különbségeit összehasonlítottuk a Sol utáni pre-post különbségekkel, hogy azonosítsuk a két izom kölcsönhatását. A jelentőséget elfogadták P 0,05; 1. ábra). Az ULLS előtt az IGF1, a FOXO-1A, a FOXO-3A, a kaszpáz-3, valamint a kalpain-2 és -3 mRNS expressziója nagyobb volt Sol esetében, mint VL (P 0,05; 2. ábra). Nem voltak különbségek (P > 0,05) az atrogin-1, MuRF-1, 4E-BP1 vagy myostatin kiindulási mRNS-expressziójában az izmok között. Az atrogin-1 általában magasabb volt Sol-ban a VL-hez képest (P = 0,12; adatok nem láthatók). Az Atrogin-1 és a MuRF-1 emelkedett VL-ben, de Sol-ban nem, ULLS után (interakciós idő és izom) P 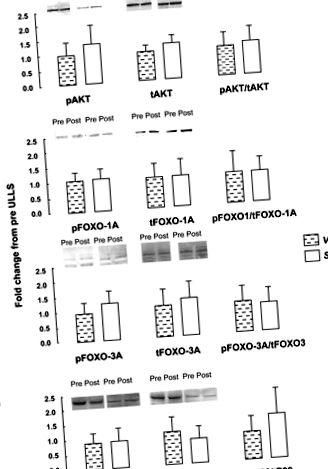
1. ábra.Foszforilált és teljes fehérje mennyiség, valamint a foszforilezett (p) és az összes (t) fehérje aránya az Akt1–1 esetében (A), Villafej O osztály (FOXO) -1A (B), FOXO-3A (C) és p38 (D) 3 nap előtti és előtti (utáni) egyoldalú alsó végtag-szuszpenzió (ULLS) a vastus lateralis izomban (VL) és a soleus izomban (Sol) (n = 8). Az oszlopok az átlagos értéket mutatják, a sávok pedig az SD-t.
2. ábra.Az IGF1, FOXO-1A és FOXO-3A mRNS-expressziójának változásaA), valamint a kaszpáz-3, kalpain-2 és kalpain-3 (B) a VL és a Sol. Az mRNS expressziókat a GAPDH háztartási génre normalizáltuk. A dobozdiagramok 25–75 percentiliseket és medián értékeket mutatnak (n = 8).
3. ábra.A hajtás megváltoztatja az atrogin-1 és MuRF-1 mRNS expresszióját VL-ben és Sol-ban. Az atrogin-1 mind a 18S-re, mind a GAPDH-ra normalizálódik annak bizonyítására, hogy a célgén/háztartásgén arányának változásai függetlenek voltak egy adott háztartási gén változásától. # Különbség (P
4. ábra.A: az eukarióta transzláció iniciációs faktor 4E kötő fehérje 1 (4E-BP1) mRNS szintjének változása VL-ben és Sol-ban. Az mRNS-t GADPH-ra normalizálják háztartási génként. B: a foszforilezett 4E-BP1 szeres változásai normalizálják a teljes fehérje szintet VL-ben és Sol-ban. # Különbség (P
5. ábra.A: a myostatin mRNS szintjének változása VL-ben és Sol-ban. Az mRNS-t GADPH-ra normalizálják háztartási génként. B: a myostatin fehérje szintjének változása VL-ben és Sol-ban. *Jelentős különbség (P
A vázizomzat lebomlása napokon belül nyilvánvaló (45), és a teljes izom atrófia heteken belül jelentkezik ULLS-ben szenvedő egészséges egyéneknél (5, 19, 44). Ezeknek a megfigyeléseknek a feltételezéseként feltételezték, hogy az izomsejtek tenyészetében az atrófiás folyamatokat szabályozó gén expresszió és jelátviteli utak, valamint az állatmodellek csak néhány napos, nem súlyú terhelés után változnak az emberi vázizomzatban. Valójában az atrogin-1 és MuRF-1 megnövekedett mRNS-szintjét mutattuk ki, amelyek kulcsfontosságú tényezők az Ub-P útvonal aktiválásában, 3 napos ULLS után. Bár az Akt1 foszforilációjában párhuzamos változások nem következtek be, a myostatin mRNS és a fehérje szintje egyidejűleg növekedett.
A két izomspecifikus E3 ubiquitin ligáz fehérje, az atrogin-1 és a MuRF-1, olyan kísérleti modellekben aktiválódik, amelyek izomterhelést idéznek elő. Ezért ezeket a tényezőket a vázizomzat lebontásának markereinek nevezték ki (4, 6, 18, 26, 39, 42). Egy nemrégiben készült tanulmányban fokozott aktin- és miozin-proteolízisről számoltunk be (45), és a jelen vizsgálat 3 napos ULLS után megnövekedett atrogin-1 és MuRF-1 mRNS-szinteket mutatott. Ezek a megállapítások együttesen azt sugallják, hogy a vázizomzat proteolízise az atrófia folyamatának elején történik az Ub-P útvonal aktiválásával. Mégis, az mRNS szintjén a fehérje lebontási folyamat „upstream” faktorai, azaz a kaszpáz-3, a kalpain-2 és a kalpain-3 az ULLS nyomán változatlanok voltak. Ez a megfigyelés összhangban áll azzal az általános elképzeléssel, hogy ezek az enzimek proteolitikusan aktiválódnak az előformázott fehérjék hasításával (4, 17, 25). Ezért a jövőbeni ULLS-vizsgálatok indokolttá teszik a vázizomenzim aktivitásának vagy tartalmának változását.
Az izomsorvadást megkönnyítheti a kompromittált fehérjeszintézis is (6, 15, 16, 42). Míg a fehérjeszintézis szabályozását számos transzlációs tényező közvetíti (32, 37), úgy tűnik, a 4E-BP1 defoszforilezése szabályozza a fehérjeszintézis sebességét azáltal, hogy gátolja a fehérje transzlációját az eIF-4E-hez való fokozott kötődés révén. Jelen tanulmányban a 4E-BP1 mRNS és a foszforiláció/fehérje szint arány párhuzamosan növekedett. Az egyetlen tényező változásának jelentőségét azonban nem szabad túlbecsülni, de az ULLS korai szakaszában nem támogatja a csökkent fehérjeszintézist. Ez ellentétben áll az attenuált fehérjeszintézis jól dokumentált megállapításával egy hosszabb ideig tartó izomhasználat után (35).
- Endotoxemia és májkárosodás rágcsáló modellben a hátsó lábszár tehermentesítésében Journal of Applied Physiology
- A magas fehérjetartalmú étrend hatása a nagy bélre túlsúlyos embereknél - teljes szöveg megtekintése
- Az étrend hatása az exokrin hasnyálmirigy-elégtelenség klinikai tüneteire kutyákban Journal of the
- A magas zsírtartalmú étrend gátolja az emberek terhelés okozta izom hipertrófiáját
- Az elhízás hatása a mell méretére, a mellkas gerincének szerkezetére és működésére, a felső törzsre