International Journal of Molecular Sciences
Legfrissebb cikkek
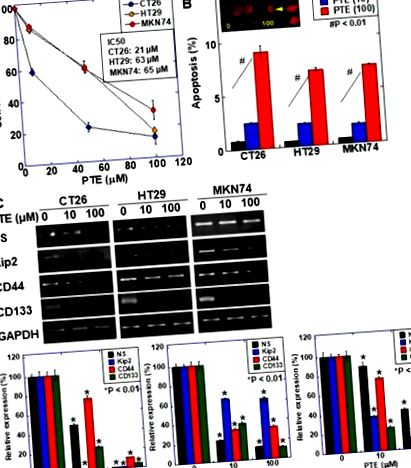
A pterostilbene (PTE) hatása a sejtproliferációra és az őssejtmarkerek expressziójára rákos sejtvonalakban. (A) A sejtproliferációt 3- (4,5-dimetil-tiazol-2-il) -5- (3-karboxi-metoxi-fenil) -2- (4-szulfofenil) -2H-tetrazolium, belső só (MTS) vizsgálattal értékeltük. A sejteket 48 órán át PTE-vel kezeltük. (B) Az apoptózist etidium-bromid (EtBr) festéssel értékeltük. Az inszert, 48 órás PTE-vel kezelt CT26 sejteket EtBr-rel festettük. Nyílfej, apoptózis test. Méretarány, 20 µM. (C) őssejt-markerek mRNS-expressziója; nukleosztinint (NS), CD44-et, Kip2-t és CD133-ot vizsgáltunk RT-PCR-rel. A gliceraldehid-3-foszfát-dehidrogenázt (GAPDH) amplifikáltuk töltési standardként. Az alsó paneleken az őssejt marker expressziójának félkvantifikációját vizsgáltuk RT-PCR-rel. Hibasáv, szórás három független vizsgálattól. A statisztikai különbséget szokásos varianciaanalízissel számoltuk. * Statisztikai különbség a PTE-től (0 µM). PTE, pterosztilbene; IC50, 50% -os gátló koncentráció.
A PTE hatása a gömbképződésre a rákos sejtvonalakban. A gömbképződést 10 000 sejtben vizsgáltuk PTE kezeléssel vagy anélkül 7 napig. (A) CT26 sejtek. (B) HT29 sejtek. A képek fáziskontrasztos mikroszkópos képek voltak. Hibasáv, szórás három független vizsgálattól. A statisztikai különbséget szokásos varianciaanalízissel számoltuk. Méretarány, 50 μm. TE, pterostilbene.
A PTE hatása az oxidatív stresszre a rákos sejtvonalakban. (A) A 4-hidroxinonenal (4-HNE) szinteket enzimhez kapcsolt immunszorbens vizsgálattal (ELISA) mértük. A sejteket 48 órán át PTE-vel kezeltük. (B) A hem-oxigenáz-1 (HO-1) mRNS-expresszióját RT-PCR-rel vizsgáltuk. A GAPDH-t töltési standardként amplifikáltuk. A jobb oldali rész HO-1 expressziójának félkvantifikálását végeztük RT-PCR-rel. Hibasáv, szórás három független vizsgálattól. A statisztikai különbséget szokásos varianciaanalízissel számoltuk. PTE, pterosztilbene; HNE. Hydroxynonenal; HO, hem-oxigenáz.
A PTE hatása a rákos sejtek mitokondriális működésére. A mitokondriális membrán feszültségét és a mitokondriális reaktív oxidatív anyagokat (ROS) tetrametil-rodamin (TMRE), illetve dihidrorodamin (DHR) segítségével vizsgáltuk. A sejteket 48 órán át PTE-vel kezeltük. (A) TMRE és DHR fluoreszcencia képei. A TMRE képet egyesítették a fázissal kontrasztos képpel. Méretarány, 25 μm. (B, C) A mitokondriális membránpotenciál (TMRE) és a mitokondriális ROS (DHR) félkvantifikációja. Hibasáv, szórás három független vizsgálattól. A statisztikai különbséget szokásos varianciaanalízissel számoltuk. PTE, pterosztilbene; TMRE, tetrametil-rodamin; ROS, reaktív oxidatív anyagok; DHR, dihidrorodamin 123; FI, fluoreszcencia intenzitás.
Az E-vitamin hatása a PTE által kiváltott oxidatív stresszre a rákos sejtvonalakban. A sejteket PTE-vel (10 μM) és/vagy E-vitaminnal (10 μM) és/vagy N-acetil-L-ciszteinnel (NAC) (5 mM) kezeltük 48 órán át. (A) A mitokondriális ROS-t a MitoROS (vörös szín) értékelte. A MitoROS képet egyesítették a fázissal kontrasztos képpel. (B) A sejtproliferációt MTS-sel értékeltük. (C) A mitokondriális ROS félkvantifikációja. C, kontroll; P, PTE; PE, PTE + E-vitamin; PN, PTE + NAC. Hibasáv, szórás három független vizsgálattól. A statisztikai különbséget szokásos varianciaanalízissel számoltuk. Méretarány, 25 μm. PTE, pterosztilbene; ROS, reaktív oxidatív anyagok; FI, fluoreszcencia intenzitás; NAC, N-acetil-L-cisztein; MTS, 3- (4,5-dimetil-tiazol-2-il) -5- (3-karboxi-metoxi-fenil) -2- (4-szulfofenil) -2H-tetrazolium.
Az (a) réz (II) és (b) cink (II) komplexek kör alakú dikroizmus (CD) spektrumai a TetraHPRG-vel vízben (pH = 7,5), a fém és a ligandum mólarányának különböző mol-ekvivalensének moláris aránya 1: 1 és 2: 1; [L] = 1 × 10 −5 M).
A TetraHPRG-vel képzett Zn 2+ komplexek fajeloszlási diagramja 0,5: 1 (M: L) moláris arány mellett. [Zn 2+] = 1 × 10-3 M.
CD spektrumok: Hka, TetraHPRG és Hka/TetraHPRG vízben (pH = 7,5), [L] = 1 × 10-5 M.
Az (a) réz (II) és (b) cink (II) komplexek CD-spektrumai Hka-val vízben (pH = 7,5), a fém különböző mol-ekvivalensével (a fém: ligandum moláris aránya 1: 1 és 2: 1; [L] = 1 × 10 −5 M).
Az (a) Hka/TetraHPRG/Cu 2+ hármas rendszer CD-különbségspektrumai mínusz a TetraHPRG/Cu 2+ rendszerek CD-spektrumai és a Hka/Cu 2+ CD-spektrumai 1: 1 fém/ligandum arányban és (b) CD a Hka/TetraHPRG/Zn 2+ terernáris rendszer különbségspektrumai mínusz a TetraHPRG/Zn 2+ rendszerek normalizált CD-spektrumai és a Hka/Zn 2+ CD-spektrumai 1: 1 fém/ligandum arányban.
ELISA vizsgálati lépések egybeesés (lefelé) és előkezelés (fel) körülmények között. HKa * (kininogén által aktivált), Me 2+ (Cu 2+ vagy Zn 2+), Av-HRP (torma-peroxidázzal konjugált avidin), TMB (3,3-5,5-tetrametil-benzidin).
A vazpin hatása a nukleáris petesejtek érésére és a progeszteron (P4) szekréciójára. A COC-kat (30/csoport/kísérlet) 100 sertésből (15 tüsző/petefészek) vett petefészkekből gyűjtött anyag morfológiai vizsgálata után választottuk ki. A sertés gomoly – petesejt komplexeket (COC) 22 vagy 44 órán át tenyésztettük érlelő közegben vazpin jelenlétében vagy hiányában (1 ng/ml), majd mechanikusan elválasztottuk oocitákra és gomoly sejtekre. A nukleáris érési szakaszokat (A) Hoechst 33342 vagy DAPI festéssel (B, D) elemeztük, míg a táptalajt összegyűjtöttük és a P4 szinteket ELISA-val (C, E) mértük. DNS-tartalom nyilakkal. A kísérleteket egymástól függetlenül hajtottuk végre, és háromszor megismételtük (n = 3). Az adatokat három független kísérlet átlagának ± SEM-nek ábrázoljuk. A kontroll és a vazpin csoport közötti jelentőséget * p p 0,01 jelzi; GV (germinális hordozó stádium), meiózis I metafázisa (meta-I), meiózis II metafázisa (meta-II).
A mitogén-aktivált kináz (MAP3/1) és az AMP-aktivált kináz (PRKAA1) bevonása a vazpin in vitro petesejt-érésre gyakorolt hatásába. A COC-kat (50/csoport/kísérlet) 100 sertésből (15 tüsző/petefészek) vett petefészkekből gyűjtött anyag morfológiai vizsgálata után választottuk ki. Sertés gomoly – petesejt komplexeket (COC) 44 órán át tenyésztettünk érlelő közegben PD98059 (100 μM), MAP3/1 kináz inhibitor vagy C vegyület (1 μM), PRKAA1 kináz inhibitor önmagában vagy vazpin (1 ng/ml) alkalmazásával. A COC-kat mechanikusan elválasztották oocita és gomoly sejtekbe, és a sejtmag érési szakaszait DAPI festéssel (A, C) elemeztük, míg a táptalajt összegyűjtöttük és a progeszteron (P4) szintet ELISA-val (B, D) mértük. A kísérleteket egymástól függetlenül hajtottuk végre, és háromszor megismételtük (n = 3). Az adatokat három független kísérlet átlagának ± SEM-nek ábrázoljuk. A statisztikai elemzést p 0,05-nél végeztük; meiózis metafázis-II (meta-II), nincs szignifikáns (ns).
A vazpin hatásának modellje a sertés petesejtjeinek in vitro érésén. A vazpin a mitogén-aktivált kináz (MAP3/1) aktiválásával és az AMP-aktivált kináz (PRKAA1) gátlásával serkenti az oocita sejtmag érését, valamint a progeszteron (P4) szekrécióját; a meiózis metafázisa (meta-II); ↑ növekedés; ↓ csökkenés.
A kiválasztott változatok Sanger-ellenőrzése. A fekete szín konzervált régiókat, a szürke és a fehér mutáns régiókat mutat.
Missense mutáció a glutation S-transzferáz fehérjében. (A) 16 Brucella glutation S-transzferáz szekvencia MSA-ja. A vörös téglalapgal jelölt 83. pozíció argininként konzervált. (B) A proszit motívumokat a glutation S-transzferáz modellszerkezetén mutatjuk be (GST-C TER piros, GST-N TER sárga). Glutation bíbor gömbökben, Arg83 zöld pálcákban. (C) A glutation S-transzferáz a konzervációnak megfelelően színeződik. Glutation bíbor gömbökben, Arg83 botokban. Ez az elemzés az Uniref90 150 homológ szekvenciáján alapul.
Missense mutáció a foszfomannomutázon belül. (A) 41 Brucella Phosphomannomutase szekvencia MSA-ja. Csak az első foszfoglukomutáz-foszfomannomutáz (PGM-PMM) van bemutatva (1–140. Szermaradék). A fekete téglalapgal jelölt Gly103 konzerválódik minden homológon keresztül. (B) A fehérje domének a glutation S-transzferáz modellszerkezetén jelennek meg (PGM-PMM-I rózsaszínben, PGM-PMM-II sötétvörösben, PGM-PMM-III vörösben, PGM-PMM-IV narancssárgában ). Glükóz-6-foszfát magenta gömbökben, katalitikus foszfo-hisztidin 104 zöld szénatomokban, Glicin 103 sárga szénatomokban. (C) A PGM/PMM a megőrzés szerint színezett. Glükóz-6-foszfát bíbor gömbökben. 103. és 104. pozíció botokban. Ez az elemzés az Uniref90 150 homológ szekvenciáján alapul.
Egész sejtes immunvizsgálat, amely bizonyítja a felszíni O-poliszacharid (O-PS) hiányát a természetes durva Brucella melitensis Rev.1 71036 és 44457 vakcinatörzsekben. A Brucella felületi O-PS értékelését egy tisztított egér anti-Brucella O-PS monoklonális antitest alkalmazásával határoztuk meg, a 3. szakaszban leírtak szerint. A B. melitensis Rev.1 Elberget (sima fenotípus) pozitív kontrollként, a B. canis-t (durva fenotípus) negatív kontrollként használtuk (**** = pt teszt).
(a) A KMT2 család tartománystruktúrája és a KMT2 komplexek központi alegységei. A számok az aminosavak számát jelzik. KMT, hiszton – lizin N-metiltranszferáz; ASH2L, hiányzik, kicsi vagy homeotikus 2-szerű; DPY30, Dumpy-30; RBBP5, retinoblastoma-kötő fehérje 5; WDR5, WD ismétlődő fehérje 5; AT-horog, adenozin-timidin-horog; CXXC, Cinkujj-CXXC domén; FYRN/FYRC, fenilalanin és tirozinban gazdag régió (N- és C-terminális); HMG, nagy mobilitású csoport; HWH, hélix-szárny-hélix domén; N-SET, a SET N-terminálja; PHD, növényi homeomain; Post-SET, a SET C-terminálja; RRM, RNS felismerési motívum; SDI, Sdc1-Dpy-30 kölcsönhatás; SET, Su (var) 3-9, a zeste fokozója és a Trithorax; SPRY, SPla és a ryanodin receptor domén; és WD ismétlés, triptofán-aszparaginsav ismétlés. (b) A KMT2 komplex felépítése. Az enzimet és a komplex mag alegységeit a diagram mutatja. Az egyes alegységek közötti kölcsönhatásokat kék vonalak jelölik. Az egyes KMT2 komplexekre jellemző alegységek, amelyeket az ábra nem mutat be, kölcsönhatásba lépnek a KMT2-ek amino-terminálisával. WIN motívum, WDR5 interakciós motívum.
COMPASS és COMPASS-szerű komplexek specializációja emlősökben. A COMPM komplexekként emlegetett KMT2F/KMT2G komplexek hasonlítanak leginkább az élesztő Set1 komplexekre. Ezek a komplexek elsősorban a tömeges H3K4me3 genom egészéért felelősek. A KMT2A/KMT2B és a KMT2C/KMT2D komplexeket COMPASS-szerűnek nevezik, és leginkább a Drosophila Trithorax komplexhez, illetve a Drosophila Trithorax-hoz kapcsolódó fehérjéhez hasonlítanak. A KMT2A/KMT2B komplexek szükségesek a H3K4 tri- és dimetilezéséhez a promóterek kevesebb mint 5% -ában, és főleg a fejlődési géneket szabályozzák. A KMT2C/KMT2D komplexek fokozókat foglalnak el és felelősek a H3K4 monometilezéséért.
A H3K4 metiltranszferáz kromatinná történő toborzásának mechanizmusai. A KMT2 komplexeket toborozzák és stabilizálják a kromatinon mechanizmusok kombinációjával: (a) kölcsönhatások szekvencia-specifikus transzkripciós faktorokkal, (b) asszociáció az alap transzkripciós géppel, (c) kölcsönhatás hosszú, nem kódoló RNS-ekkel (lncRNS-ek), (d) a hiszton-módosítás felismerése és (e) közvetlen kölcsönhatás a DNS-sel. A referenciákat lásd a szövegben.
A H3K4 metilációjának ismert írói, olvasói és törlői.
A tanulmány megtervezése. Összesen 31 vad típusú (WT) és 33 p66shc knockout (p66KO) egeret végeztek pulmonalis artéria sávozással (PAB) vagy ál műtéttel. Három héttel később az összes állatot echokardiográfiai (echo) értékelésnek vetették alá. A következő napon megvizsgálták a mitokondriális reaktív oxigénfajok (ROS) vagy a kardiomiocita (CM) működését. Az egereket további hemodinamikai (hemo) méréseknek vetettük alá, a kamrai tömeg későbbi meghatározásával.
Reprezentatív egyensúlyi állapotok az (A) kezeletlen normotenzív, transzgén-negatív Hannover Sprague-Dawley (HanSD) patkányokban, (B) HanSD patkányokban végzett nyomás-térfogat elemzésből, két héttel az utolsó doxorubicin injekció után (azaz a a kísérleti protokoll), (C) kezeletlen magas vérnyomású, Ren-2 transzgén (TGR) patkányok és (D) TGR doxorubicin beadása után. ESPVR, vég-szisztolés nyomás térfogat viszony (pontozott piros vonal). EDPVR, vég-diasztolés nyomás térfogat viszony (kék vonal).
A biológiai jelentőségű fehérjék poszttranszlációs módosításának széles skáláját bemutató vázlat.
Pillanatkép a rákos glikozilezés jellemzőiről [15].
A glikozilációs kutatások munkafolyama, nedves laboratóriumi elemzésből kiindulva - a műszeres elemzés a bioinformatikai alapú számításokba torkollik (adatelemzés).
Az angiogenezis szerepe és az érintett tényezők. Az angiogenezis segíti a tumor növekedését a tápanyagok átvitelén keresztül, de áttétjeiben is. A táblázat angiogén tényezőket mutat be, amelyek gátlókkal csökkentve megakadályozzák a tumor növekedését és az áttéteket.
Az AmOctα2R-re levezetett aminosav-szekvencia szerkezeti jellemzői. (a) Az AmOctα2R hidrofobicitási profilja. A profilt Kyte és Doolittle [36] algoritmusa szerint számítottuk, 19 aminosav ablakmérettel. Az 1,6-nál (szaggatott vonal) nagyobb pontszámú csúcsok jelzik a lehetséges transzmembrán (TM) régiókat; (b) TM tartományok előrejelzése a TMHMM szerver 2.0 verziójával [37]. A feltételezett TM domének piros színnel vannak jelölve. Az extracelluláris régiókat lila vonallal, az intracelluláris régiókat kék vonallal mutatjuk be; (c) a receptor színkódolt (szivárvány) háromdimenziós (3D) modellje, a Phyre2 előrejelzése szerint [38]. Az extracelluláris N-terminust (N) és az intracelluláris C-terminust (C) jelölik. Megjegyezzük, hogy ebben a szimulációban az AmOctα2R első 216 aminosavmaradékát kihagytuk.
Az AmOctα2R-hemagglutinin A (HA) expressziója flpTM sejtekben. (a) Az AmOctα2R-HA receptorokat expresszáló flpTM sejtek membránfehérjéinek (30 ug) Western blot-ját nem kezeltük (1. sáv), vagy PNGaseF-fel (2. sáv) kezeltük. Kontrollként 30 µg membránfehérjét a nem transzfektált flpTM sejtekből (3. sáv) nátrium-dodecil-szulfát-poliakrilamid gélelektroforézissel (SDS-PAGE) elválasztottunk és polivinilidén-difluorid (PVDF) membránra blottoltunk. A blotot patkány anti- (hemagglutinin A) HA antitesttel vizsgáltuk. (b) Ugyanazt az a) pontban leírt blotot próbáltuk meg egy antitesttel, amely a ciklikus nukleotid-kapu (CNG) csatorna C-terminusa ellen irányult. A marker fehérjék méretét kDa-ban a bal margón adjuk meg.
Az oktopamin koncentrációfüggő hatása az intracelluláris cAMP-re AmOctα2R-HA-expresszáló flpTM sejtekben. A relatív fluoreszcenciát (amely megfelel a cAMP mennyiségének) a 10 µM NKH 477 (= 100%), vízoldható forskolin analóg alkalmazásával kapott érték százalékában adjuk meg. Az összes mérést 100 µM izobutil-metil-xantin (IBMX) jelenlétében hajtottuk végre. A 10–9 M és 10–6 M közötti tartományban az AmOctα2R-HA oktopamin-aktivációja a fluoreszcencia jel koncentrációfüggő csökkenéséhez vezetett. Ezzel szemben a fluoreszcencia jel növekedését figyelték meg 3 × 10-6 M vagy annál magasabb oktopamin-koncentráció mellett. Az adatpontok a négyszeres meghatározás átlag ± SD értékét jelentik.
Az oktopamin koncentrációfüggő hatása a nem transzfektált (kontroll) flpTM sejtek relatív fluoreszcenciájára. Az oktopamin koncentráció-válasz görbéit 10 µM NKH 477 hiányában (nyitott körök) vagy jelenlétében (kitöltött körök) határoztuk meg. A relatív fluoreszcenciát a 10 μM NKH 477-gyel kapott érték százalékában adjuk meg (= 100%). Az összes mérést 100 μM IBMX jelenlétében végeztük. Mindkét körülmények között a magasabb oktopamin-koncentráció a fluoreszcencia növekedéséhez vezetett. Az adatpontok négy érték átlag ± SD értékét jelentik.
Koncentráció-válasz görbék agonisták számára intracelluláris cAMP szinten AmOctα2R-HA-expresszáló flpTM sejtekben. A relatív fluoreszcenciát (amely megfelel a cAMP mennyiségének) a 10 µM NKH 477-gyel kapott érték százalékában adjuk meg (= 100%). Az összes mérést 100 µM IBMX jelenlétében hajtottuk végre. Az adatpontok egy tipikus kísérlet négy értékének átlag ± SD értékét jelentik.
A feltételezett antagonisták hatása a tiramin-aktivált AmOctα2R-HA-ra. Az anyagok koncentrációs sorait 10 µM NKH 477, 10 µM tiramin és 100 µM IBMX jelenlétében alkalmaztuk. Az alkalmazott ligandumok a következők voltak: (a) fnetolamin, (b) epinasztin, (c) mainserin és (d) johimbin. Az adatok egy tipikus kísérlet négy értékének átlag ± SD értékét jelentik. Az összes meghatározást egymástól függetlenül megismételtük legalább háromszor.
- KARELIA ALKALMAZOTT TUDOMÁNYEGYETEM Nemzetközi üzleti szak - PDF Ingyenes
- IJAER, Nemzetközi Alkalmazott Mérnöki Kutatások Lapja, mérnöki folyóiratok, indiai
- Tengeri kábítószer-különkiadás Válogatott cikkek a 3. Nemzetközi Élettudományi Szimpóziumról
- Maria Sharapova kudarcot vallott az Australian Openen - BBC Sport
- 5 napig fotózós naplót tartottam; Ez egy szóváltás volt, de önmagában működött