Krónikus hepatitis C és májfibrózis
Levelezés: Kostas Pantopoulos, PhD, Lady Davis Orvosi Kutató Intézet, Zsidó Általános Kórház, 3755 Cote Ste-Catherine Road, Montreal, Quebec H3T 1E2, Kanada. [email protected]
Telefon: + 1-514-3408260-5293 Fax: + 1-514-3407502
Absztrakt
Alap tipp: A krónikus hepatitis C a májhoz kapcsolódó morbiditás és mortalitás vezető oka, és hajlamosítja a májfibrózist, az extracelluláris mátrixfehérjék túlzott felhalmozódását. A májfibrózis fokozatos meghatározása kritikus a betegek kezelése és előrejelzése szempontjából. Ez az áttekintés frissítést nyújt a hepatitis C vírus (HCV) epidemiológiájáról, összefoglalja a HCV-függő máj fibrogenezisének alapvető mechanizmusait, és megvitatja a májfibrózis értékelésének általános módszereit. Míg a májbiopsziát a közelmúltig tekintették aranystandardnak, az új, nem invazív módszereket, beleértve a szérum biomarkereket, a tranziens elasztográfiát és a kombinációs algoritmusokat, fokozatosan beépítik az új irányelvekbe, és az ellátás standardá válnak.
A KRÓNOS C HEPATITISZ TERHE: A SZŰRŐ DILEMMA
A krónikus hepatitis C-t (CHC) a hepatitis C vírus (HCV) okozta fertőzés okozza, és jelentős közegészségügyi problémát jelent, világszerte körülbelül 200 millió embert érint [1]. Ez a hepatocelluláris carcinoma (HCC) vezető oka és a májtranszplantáció fő indikációja a nyugati országokban. Bár egyes adatok azt jelezték, hogy a HCV nem növeli az összes okból bekövetkező halálozást [2], más tanulmányok szerint a CHC 8–12 évvel csökkentheti a várható élettartamot [3,4]. Így a HCV 2002-ben több mint 86000 halálesetet okozott Európában [5]. A CHC-nek tulajdonítható halálozás és morbiditás várhatóan drámai módon növekszik az elkövetkező 50 évben, tekintve, hogy az új HCV-fertőzések aránya csak 1989 után csökkent jelentősen [6]. Markov-modellanalízis szerint 2030-ra a HCV-vel összefüggő szövődmények miatti halálozások 30% -a megelőzhető lenne az interferon/ribavirin terápiában részesülő betegek 50% -ának növelésével [7]. Új anti-HCV szerek, köztük az NS3/4A, az NS5A és az NS5B inhibitorok kifejlesztésével a kezelés eredményességének magasabb aránya várható még cirrhosisban szenvedő vagy transzplantált betegeknél is.
Az akut HCV-fertőzés gyakran nem oldódik fel spontán módon. A fertőzöttek körülbelül 80% -a krónikus hordozóvá válik, és súlyos májbetegséggé válhat. A CHC természetes kórtörténete alapján a becslések szerint a betegek 10-20% -ánál májcirrhosis, 1% -5% -án pedig 20-30 éven belül kialakul a HCC [8]. A májcirrózis megállapítása után a HCC évente 5–7% -os ütemben fejlődik ki [9]. Fontos, hogy az epidemiológiai vizsgálatok kimutatták, hogy a betegek többsége nincs tisztában pozitív HCV antitest állapotukkal [6]. A Nemzeti Akadémiák Orvostudományi Intézetének megbízásából készített jelentés rámutatott a vírusos hepatitis gondozásának hiányosságaira, és becslések szerint a CHC-ben szenvedő betegek akár 75% -át sem diagnosztizálták [10]. Ezen a vonalon a Betegségmegelőzési és Megelőzési Központ (CDC) becslései szerint bár az 1945-1965 során született személyek az Egyesült Államok lakosságának körülbelül 27% -át teszik ki, az összes HCV-fertőzés 75% -át, a HCV-vel kapcsolatos halálozás 73% -át teszik ki., és nagyobb a HCC és a végstádiumú máj szövődményeinek kockázata.
Tekintettel arra a tényre, hogy a korai diagnózis és a kezelés megakadályozhatja a májcirrhosist és a HCC-t, úgy gondolják, hogy az 1945-1965 során született személyek (baby boom-ok) egyszeri tesztelése több mint 120000 halálesetet képes megakadályozni az Egyesült Államokban. Ezen epidemiológiai adatok és a CHC kezelésében a közelmúltban elért eredmények alapján a CDC most egy általános szűrési stratégiát javasol, egyszeri teszteléssel, anélkül, hogy előzetesen megállapítanák a HCV kockázatát a baba életkorúak számára [6]. Egy nemrégiben készült tanulmány kimutatta, hogy a HCV szélesebb körű szűrése valószínűleg költséghatékony [11]. Mindazonáltal a HCV-vel kapcsolatos morbiditás és mortalitás jelentős csökkentése szintén a beutalás, a kezelés és a nyomon követés javított arányát igényli [11]. Így, miután a CHC-ben szenvedő betegeket a HCV-fertőzés szélesebb körű szűrése alapján felismerik, megfelelő klinikai ellátást és terápiát kell felajánlani nekik. Ebben a nézetben a májfibrózis stádiumának értékelése a kulcsfontosságú esemény a CHC klinikai kezelésében, amely egyaránt befolyásolja a betegség prognózisát és a kezelési indikációt [12].
HCV- ÉS MÁJFROBRENGÉZIS: ALAPFOGALMAK
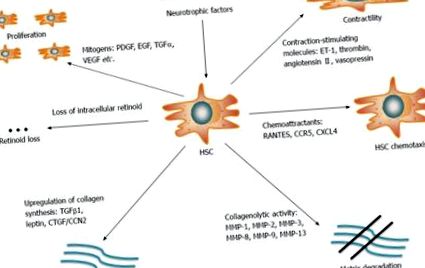
A máj fibrogenezisének hátterében álló mechanizmusok tisztázása kiemelt fontosságú a végstádiumú májbetegség kezelésében és megelőzésében. A májfibrózist az extracelluláris mátrix (ECM) fehérjék, például kollagén, laminin, elasztin, fibronektin stb. Túlzott felhalmozódása határozza meg, és jelenleg a krónikus májkárosodás sebgyógyulási válaszának tekintik [13]. A HCV-fertőzés közvetlenül modulálja a vírusfehérjék szignalizációs és metabolikus útjait. Ezenkívül közvetetten indukálja a gazdaszervezet vírusellenes immunválaszát, amely krónikus gyulladáshoz vezet. Ezek az események együttesen elősegítik a máj fibrogenezisét [14]. A máj stellate sejt (HSC), egy A-vitamint (retinoid) tároló sejt, amely a Disse perisinusoidális terében található, a legfontosabb fibrogenetikai elem. Noha gyulladásos ingerek hiányában nyugalomban vannak, a HSC-k a májkárosodás hatására aktiválódnak, és proliferatív, kontraktilis miofibroblasztokká alakulnak át. Az aktivált HSC-k az ECM termelésének elterjedt forrását képezik [15], és ezáltal megzavarják az egyensúlyt az ECM fehérjék lerakódása és oldódása között, ami fibrotikus hegesedéshez és végül májcirrózishoz vezet (1. ábra).
A májcsillagsejtek retinoidot tároló sejtek, amelyek kulcsfontosságú szerepet játszanak a máj fibrogenezisében. A májkárosodás során nyugalmi állapotból átalakulnak proliferatív, kontraktilis miofibroblasztokká. Az aktivált HSC-k jelentik a fő forrást a kollagén és más ECM-fehérjék előállítására. Számos molekula és út szabályozza az egyensúlyt az ECM fehérjék lerakódása és lebomlása között. HSC-k: Májcsillagsejtek; ECM: Extracelluláris mátrix; PDGF: Trombocita eredetű növekedési faktor; EGF: epidermális növekedési faktor; TGF: Transzformáló növekedési faktor; VEGF: vaszkuláris endoteliális növekedési faktor; CCR5: C-C kemokin receptor 5; MMP-2: Mátrix metalloproteináz 2.
A HCV-fertőzés és a májkárosodás fő szempontjait összefoglaló sejttenyészet és állatmodellek kifejlesztése döntő fontosságú volt a CHC patogenezisének megértése szempontjából [16,17]. Ez olyan utakat foglal magában, amelyek részt vesznek a HSC aktiválásának megindításában és folytatásában. A HSC-aktiváció megindítását a szomszédos sejtek parakrin ingerei, reaktív oxigénfajok (ROS), lipopoliszacharidok (LPS) vagy apoptotikus testek közvetítik. A HSC-k fibrogenetikus, proliferatív, kemotaktikus és gyulladásos szignálokra reagálva fenntartják aktivitásukat [14].
Közvetlen HCV-függő májfibrogenezis vírusfehérjék által
A HCV pozitív egyszálú RNS-t tartalmaz, amely egy nagy poliprotein prekurzorrá transzlálódik. Ez utóbbi vírusos és gazda enzimek révén proteolitikus hasításon megy keresztül érett strukturális fehérjék (mag, E1, E2 és p7) és nem strukturális fehérjék (NS2, NS3, NS4A, NS4B, NS5A és NS5B) előállítása érdekében [18]. Ezek a molekulák több sejttípust is megcélozhatnak, beleértve a hepatocitákat, monocitákat, limfocitákat és különféle szekréciós sejteket [19-21], és ezáltal modulálhatják a sejtek proliferációját, az apoptózist, az oxidatív stresszt és a veleszületett immunitást [22].
Kísérleti bizonyítékok arra utalnak, hogy a HCV magfehérje, valamint a nem strukturális HCV fehérjék közvetlenül kiválthatják a HSC aktiválását és ezáltal a fibrogenezis beindítását. A magfehérje előnyösen aktiválja a pro-mitogén intracelluláris utakat a HSC-kben, míg az NS3 és NS5 fehérjék specifikusan stimulálják a gyulladásgátló utakat az NF-κB és JNK révén [23]. A mag- és NS3-fehérjék elősegítik az intracelluláris kalcium [Ca 2+] i és ROS szint növekedését; a magfehérje hatása attól függ, hogy kötődik-e a C1q receptorhoz [23]. Az oszteopontin kalcium- és ROS-szignalizációval történő indukciója hozzájárul a hepatociták epitheliális és mesenchymális átmenetéhez [24]. A HCV burok E2 glikoproteinje egy másik potenciális fibrogenetikai tényező. Elősegíti a mátrix metalloproteináz 2 (MMP-2) aktiválódását a HSC-k CD81-hez való kötődése esetén, ami a normál ECM lebomlását eredményezi a magas HCV sűrűségű területeken, és a gyulladásos sejtek beszivárgásához vezethet [25].
Azt is meg kell jegyezni, hogy a mag, az NS3 és az NS5A fehérjék oxidatív stresszt indukálnak a hepatocitákban és monocitákban a NADPH-oxidáz aktiválásával [26-28] és a hem-oxigenáz 1 (HO-1) visszaszorításával [29]. Ezenkívül a mag és az NS3 fehérjék aktiválják a gyulladásos útvonalakat a monocitákban lévő Toll-szerű receptor 2 (TLR2) révén, amelyek modulálják a veleszületett immunitást [30]. Ezenkívül a HCV replikon modelljeivel végzett vizsgálatok bebizonyították az oxidatív stressz indukcióját és a transzformáló β1 növekedési faktor (TGFβ1) és más pro-fibrotikus jelek aktiválódását a HCV replikációjára reagálva [31,32].
Közvetett HCV-függő májfibrogenezis immunválaszokon és más utakon keresztül
A HCV-fertőzésre adott immunválasz kulcsfontosságú szerepet játszik a máj fibrogenezisének fokozásában. Több növekedési faktor, gyulladásos citokinek és kemokinek szabályozhatják a HSC-k aktiválódását és azok átalakulását miofibroblasztokká [33]. Különösen a trombocita eredetű növekedési faktor (PDGF) immun által elősegített indukciója és az ezt követő intracelluláris kalcium mobilizálása okoz mitogén hatásokat a HSC-k számára [34,35]. A Kupffer-sejtekből származó transzformáló növekedési faktor α (TGFα) [36] és az epehéj növekedési faktor (EGF) receptor epesav által indukált aktivációja [37] elősegíti a HSC-k szaporodását. Ezenkívül a vaszkuláris endoteliális növekedési faktor (VEGF) indukciója hozzájárul a HSC-k aktiválásához és proliferációjához, valamint a máj angiogeneziséhez, ezzel a molekulával a fibrogén folyamat kulcseleme. [38].
A proliferatív tényezők mellett az ECM termelést elősegítő fibrogén citokinek pozitívan szabályozottak a HCV fertőzésre adott immunválasz összefüggésében. A TGFβ1 a leghatékonyabb pro-fibrotikus citokin, amely Smad-jelzéssel stimulálja a kollagéntermelést [39,40]. Ezenkívül további molekulák, például a kötőszöveti növekedési faktor (CTGF/CCN2) [41] és az adipokin-leptin [42] elősegítik a máj fibrogenezisét a TGFβ1 jelátvitel útján. A leptin fibrogén aktivitását részben a TGFβ1 közvetíti, és további Kupffer sejtből származó ingerekre van szükség [43]. A leptin a peroxiszóma proliferátor által aktivált γ (PPARγ) receptor szuppresszoraként is működik, amely egy anti-fibrotikus magreceptor, amely képes eltörölni a HSC aktiválását és megőrizni annak nyugalmát [44].
A kemokinek fokozzák a fibrogenezist a fibrogén sejtek kemotaxisán és a gyulladásos válasz amplifikálásán keresztül. A HSC-k számos receptort termelnek, és számos citokint titkolnak [45]; szerepüket a fibrogenezis patofiziológiájában jelenleg vizsgálják. A legújabb bizonyítékok arra utalnak, hogy a C-C kemokin-ligandum 5 (CCL5, más néven RANTES) indukciója az NF-κB jelátviteli úton elősegíti a HSC-k kemotaktikus és mitogén hatásait a C-C kemokin-receptor 5 (CCR5) révén [46]. Ezenkívül a thrombocyta eredetű kemokin (C-X-C motívum) 9. ligandum (CXCL9) anti-fibrotikus tulajdonságokkal rendelkezik, amelyek a CXCR3 receptorától függenek [47], míg a CXCL4 pro-fibrotikus funkciót tölt be [48].
A neurokémiai és neurotróf faktorok szintén fokozhatják a HSC-k fibrogenetikai funkcióját. A krónikus májkárosodásra reagálva a neuroendokrin rendszer számos sejtpályája aktiválódik. Az opioid szignalizáció indukálása endogén opioidokkal stimulálja a HSC-k proliferációját és fokozza a kollagén lerakódását [49]. Hasonló vonalak mentén a CB1 receptor aktiválása HSC eredetű kannabinoidokkal [50], a HSC-k szerotoninnal történő PDGF jelátvitelének javítása [51] és a pajzsmirigyhormonok általi HSC aktiváció [52] elősegíti a fibrogenetikus utakat.
A HSC-k közvetlen kölcsönhatása az immunsejtekkel, az adhéziós molekulák expresszióján keresztül, kétirányú sejtstimulációt és a fibrózis amplifikációját eredményezi. Az α tumor nekrózis faktor és a monocita kemoattraktáns 1 fehérje (MCP-1), valamint más gyulladáscsökkentő citokinek mellett a Kupffer-sejtek szekretálódnak az NF-κB aktivációra válaszul [53]. Ez ismét HSC-k aktiválódását és a gyulladásos folyamatot felerősítő és a makrofág-aktivitást örökítő tényezők szekrécióját eredményezi, mint például a makrofág kolóniastimuláló faktor [54], interleukin 6 [55], MCP-1 [56] és RANTES [ 46]. Ezenkívül a HSC-k expresszálják a sejtadhéziós molekulákat, beleértve az 1. vaszkuláris sejtadhéziós molekulát [57] és az 1. intracelluláris adhéziós molekulát [58]. Ezek részt vesznek a gyulladásos sejtek további toborzásában a sérülés helyén, ami fokozza a fibrogenetikai folyamatot. A fibrózis progressziójában szerepet játszó egyéb sejttípusok közé tartoznak a limfociták [59], a makrofágok [60] és az endoteliális sejtek [61]. A makrofágok elősegítik az aktivált HSC túlélését NF-κB-függő utakon keresztül [62]. Ezzel szemben a HCV-fertőzött betegek természetes gyilkos sejtjei és T-sejtjei elősegítik a HSC-k apoptózisát, és ezáltal anti-fibrotikus funkciót gyakorolnak [63].
Végül, de nem utolsósorban az oxidatív stressz a májfibrózis kulcsfontosságú eleme [64]. Az apoptotikus parenchimasejteket aktivált HSC-k fagocitálják, ami a NADPH-oxidáz aktiválódását eredményezi [65]. Ez utóbbi a ROS generálását közvetíti, amelyek képesek mind a fibrózis elindítására, mind állandósítására a HSC-k, hepatociták, Kupffer-sejtek és gyulladásos sejtek aktiválásával [66]. Ezt a folyamatot tovább fokozzák többszörösen telítetlen zsírsavak, etanol és vas jelenlétében. Ezenkívül az apoptotikus hepatociták DNS-e kölcsönhatásba léphet a HSC-k TLR9-jével, és ezáltal fokozhatja a kollagéntermelést és a lerakódást [67].
Enyhe vagy közepesen súlyos máj túlterhelés a CHC-betegek gyakori megnyilvánulása. Ez nagyrészt a vas szabályozó hormon hepcidin [68,69] szabályozatlanságának tudható be, amelyet transzkripciósan gátol a HCV által kiváltott oxidatív stressz [70]. Annak ellenére, hogy a vas antagonizálja a HCV replikációt az NS5B víruspolimeráz [71,72] inaktiválásával, a máj vasfelhalmozódása [73], az emelkedett szérum ferritinszint [74] vagy a csökkent szérum hepcidinszint [75] összefügg a májbetegség progressziójával. A HFE hemokromatózis fehérje, amely egy atipikus fő hisztokompatibilitási komplex I. osztályú molekula, szintén hozzájárulhat a máj fibrogeneziséhez, mint a hepcidin upstream szabályozója és/vagy lehetséges immunológiai faktor [76,77].
A MÁJFBROZIS HATÁSA A PROGNÓZISRA, A KEZELÉSRE ÉS A SZŰRÉSRE VONATKOZÓ STRATÉGIÁKRA
A májfibrózis felhalmozódása jelentős esemény, amely jelentős következményekkel jár a CHC patológiájának fejlődésében [78]. Jelzi a progresszív betegség kialakulását, amely végül cirrhosishoz és végstádiumú máj szövődményekhez vezethet [79]. A diagnózis hiányában hiányzó vagy enyhe fibrózisban szenvedő betegeknél a következő 20 évben viszonylag alacsony a kockázata a cirrhosis kialakulásának (25% -30%). A portális és a septumfibrózis egyaránt cirrhózist okoz, bár különböző progressziós arányokkal (18-20 év a portális fibrózisban szenvedő betegeknél és 8-10 év a septum fibrózisos betegeknél) [80]. Így a májfibrózis szakasza kritikus a klinikai kezelés szempontjából, különösen a HCV-fertőzött betegek új szűrési hullámának fényében [6].
A CHC-betegek klinikai kezelése a májfibrózis két különböző stádiumától függ [81]: (1) jelentős fibrózis, amelyet szövettanilag septumfibrózisnak minősítenek (a METAVIR F3 stádiumban van), végleges indikációt jelent az antivirális kezelés ütemezésére, nem pedig elhalasztására; és (2) a cirrhosis (a METAVIR F4 stádiuma) specifikus és rendszeres nyomon követést tesz szükségessé, amelynek tartalmaznia kell a HCC és a nyelőcső-varikumok szűrését. A vírusellenes kezelés indikációjától eltekintve, egy előrehaladottabb májfibrózisos stádiumnak beavatkozást kell igényelnie az ismert negatív kofaktorok betegség progressziójának szabályozására (1. táblázat). Ide tartoznak az életmód módosítása (étrend, fogyás, rendszeres testmozgás), az alkohol- és drogmegtartóztatás, a szakorvosokhoz (hepatológus, anyagcsere klinikák, dietetikus, pszichológus) történő beutalás, specifikus gyógyszerek (sztatinok, inzulinérzékenyítők). Így az új szűrővizsgálati stratégiákat, amelyek a személyek nagy csoportja, a baby boom-osok számára nyitnak, diagnosztikai és terápiás beavatkozásokkal kell összekapcsolni minden újonnan azonosított beteg előtt.
Asztal 1
A fibrózis progressziójához hozzájáruló tényezők krónikus hepatitis C esetén
- A vér mikrobiotájának változásai elhízott májfibrózis esetén
- Az FDA jóváhagyja a Zepatiert az krónikus hepatitis C 1. és 4. genotípusának kezelésére
- Elhízott betegek májfibrózisával összefüggő változásai a vér mikrobiota profiljában
- Cisztás fibrózis Májbetegség Riley Gyermekek egészsége
- Harvoni hatása a proteinuriára és az eGFR-re a hepatitis C vírussal összefüggő krónikus vesebetegségben