A stoppos útmutató a PGC-1α izoformszerkezethez és biológiai funkciókhoz
Absztrakt
A peroxiszóma-proliferátor-aktivált receptor γ (PPARγ) 1-es koaktivátor (PGC-1) transzkripciós koaktivátor családjának fehérjéi számos szövetben koordinálják a fiziológiai adaptációkat, általában válaszul a magasabb tápanyag- és energiaellátás igényére. A család alapító tagjai közül, PGC-1a (más néven PPARGC1A) a legmagasabb szintű szabályozású gén, amely több promotert és alternatív splicelést használ egyre növekvő számú koaktivátor variáns előállításához. PGC-1a a promóterek szelektíven aktívak a különféle szövetekben, válaszul a specifikus ingerekre. A mai napig több mint tíz új PGC-1α izoformát expresszáltak egy új promóterből (PGC-1α-b, PGC-1α-c), alternatív splicing (NT-PGC-1α) vagy mindkettő (PGC) -1a2, PGC-1a3, PGC-1a4). A kapott fehérjék differenciális szabályozást és szöveteloszlást mutatnak, és ami a legfontosabb, specifikus biológiai funkciókat töltenek be. Ebben az áttekintésben az új PGC-1α izoformák szerkezeti és funkcionális jellemzőit tárgyaljuk, azzal a céllal, hogy integratív képet nyújtsunk a transzkripciós koaktivátorok ezen folyamatosan bővülő rendszeréről.
Bevezetés
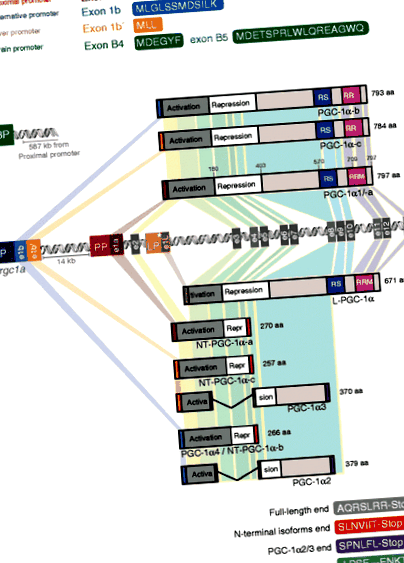
A PGC-1α izoformszerkezet és transzkripciós origó. Transzkripciót indítottunk az AP upstream alternatív promóterétől (AP) Pgc-1α a gén új 1b vagy 1b ′ exonok (e1b, e1b ′) beiktatását eredményezi. Ezek két különálló N-véget kódolnak (kék és narancssárga aa szekvencia), amelyek különböznek a kanonikus 1a exontól (e1a; aa szekvencia barna), amely a proximális promotert (PP) követi. Az intronban 2 (LP) található további promóter szabályozza az emberi máj májváltozatának expresszióját, amely magában foglalja az új 1L exont (e1L). Az agy-specifikus PGC-1a izoformák halmaza expresszálódik egy promóter régió (BP) irányítása alatt, amely 581 kb-rel helyezkedik el az e1a-tól szemben. Három különböző illesztési lehetőségből származó C-terminális aminosav-szekvenciákat mutatunk be. * Magasan konzervált emlősökben; csak az emberi szövetekben észlelt átiratokat
PGC-1: találkozz a szülőkkel
Hol kezdjük? Több origó a PGC-1α átírásokhoz
A PGC-1a-b és a PGC-1a-c csak N-terminálisukban különbözik, míg a fehérje többi része azonos a kanonikus PGC-1a1-gyel. Ezzel párhuzamosan két másik transzkriptumot azonosítottak, amelyek tartalmazzák az 1b hosszú és rövid exont, amelyek az Pgc-1α2 és Pgc-1α3, de elsődleges szerkezetüket ebben a tanulmányban nem vizsgálták [33]. Nómenklatúrájukkal összhangban a kanonikus izoformát átnevezték Pgc-1α1. Az alternatív gén promoter a fajok között nagyon konzervált, és kimutatták, hogy aktív az emberi vázizomzatban [34–36]. Ennek megfelelően az új PGC-1α izoformákat a vázizomzatban kimutatják edzés után [35–37].
Ezek az első vizsgálatok azt mutatták, hogy a proximális Pgc-1α gén promoter, honnan Pgc-1α1 expresszálódik, úgy tűnik, hogy magasabb az alap expressziója, míg az alternatív promoter jobban reagál a stimulációra. Valójában a fizikai testmozgás vagy a hideg expozíció a vázizomzatban (illetve a BAT-ban) promóter-aktivitás elmozdulást indukál az upstream TSS felé, elősegítve az új PGC-1α izoformák expresszióját [32, 33]. Ez az alternatíva Pgc-1α a gén promoter nagyon reagál a β-adrenerg stimulációra, mind BAT-ban, mind vázizmokban. Ezzel összhangban a klenbuterollal (β2-adrenerg agonistával) kezelt egerek az új PGC-1α izoformák expressziós szintjét hasonlítják össze a testedzéssel kiváltott szintekkel. Ezzel szemben a β2-adrenerg antagonista ICI-118 551 tompul Pgc-1a-b és Pgc-1a-c fizikai gyakorlással történő indukció [32], míg a nem szelektív β-blokkoló propranolol jelentősen csökkenti az izom nagyságát Pgc-1α indukció önkéntes futással [33].
A PGC-1α-b és a PGC-1α-c szerkezete vagy funkciója szempontjából nem különbözik szignifikánsan a PGC-1a1-től (azaz a PGC-1a-a). Például a PGC-1α1-hez hasonlóan koaktiválják a PPAR magreceptorokat [32], és mindezek a fehérjék olyan transzkripciós programokat szabályoznak, amelyek a vázizomzatban végzett állóképességi edzés néhány hatását kiváltják, elősegítve a mitokondriális biogenezist, a zsírsavoxidációt [32] és az angiogenezist [38]. ] (2. ábra). Chinsomboon és munkatársai megfigyelték a testmozgás által közvetített indukciót Pgc-1α2 és Pgc-1α3 a vaszkuláris endoteliális növekedési faktor (VEGF) expressziójához és az angiogenezis elősegítéséhez kapcsolódik ösztrogénnel kapcsolatos receptor (ERR) α-függő módon [33]. További jellemzése a Pgc-1a-b a vázizom-specifikus transzgénikus egérmodellből kiderült, hogy a javult oxidatív kapacitás és a testmozgás teljesítménye közvetlenül összefügg a mitokondriális térfogattal, nem pedig a megnövekedett mitokondriális funkcióval [38]. Pgc-1a-b koplalás után patkány kardiomiocitákban is kimutatták ezt az eseményt, amely a cAMP jelzésétől függ [39].
A PGC-1α izoformák átfedésben vannak és specifikus biológiai aktivitással rendelkeznek
PGC-1α izoformák: ABC, L/B, NT és 2, 3, 4
L (iver) - és B (eső) -PGC-1α
Az újszerű upstream alternatíva mellett PGC-1a gén promoter [32, 33], más TSS-eket írtak le az ember számára PGC-1a gén [40, 41]. Az egyik webhely a PGC-1a gén, és annak ellenére, hogy erősen konzervált régióban van, úgy tűnik, hogy csak az emberi éhomi májban alkalmazzák [40]. A kapott átirat, L-PGC-1a, kódolja az új 1L exont, amely a 3. exonhoz illeszkedik, majd a kanonikát követi PGC-1a átirat szekvencia (1. ábra). Mivel az L-PGC-1α kezdőkodonja most a 3. exonban található, ennek a fehérjének hiányzik a PGC-1a1 első 127 aa-ja (amelyet az 1., 2. és a 3. exon kódol). Ennek következtében hiányzik az L-PGC-1α-ból az aktivációs domén első LXXLL motívuma, amely megkönnyíti az SRC-1/p300 toborzását, és a GCN5 interakciós régió (a PGC-1α1 aa 1–97). Mivel az L-PGC-1α fenntartja a C-terminális NLS-t, a fehérje a magban lokalizálódik, ahol koaktiválja a PPARα-t, a PPARγ-t és a hepatocita 4α nukleáris faktort (HNF4α), de nem a máj X receptor α-t (LXRα) [40]. A PGC-1α1-hez hasonlóan az L-PGC-1α a glükokortikoidokra és a cAMP-re reagálva indukálódik. Érdekes megjegyezni, hogy az aa 1–127 hiánya mindkét transzláció utáni módosítást befolyásolhatja, pl. acetilezés, valamint kölcsönhatások más transzkripciós faktorokkal.
Ugyanezen csoport későbbi munkája azonosított egy másik TSS-t, amely 587 kb-rel volt az áramlási irány előtt PGC-1a exon 2, amely számos agy-specifikus izoformát képes előállítani [41]. Az emberi agyban ezek az új átiratok bőségesebbnek tűnnek, mint a kanonikusak PGC-1a1 és számos változó hosszúságú izoformát kódolnak, amelyeket megerősítettek a transzkriptum szintjén az emberi agymintákban és a fehérje szintjén egy SH-SY5Y neuroblasztóma sejtvonalban [41]. Ezek az átiratok tartalmazzák a B1-5 új exonokat, amelyek a 2. kanonikus exon előtt helyezkednek el. Ezen transzkriptumok többsége magában foglalja a B1 exont, amelyet a B4 és/vagy B5 követ, majd a 2–13. Exonokat [41]. Azt, hogy az agy-specifikus izoformák funkcionális aktivációs doménekkel rendelkeznek-e, még meg kell határozni. Érdekes módon az újonnan azonosított promóter, amely közvetíti ezen agy transzkripcióját PGC-1a az izoformák a Huntington-kór megjelenésének életkorával járó genomi régióban találhatók [41], amely betegség megváltozott PGC-1α funkcióval függ össze [42–44].
NT (erminal) -PGC-1a
Noha az NT-PGC-1α fehérjékből hiányzik a C-terminális domén, amely a PGC-1α1-ben szükséges a mediátor komplexummal való interakcióhoz [9], mégis koaktiválják a PPARα és a PPARγ transzkripciós aktivitást [45]. Ez az asszociáció azonban szigorúan ligandumfüggő, valószínűleg azért, mert az NT-PGC-1α-ból hiányoznak azok az aminosav-szekvenciák, amelyek a PGC-1α1-ben a PPAR-k ligandfüggetlen koaktivációját közvetítik (aa 338–403 a PGC-1α1-ben) [48]. A C-terminális domének hiánya rezisztenssé teszi az NT-PGC-1α fehérjéket a Twist-1 által közvetített gátlás ellen a barna adipocitákban [49]. Ez arra utal, hogy a PGC-1α1-től eltérően az NT-PGC-1α nem célozható meg a Twist-1 által közvetített negatív visszacsatolási hurokkal [50].
Az NT-PGC-1a-a biológiai aktivitása jelentősen átfedésben van a PGC-1a1 aktivitásával. Valójában az NT-PGC-1α-a vagy a PGC-1α1 expressziója differenciált barna adipocitákban hasonló génprogramokat vezérel, fokozott mitokondriális biogenezissel (2. ábra) és megnövekedett karnitin-palmitoil-transzferáz-1b-vel (CPT-1b) és szétkapcsolva az 1-es fehérjét (UCP1). ) kifejezés [45]. NT-Pgc-1a-a az expressziót edzés indítja el, nem függ a β-adrenerg ingerléstől, és elősegíti a klasszikus oxidatív fenotípust a C2C12 sejtekben [47]. Ennek megfelelően a NT-Pgc-1a-a közelebb áll a Pgc-1α1 és különbözik az alternatív gén-promótertől átírt izoformáktól. NT-Pgc-1a több szövetben megtalálható, és különösen bőséges az egér agyában [45]. NT-Pgc-1a-a és Pgc-1α1 (emberben az L-PGC-1α-val együtt) az egyetlen izoform, amelyről beszámoltak az éhomi májban történő indukcióról (2. ábra).
PGC-1α2, -α3 és -α4
A vázizomzat koaktivátorainak PGC-1α rendszerében bekövetkező változások áthaladhatnak más szövetekkel, és szisztémás hatást fejthetnek ki. Számos friss jelentés azt mutatja, hogy a specifikus PGC-1α izoformák megemelkedése a vázizomban a keringő faktorok (miokinek) szekréciójával más szövetekre is hatással lehet. Az irizin és a β-aminoizo-vajsav (BAIBA) [52, 53], mind a PGC-1α1, mind a PGC-1α4 által szabályozott mioztatin és a meteorin-szerű fehérje irányítása alatt [54, 55], mind a vázizom szignáljait juttatják el a zsírszövetbe . Így a PGC-1α1 vagy a PGC-1α4 vázizomzatának túlexpressziója a zsírszövet megbarnulását eredményezi, bár ezt az egyes izoformákra jellemző különféle utak és mechanizmusok révén érik el.
Nemrégiben feltártunk egy olyan mechanizmust, amely révén a vázizom PGC-1α1 aktivációja megvédheti a stressz okozta depressziót. Ezt az izom és az agy közötti áthallást nem a miokinek szekréciója közvetíti, hanem a triptofán-kinurenin-metabolit vázizomzatának méregtelenítése, amely az agyban történő felhalmozódásakor neuroinflammációhoz és depresszióhoz kapcsolódik [56].
Kihívások és perspektívák
Melyik promótert kell népszerűsíteni?
Az egyik sürgető kérdés a PGC-1α izoform expresszióval kapcsolatban az, hogy a sejtek hogyan szabályozzák specifikusan a különbözőt Pgc-1α gén promoterek? Hogyan diktálják a specifikus ingerek, melyik promoter aktiválódik? Hideg expozíció esetén a BAT egyértelműen áttér a preferenciára a proximálisról az alternatívára Pgc-1α promóter és minden indukált izoform, akár teljes hosszúságú, akár spliccelve, tartalmazza az új 1b exont [32, 45, 46]. Ennek a specifikus szabályozásnak a biológiai jelentése továbbra is megfoghatatlan, mivel a különböző PGC-1α izoformák BAT-ban való expressziója nem tűnik differenciált biológiai funkciónak, és a promóter eredetétől vagy a splicing választástól függetlenül úgy tűnik, hogy mind a mitokondriális termogenezis programot hajtják végre.
A promóter választása és a PGC-1α izoform expressziója a vázizomzatban is szabályozott. A 14 kb-os upstream alternatíva Pgc-1α A génpromóter nagyon érzékeny a stimulációra, és a legtöbb testmozgási beavatkozás, a magas intenzitástól az alacsony intenzitású állóképességig [57] a rezisztencia edzésig [36], bizonyos mértékig aktiválni látszik. Úgy tűnik, hogy a klasszikus proximális promoter kevésbé indukálható, de következetesen reagál a nagy intenzitású állóképességi gyakorlatokra [57] vagy a szabadonfutó futásra [33, 58]. A testedzett állatok β-adrenerg antagonistával történő előkezelése károsítja Pgc-1a-b és Pgc-1a-c indukció, de nem befolyásolja a Pgc-1α1 [32]. Valójában a β2-adrenerg agonista clenbuterol in vivo beadása indukálja az új promóterből származó összes izoformát, miközben visszaszorítja. Pgc-1α1 kifejezés (V. Martínez-Redondo, J. L. Ruas, publikálatlan megfigyelés). Ez a váltás a PGC-1α4 által közvetített izom hipertrófiát adja az egyéb alternatív izoformák által kiváltott bioenergetikai hatásokhoz. Ezen mechanizmusok szabályozásának megértése lehetővé teszi az egyes specifikus utak terápiás célzását.
Technikai szempontok a PGC-1α izoformák kimutatásához
Annak ellenére, hogy a szekvencia konzervációja az egész régióban megfigyelhető Pgc-1α gén régióban, nem minden izoformája expresszálódik minden fajban. Ez a helyzet az L-PGC-1α izoformával, amelyet csak az emberi szövetekben mutattak ki [40, 41]. Tudomásunk szerint egyetlen rendelkezésre álló adatbázis sem tartalmaz átfogó információt az összes leírt PGC-1α izoformáról. Az ember számára PGC-1a izoformák, az Ensembl (www.ensembl.org) (ENSG00000109819) bejegyzéseket tartalmaz a PGC-1a1 (001), NT-7a (homológ az egérrel NT-Pgc-1a-a) (007), agy-specifikus izoform 8a (008) és L-PGC-1a (202), amelyek az Uniprot (www.uniprot.org) fehérje adatbázishoz (Q9UBK2 bejegyzés) kapcsolódnak, mint 1., NT-7a, 8a és 9. izoformák. Ugyanebben a bejegyzésben más emberi agyi B5, B4, B4-8a, B5-NT és B4-3ext izoformákat is dokumentálnak (mint a 3–7 izoformák). Az egér változatoknál csak izoformák Pgc-1α1 (001), NT-Pgc-1a-a (002) és Pgc-1α4 (003) megtalálható az Ensemblben (ENSMUSG00000029167), míg az Uniprot-ban (O70343 bejegyzés) a PGC-1α1, -α2, -α3 és -α4 izoformák mind dokumentálva vannak. Az NT-PGC-1a-a fehérjeszekvenciája a Q3LIG2 bejegyzésben található.
Amint a PGC-1α-ra leírt variánsok száma növekszik, nagy jelentőségű lenne megegyezni egy egységes, szisztematikus és nem leíró nómenklatúrában.
Személyre szabott edzés a PGC-1-ek számára
Egy másik vita tárgya az, hogy a különféle edzéstípusok külön szabályozzák-e Pgc-1α promoter aktiváció és izoform expresszió. Alternatív promoter eredetű Pgc-1α4, amely az izom hipertrófiáját hajtja, csak olyan ellenálló képességet tartalmazó edzésprogramok indukálják, míg kifejeződését a 8 hetes aerob kerékpározás nem befolyásolja [36]. Ezenkívül egy 12 hetes progresszív súlyemelő program kifejezetten izoformákat indukál Pgc-1α2, Pgc-1α3 és Pgc-1α4 a regény promóterétől [37]. Más kutatások azonban azt mutatják, hogy mindkét promoter aktiválható a testmozgástól függetlenül [60, 61]. A PGC-1α izoform expressziós mintázatok eltérő időbeli dinamikát mutatnak [55], és amíg meg nem értjük a különböző expressziós profilok mögött álló mechanizmusokat, fontos egyesíteni a kísérleti eljárásokat, mint például a testmozgás, a mintavétel és a génexpresszió-elemzési technikák. Az emberi önkéntesekkel végzett edzéses vizsgálatok egyik gyakori eredménye, hogy az egyidejű edzésprogramok, mind állóképességi, mind rezisztencia-összetevőkkel, szinergikusan hatnak az összes PGC-1α izoformák expressziójára, bár az alternatív promóterre gyakorolt hatása hangsúlyosabb.
Az ellenállást gyakorló edzésprotokollokat nehéz rágcsálókká lefordítani, ezért különböző kísérleti protokollokat alkalmaznak a vázizom hipertrófiájának kiváltására. A hátsó szár felfüggesztése – újratöltő modellje [62] segítségével specifikus indukciót láthattunk Pgc-1α4 és az ezzel járó elnyomás Pgc-1α1 az újratöltési/hipertrófiás szakaszban [36]. Ugyanebben a tanulmányban bebizonyítottuk, hogy a PGC-1α4 elegendő a vázizom hipertrófiájának kiváltására. Egy másik csoport beszámolt arról, hogy azok az egerek, amelyeknél az összes (ismert) PGC-1α fehérje nem expresszálódik a vázizomzatban, még mindig a szinergikus ablációs modell által kiváltott hipertrófián esik át [63]. Nem zárhatjuk ki további izoformák létezését, amelyek figyelembe vehetik ezeket a sajátos hatásokat, vagy kompenzációs mechanizmusokat a Pgc-1α gén az embrionális állapot óta. Amíg nem rendelkezünk a megfelelő egérgenetikai modellekkel a PGC-1α izoformára jellemző funkciónyereségről és -vesztésről, addig nehéz meghatározni az egyes fehérjék in vivo hozzájárulását a PGC-1α aktiváció általános hatásaihoz.
Összefoglalva, a jövőbeni tanulmányoknak meg kell vizsgálniuk a PGC-1α variánsok szabályozásának és kölcsönhatásának mechanizmusait a különböző szövetekben és fiziológiai kontextusban. Végül szeretnénk kiemelni a szisztematikusabb nómenklatúra fontosságát a transzkripciós koaktivátorok folyamatosan bővülő PGC-1α rendszere szempontjából.
- A nagyobb ember útmutatója a fogyáshoz
- Az UCSF Útmutató az egészséges és boldog táplálkozáshoz UC San Francisco
- A végső útmutató a CBD-hez és az idősek számára a fogyásért Egy ütő Detroit Detroit Metro Times
- A keleti kelbimbó végső útmutatója - Karcsú konyha
- A végső útmutató a saját fogyás sikertörténetévé - Sworkit At Home Workout és