Lichenin
Kapcsolódó kifejezések:
- Poliszacharid
- Poliszacharidok
- Glükán
- Enzimatikus hidrolízis
- Megfagyás
- Gabona
- Zab
- Árpa
- Cetraria islandica
Letöltés PDF formátumban
Erről az oldalról
A β-glükánok kémiája
1.H.4.a Lichen (1,3; 1,4) -β-glükánok
Az (1,3; 1,4) -β-glükán-lichenin forró vízzel extrahálható az izlandi moha (Cetraria islandica) lepkeiből. A glükán a mikobiont sejtfalaiban található (Honegger és Haisch, 2001). A gabona társaival összehasonlítva a lichenin sokkal nagyobb arányú tri-/tetra-szacharid-építő egységeket tartalmaz (lásd a 2. táblázatot), bár e két oligoszacharid tartalma csak 75%, szemben a gabona-glükánok> 90% -ával; a DP 5–14 sejt-oligoszacharidok a molekula 22% -át teszik ki.
Lichenin-szerű poliszacharidokról számos más zuzmóról számoltak be (Stone és Clarke, 1992; Carbonero és mtsai, 2001, 2002, 2005, 2006).
Az (1,3; 1,4) -β-glükánok eloszlása, finom szerkezete és működése a fűben és más taxonokban
Zuzmók és gombák
Annak ellenére, hogy zuzmókban elterjedtek, csak egy nem zuzmás gomba, az ascomycete Aspergillus fumigatus sejtfalaiban jelentettek (1,3; 1,4) -β-glükánokat, ahol egy nagyon komplex részeként fordulnak elő, lúgban oldhatatlan heteropoliszacharid (Fontaine et al., 2000).
Kölcsönhatások a fehérjék és az (1,3) -β-glükánok és a kapcsolódó poliszacharidok között
I.D.c CBM11
A CBM11 egy kis család, amelynek csak nyolc tagját jelentették be - ezek mind az endo-1,4-β-glükanázok moduljai (Coutinho és Henrissat, 1999). Jelenleg egy szerkezet áll rendelkezésre a CBM11 számára a C. thermocellum Lic26A-CelE-től (CtCBM11, PDB ID: 1V0A) (Malburg et al., 1997). Ez az enzim mind az 5., mind a 26. család katalitikus doménjét tartalmazza, amelynek differenciális aktivitása van (1,3) -β-glükán és (1,3; 1,4) -β-glükán ellen. Az, hogy a magányos CBM ebben az összefüggésben preferenciálisan kötődik-e az előre jelzett szubsztrátok egyikéhez, vagy kölcsönösen kölcsönhatásba lép mindkettővel, fontos biológiai kérdés a CBM filogenitás és a β-glükán felismerés megértése szempontjából.
A CtCBM11 kötődési profiljának vizsgálatához a modult különböző komplex poliszacharidok könyvtárával szemben teszteltük (Carvalho et al., 2004). Az affinitás gélelektroforézist alkalmazva kimutatták, hogy a Ct CBM11 a legnagyobb affinitással köti az (1,3; 1,4) -β-glükánokat, a zab β-glükánt és a lichenint; gyengébb kötődést mutat a hidroxi-etil-cellulózhoz, a glükomannánhoz és a zab tönköly xilánhoz; és nem léptek kölcsönhatásba tiszta (1,3) -β-glükánokkal. Ezt a megfigyelést izotermális titráló kalorimetriával támasztották alá, amely meghatározta, hogy (1,3; 1,4) -β-glükánok, beleértve a lichenint, a zab β-glükánt és (1,3; 1,4) -β-glükotetraszacharidokat, ~ 5-szer nagyobb affinitás, mint az (1,4) -β-oligoglükozidoké (Carvalho et al., 2004). Az (1,3; 1,4) -β-glükánokkal és (1,4) -β-glükánokkal folytatott preferenciális kölcsönhatások párhuzamosan kísérik a mellékelt GH 5 és 26 katalitikus modulok aktivitását, és jelzik, hogy a CtCBM11 mindkét glikozidáz toborzására alkalmas. eltérő specifitások az alkalmazható célszubsztrátumokhoz. Azt, hogy a downstream enzimatikus aktivitások egyidejűek-e (a GH5A és a GH26 egyszerre aktívak) vagy egymás után következnek-e (az egyik enzim elmarad a másiktól, a szubsztrát koncentrációjától függ).
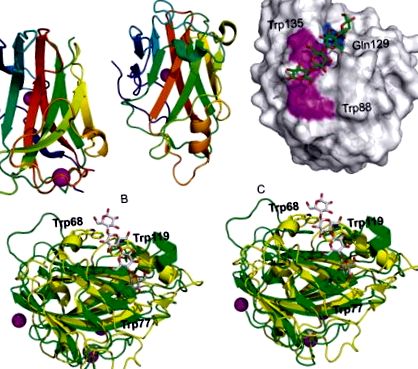
A CtCBM11 szerkezete egy zselés tekercs topológiájú β-szendvics, amely két szerkezeti kalciumatomot tartalmaz (5A. Ábra) (Malburg et al., 1997). Az első kalcium a konvex β-lapon belül helyezkedik el, a második pedig az N- és a C-vég közelében lévő hurktartományokon belül koordinálódik, ami stabilitást biztosít ennek a régiónak, amelynek nincs jelentős másodlagos szerkezete. A kötési helyet a konkáv β-lapra hely-irányított mutagenezissel térképeztük fel, amely három aromás csoport jelentőségét mutatta a komplexképződésben: Y22, Y53 és Y129. A β-glükán felismerés molekuláris meghatározóinak helyszíni boncolása és felderítése várja az (1,3; 1,4) - és (1,4) -β-oligoglükozidokat tartalmazó fehérjekomplexek jelentését.
5. ábra:. (A) A CtCBM11 rajzos ábrázolása két kalciumatommal komplexben, gömbként ábrázolva (PDB ID: 1V0A). (B) A CcCBM17 rajzfilmábrázolása gömbként feltüntetett kalciumatommal komplexben (PDB ID: 1J83). (C) A CcCBM17 oldószerhez hozzáférhető felületi modellje cellotetraózzal komplexben (PDB ID: 1J84). A sekély kötő hasadékot két felületi aromás maradékkal, a Trp88 és Trp135, valamint a Gln129 béléssel látják el. (D) A Bsp CBM28 (PDB ID: 1UWW) fali szemmel sztereó nézete Ct CBM17-kel (sárga, PDB ID: 1V0A). Megjelennek a Bsp CBM28 (Trp68, Trp77 és Trp119) kötődésében szerepet játszó aromás csoportok. A CtCBM17-ből származó cellotetraose-ligandum látható. A színspecifikációk a panelek színeire vonatkoznak.
Az (1,3) -β-glükánok fizikai-kémia
II.C.3 Gabona (1,3; 1,4) -β-glükánok gélesedése
22. ábra:. Lánc kölcsönhatások egy (1,3; 1,4) -β-glükánban gélesedéshez vezetnek. (A) Az egymást követő (1,4) -β-kapcsolatok szekvenciái asszociálnak. (B) Az egymást követő cellotrióz egységek társulása (1,3) -β-kötésekkel összekapcsolva, amely spirális szerkezetet képez.
Böhmtől és Kulickétől (1999) .
3. táblázat:. Kompressziós modulus (E), valódi feszültség (τ tr) és valódi törzs (ε tr) meghibásodás esetén az (1,3; 1,4) -β-glükán géleknél 8% (w/v) koncentrációban
| Zab200 | 2.1 | 36.6 | 4.5 | 0,22 |
| Árpa200 | 3.0 | 36.7 | 6.3 | 0,38 |
| Búza200 | 3.1 | 44.6 | 18.5 | 0.5 |
| Zab100 | 2.1 | 39.7 | 2.5 | 0,08 |
| Árpa100 | 2.8 | 55.7 | 4.6 | 0,16 |
| Lichenin100 | 24.5 | 91.1 | 24.3 | 0,27 |
200 és 100 a hozzávetőleges moláris tömeg × 10 −3. A gél kikeményedése és mérési hőmérséklete 25 ° C. Lazaridou et al. (2004).
Az (1,3) -β-glükánok és a hozzájuk kapcsolódó poliszacharidok evolúciós aspektusai
4.7.3 (1,3; 1,4) -β-glükánok előfordulása
2. ábra:. (1,3; 1,4) -β-glükánok előfordulása a glaucophytáktól, a vörös algáktól és a zöld algáktól kezdve a kommelinid Poalesig: a. a vörös algában a Kappapheus tartalmazza a szulfatált formát; b. az Ulva klorofita alga glükánja xilózt tartalmaz; c. a sivatagban lévő Micrasterias-ban (charophyte alga); d. a Locopholea májmortában található glükán (bryophita) arabinózt tartalmaz; e. az Equisetum monilofita nemzetségben (zsurló); f. a Poaceae és a kapcsolódó „core Poales” családokban a Poales sensu lato-ban.
Trichoderma enzimek a textilipar számára
Terhi Puranen,. Jari Vehmaanperä, a Trichoderma biotechnológiájában és biológiájában, 2014
Enzimosztályok a katalitikus aktivitás alapján
Az ipari enzimeket hagyományosan az IUB enzim-nómenklatúra szerint osztályozták, amely mind a reakció típusán, mind a szubsztrát-specifitáson alapul (Bairoch, 2000). Például a cellulázok a hidrolázokhoz és a glikozil-hidrolázok alosztályához tartoznak, vagyis az O- és S-glikozil-vegyületeket hidrolizáló enzimekhez (EC 3.2.1. ×). A trichoderma-cellulázokat endo-enzimekre osztják, amelyek a polimerlánc közepén hidrolizálnak, és exo-hatású hidrolázokra, amelyek a redukáló vagy nem redukáló végből dolgoznak fel. A trichoderma endoglükanázok az EC 3.2.1.4 osztályba tartoznak, és hidrolizálják az (1 → 4) -β-d-glükozid kötéseket a cellulózban, a licheninben és a gabona β-d-glükánban. A cellobiohidroláz I (EC 3.2.1.176) felszabadítja a cellobiózt a lánc redukáló végéből, míg a cellobiohidroláz II (EC 3.2.1.91) a cellulóz nem redukáló végén hat. A cellulóz teljes hidrolízise során úgy gondolják, hogy az endoglükanázok megtámadják a cellulóz amorf régióit, és olyan láncvégeket állítanak elő, amelyek az exoglukanázok (cellobiohidrolázok) szubsztrátumaként szolgálnak, amelyek szintén képesek a kristályos régióra hatni. Ez utóbbi enzimek előállítják a diszacharid cellobiózt, amelyet a β-glükozidáz két glükózmonomerré hidrolizál (Zhang és Lynd, 2004; Sticklen, 2008).
Az IUB osztályozás nem tükrözi az enzimek szerkezeti jellemzőit, ezért az enzimek osztályozására egy másik megközelítést alkalmaztak (Henrissat, 1991). Ez az enzimek szoros vagy szekvencia-hasonlóságain alapul, és nagyban megkönnyítette a peptidszekvenciákra és a háromdimenziós fehérjeszerkezetekre vonatkozó adatok felhalmozása. A CAZy adatbázist (a szénhidrát-aktív enzimekhez) a http://www.cazy.org címen tartják fenn, és jelenleg több mint 130 glikozid-hidroláz családot sorol fel. A fő Trichoderma endoglükanázok a GH 5. családba (endoglukanáz II vagy EGII), a GH 7. családba (endoglükanáz I vagy EGI) és a GH 12. családba (endoglukanáz III vagy EGIII) tartoznak. Az I és II cellobiohidrolázok a 7. és 6. GH családhoz vannak rendelve. A Trichoderma reesei rendelkezik egy endoglükanáz EGV-vel is, amely a 45-ös glikozid-hidroláz családba tartozik. A GH 45-ös család fontos enzimosztály, mivel számos családtagot, például a Humicola, Thielavia vagy Melanocarpus nemzetségből származóakat, textilipari alkalmazásokban használnak (Schülein, 2000; Haakana és mtsai, 2004). A Trichoderma EGV jellemzői azonban jelentősen eltérnek a textilpiacon elérhető GH45 cellulázokétól. A Trichoderma EGV így nem került kereskedelmi forgalomba (Karlsson et al., 2002).
A CAZy-osztályozás tükrözte a gén- és fehérje-nómenklatúrát is: azt javasolták, hogy a géneket GH-családjuk szerint jelöljék meg, betűkódokkal ábécé sorrendben, azonos géncsoporthoz tartozó enzimeket kódoló több gén esetében (Henrissat et al., 1998 ). Így a Trichoderma cellulázok cellobiohidroláz I és endoglükanáz I azonos családba tartozó génjei - a GH7 - cel7A és cel7B rövidítéssel rendelkeznek, a jelentett fehérjeszekvenciák sorrendje szerint. Míg a rendszer leegyszerűsíti a különböző organizmusok különböző hidrolázainak összehasonlítását, hátránya, hogy a különböző hatásmódú enzimeknek hasonló betűszavai vannak, például az exo-hatású cellobiohidroláz I (Cel7A) és az endo hatású endoglükanáz I (Cel7B). . Továbbá, mivel a betűkód a felfedezés sorrendjét tükrözi, nem pedig a struktúrát vagy az aminosav-szekvenciát, a különböző organizmusokban hasonlóan ható vagy homológ enzimek eltérő betűkódokkal rendelkeznek.
Az áttekinthetőség érdekében kettős rövidítést használunk ebben az áttekintésben: például az endoglükanáz II EGII/Cel5A kóddal rendelkezik.
- Indirekt kalorimetria - áttekintés a ScienceDirect témákról
- Intercostal Nerve - áttekintés a ScienceDirect témákról
- Szándékos mérgezés - áttekintés a ScienceDirect témákról
- Közepes láncú triglicerid - áttekintés a ScienceDirect témákról
- Laminin - áttekintés a ScienceDirect témákról