Laminin
Kapcsolódó kifejezések:
- Eicosanoid Receptor
- Alapmembrán
- Kollagén
- Extracelluláris mátrix
- Az extracelluláris mátrix fehérjék
- Axon
- Peptid
- Fehérje
- Sejttapadás
- Fibronektin
Letöltés PDF formátumban
Erről az oldalról
Extracelluláris mátrix | Alagsori membránok
Laminin
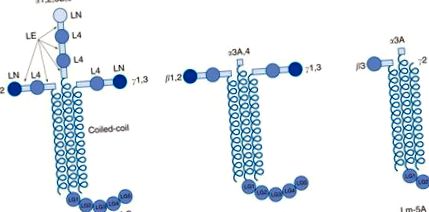
A lamininok alkotják a BM-ek fő nem kollagén komponensét. A lamininok heterotrimer glikoproteinek, amelyek egy a, egy p és egy y láncból állnak (3. ábra). Öt α-, négy p- és három y-lánc kombinációjából tizenöt laminin izoformát azonosítottak (1. táblázat). Az α-, β- és γ-láncok strukturális homológiát mutatnak, ideértve a laminin N-terminális doménjeit (LN), a laminin epidermális növekedési faktor (EGF) szerű ismétlődő doménjeit (LE), a laminin 4 doménjeit (L4) és a α-spirális tekercses tekercs hosszú karok. Az α-láncok számára egyedülállóak a nagy C-terminális laminin-globuláris (LG) domének, amelyek öt kisebb egységből állnak (LG1–5). Ezeket az α-láncú LG doméneket olykor proteázok hasítják, hogy kisebbek legyenek. A laminin-láncok (különösen az α3β3γ2 vagy laminin-5) alcsoportja esetén az N-terminális rövid karokat proteázok csonkítják és/vagy hasítják.
3. ábra A lamininek általános szerkezete. A laminin (Lm) heterotrimerek (arab számokkal) három alakban léteznek: kereszt-, Y- vagy T-alakúak és rúd alakúak. A rövid karok, a laminin N-terminális (LN) és a laminin négy (L4) globuláris doménjeit rúdszerű laminin EGF-szerű ismétlődő (LE) domének választják el egymástól. Az α – β – γ láncok a tekercselt tekercs doménjein keresztül trimerizálódva alkotják a hosszú karot. A C-terminális LG domén egyedülálló az α-láncokra.
Asztal 1 . Laminin-heterotrimerek és láncösszetétel
| Laminin-1 | α1β1γ1 |
| Laminin-2 | α2β2γ2 |
| Laminin-3 | α1β2γ1 |
| Laminin-4 | α2β2γ1 |
| Laminin-5A | α3Aβ3γ2 |
| Laminin-5B | α3Bβ3γ |
| Laminin-6A/B | α3A/Bβ1γ1 |
| Laminin-7A/B | α3A/Bβ2γ1 |
| Laminin-8 | α4β1γ1 |
| Laminin-9 | α4β2γ1 |
| Laminin-10 | α5β1γ1 |
| Laminin-11 | α5β2γ1 |
| Laminin-12 | α2β1γ3 |
| Laminin-14 | α1β2γ3 |
| Laminin-15 | α1β5γ3 |
Extracelluláris mátrix
Laminin
A lamininok kereszt alakú molekulák, amelyek több különböző típust tartalmaznak, és a tüdő fejlődésének részét képezik [1, 77–79]. A fejlődő tüdő elemzése kimutatta egyes lamininláncok kifejeződését már az emberi terhesség 10 hetében [80]. A lamininok az alapmembrán mentén expresszálódnak, de a különböző laminin alegységek időbeli és térbeli expresszióját dokumentálták [25, 81]. A laminin expresszió szerepet játszhat a tüdõ és más szövetek sejtdifferenciálódásában. Néhány bizonyíték arra utal, hogy a laminin szerepet játszhat az alveoláris morfogenezisben [82]. A laminin – heparán-szulfát kölcsönhatás elengedhetetlen lehet a lumen képződéséhez és az elágazó morfogenezishez [83] .
Tervezési szempontok az őssejtek idegszövetének mérésekor
2.1.3 Laminin
A laminin egy olyan fehérje, amely számos tulajdonsággal rendelkezik a fibronektinnel. Például magas a molekulatömege is. A laminin fehérje három alegységből áll, köztük a-, β- és γ-láncokból, amint az a 2. ábrán látható. A laminineket szintén glikoproteineknek tekintik, mivel oligoszacharidokkal funkcionalizáltak [3]. Az extracelluláris mátrixban a laminin képes megkötni más laminin molekulákat, valamint más fehérjéket, például a kollagént, ami segít megerősíteni az extracelluláris mátrix szerkezetét. A sejtek a lamininhez is kötődhetnek az integrin receptorokon keresztül, amelyeken sejtmembránjukban expresszálódnak [15]. Ezek a tulajdonságok vonzóvá teszik a lamininokat mind a pluripotens őssejtek, mind az idegsejtek sejttenyésztési szubsztrátjaiként [16,17]. Az őssejtek érett fenotípusokká történő differenciálására vonatkozó protokollokhoz gyakran 2D laminin szubsztrátokon tenyésztésre van szükség. A laminin szintén kulcsszerepet játszik az idegrendszer fejlődésében, mivel az axonok hajlamosak erre a fehérjére vándorolni, vonzóvá téve azt a regeneratív gyógyászati alkalmazások számára [18]. Végül a laminin megtalálható az idegi őssejt-fülkében, ahol hozzájárul a növekedési faktort megkötő tulajdonságaihoz a fraktonként ismert speciális struktúrákhoz [19] .
2. ábra A laminin molekuláris szerkezete. Három alegységből áll, amelyek neve α, β és γ.
Újranyomtatták Plantman S. engedélyével. Az ECM molekulák proregeneratív tulajdonságai. BioMed Res Int 2013; 2013.
Neuropatológia
Edoardo Malfatti, Norma Beatriz Romero, a Klinikai Neurológia Kézikönyvében, 2018
Laminin α2
30.10. A-laminin fluoreszcens immunjelölése. (A) A bazális membrán festését mutató kontroll. (B) A laminin α2 expressziójának csökkenése egyes szálakban, hiánya másokban molekulárisan igazolt laminin α2-vel kapcsolatos dystrophiában. (C) A festés teljes hiánya.
Extracelluláris Mátrix (ECM) molekulák
3.5.1 Lamininok
Keresztbeszélgetés a gyulladás és az extracelluláris mátrix között a szívinfarktus után
Yonggang Ma,. Vidám L. Lindsey, a szívelégtelenség gyulladásában, 2015
4.5.4 Lamininok
A lamininok, az első ECM-glikoproteinek, amelyek az embrióban kimutathatók, a bazális membránban találhatók. A lamininek három peptidláncból állnak: α, β és γ. A laminin fehérjét az MI-t követő 3. napon detektálják az infarktus területén, a koncentráció csúcspontja a 7-11. Napon következik, majd visszatér az alapszintre [69]. A lamininok széles körű jelenléte az infarktus területén azt sugallja, hogy közvetlenül szabályozhatják az LV javulását az MI után [69]. Akut MI-ben szenvedő betegeknél a szérum laminin szintje magasabb, mint a stabil koszorúér-betegségben szenvedőknél és a koszorúér-betegségben nem szenvedőknél [70]. Ez a jelentés felveti annak lehetőségét, hogy a szérum laminin potenciális prognosztikai marker lehet az MI betegek számára.
Molekuláris és extracelluláris jelek a motorneuron specifikációjában és differenciálásában
Laminin
A lamininok nagyok (
800 kDa) az ECM-hez kapcsolódó glikoproteinek, amelyekről azt gondolják, hogy elengedhetetlenek a neuronok migrációjához és az axonális útkereséshez a fejlődés során. Ezek heterotrimer molekulák, amelyek α, β és γ láncokból állnak. Ezek a láncok különféle kombinációkban mutatják be magukat, így akár 18 különböző laminin izoformát eredményeznek, amelyek többsége az idegrendszer ECM-jében van. 54 Az S-laminin a laminin B1 alegységének homológja. Ismert, hogy megkönnyíti az MN adhéziót, és fontos szerepet játszik a neuromuszkuláris csomópontok kialakulásában. A fejlődő központi idegrendszerben az S-laminin és a laminin egyaránt megtalálható az agykéregben az altalajban. 55 Ez a helyzet drámai módon megváltozik a felnőttkori központi idegrendszerben, amelyet az S-laminin eltűnése és a laminin korlátozott expressziója jellemez az alapmembránban, ahol szoros kapcsolatban található a kollagén és heparán-szulfát proteoglikánokkal (HSPG). 51
A lamininok a PNS bazális membránjának fontos alkotóelemei, amelyek a Schwann-sejteket körülveszik. Úgy gondolják, hogy az alapmembrán szerves tapadó és növekedést elősegítő alkotóelemeként a strukturális fehérjék hálóját együtt szervezik, hogy kialakítsák azt a szubsztrátot, amelyen neuronális migráció és axonális útkeresés történhet. 56 A laminin izoformák sokfélesége előnyös lehet az MN-ek szelektív kötődésének szabályozásában, amelyet állítólag az S-laminin-specifikus LRE (leucin – arginin – glutaminsav) aminosav-szekvencia közvetít. 57
A tüdőhám integrin szabályozása
5.1.2.1 Lamininok
A lamininok a IV kollagénnel együtt jelentős szerkezeti támaszt nyújtanak a tüdő számára, és a tüdő bazális membránjának elsődleges alkotóelemei. A lamininek heterotrimer fehérjék, amelyek egy α, egy β és egy γ láncból állnak, és 16 megerősített vagy előre jelzett humán izoformája van, amelyek öt α láncból, három β láncból és három γ láncból állnak [30]. A magzati tüdő bazális membránja mind az öt lehetséges α-lánccal rendelkező laminint tartalmaz. Ezzel szemben a felnőtt tüdőhám az α lánc expresszióját α3 és α5 lamininná korlátozza [31–33] .
A laminin célzott deléciói vagy gátlása igazolja a lamininek szükségességét a tüdő fejlődésében [34,35]. A laminin α1 gátlása a magzati tüdő explantánsokban elágazó morfogenezis hibákat és megzavarodott hámpolaritást eredményez [36]. A laminin α5 globális törlése magzati veszteséget eredményez a terhesség közepén-későn, a tüdő károsodott lobar szeptációjával társulva [37]. A laminin α5 indukálható tüdőhám specifikus deléciója további szerepet játszott a tüdő fejlődésében. Ezek az egerek röviddel a születésük után elhaltak légzési elégtelenségben. A tüdőjük szövettani vizsgálata azonban a késői magzati tüdőfejlődés során hámdifferenciálódási hibákat, kitágult disztális légtereket, fokozott apoptózist és csökkent proliferációt mutatott ki az egész tüdőszekciókban [38]. .
A laminin 332 szerepét a tüdő fejlődésében globális és szövetspecifikus egér deléciók, magzati tüdő explantánsok és in vitro vizsgálatok segítségével vizsgálták. A laminin 332 expressziója kizárólag a hámsejtek alapfelületén lokalizálódik a magzati tüdő bazális membránjában. Az α1 és α5 lamininnel ellentétben a γ2 lánc (specifikus a 322 lamininre) nem szükséges az elágazó morfo genezishez vagy a magzati tüdő hámsejtjeinek differenciálódásához. A tüdő szövettani elemzése laminin γ2 -/- egerekből rendezetlen hemidesmosomákat mutatott ki a trachealis epitheliumban, azonban ezek az egerek megtartották a normális epitheliális integritást és a tüdő működését [39]. A laminin γ2 szerepét a felnőtt tüdőben ezzel a genetikai megközelítéssel nem vizsgálták, mivel a laminin γ2 -/- egerek súlyos bőrhibái perinatális letalitást eredményeztek az alultápláltság miatt [40]. A Laminin 322 a felnőtt tüdő bazális membránjában is expresszálódik. Ebben az összefüggésben az α3 laminin tüdő hámspecifikus deléciója szerepet játszott ennek a laminin izoformának a tüdőfibrózis kialakulásában [41]. Ezeknek az egereknek nincs fejlődési fenotípusuk, de megnövekedett mortalitásuk, gyulladásuk és fibrózisuk van az intratrachealis bleomycin-fertőzést követően.
Axonális útkeresés: Extracelluláris mátrix szerep
Lamininok
Tekintettel a lamininok széles eloszlására és a laminin-1 azon képességére, hogy elősegítse a robusztus axonális növekedést számos idegsejttípusból, úgy gondolják, hogy a lamininok megengedően működnek, biztosítva a tapadást, amely szükséges a növekedési kúp migrációjához, de nem tanulságos módon. befolyásolni az útkeresési döntéseket. A lamininok és más ECM-molekulák széles körben elősegíthetik a növekedési kúpok migrációját egy útvonal mentén, amelynek határait nem a tapadó ECM-molekulák hiánya határozza meg, hanem inkább a negatív iránymutatások, például rések vagy szemaforinok expressziója a szomszédos szövetekben. Ez a „surround taszítás” mind a fejlődő központi idegrendszerben, mind a PNS-ben előfordul. Számos mutációs vizsgálat számolt be sajátos hibákról az útkeresésben, amikor egy laminin hiányzik vagy blokkolva van. A laminin funkció elengedhetetlen a szöcske végtag rügyében a növekedési kúp elfordulásához, és a laminin-alfa-1 lánc mutációival rendelkező zebra halak több axonvezetési hibát mutatnak a központi idegrendszerben, de nem minden helyen. Ezek az eredmények arra utalnak, hogy a laminin által közvetített adhézió legalább néhány esetben elengedhetetlen a növekedési kúp navigálásához.
Szervezeti sejtbiológia
Lamininok
Jóllehet a laminin-nómenklatúra többször is átesett, a jelenlegi elnökölt nómenklatúra meghatározza az egyes laminin-családtagokat a megfelelő alegység-összetétel alapján. Például a 111 laminin α1, β1, γ1 alegységekből áll, míg az 511 laminin α5, β1 és γ1 alegységekből áll (Aumailley et al., 2005). A laminin trimereket az öt α, négy β és három γ lánc egyikének véletlenszerű összeállítása képezi, így legalább 15 ismert különböző heterotrimert állítanak elő (Aumailley et al., 2005). A laminin 111 molekulatömege
A laminin hálózat önfelépülése a sejt felszínén történik, és a laminin kereszt alakú molekula három „rövid karjának” kölcsönhatásával valósul meg (Hohenester és Yurchenco, 2013). Különösen azok a lamininok, amelyek nem rendelkeznek rövid karokkal, mint például a 411 és a 421, nem képesek egymástól függetlenül polimerizálni, hogy hálózatot képezzenek, bár beépülhetnek az alapmembránokba a laminin más formáival való kölcsönhatás révén. A laminin kereszt „hosszú karja” tartalmazza azokat az LG doméneket, amelyek a laminin receptor kötődésének elsődleges helyei, beleértve a laminint kötő integrineket és az α-dystroglikánt (Yurchenco, 2011). Ezenkívül a proteoglikán-agrin nagy affinitással kötődik a molekula hosszú karjának egyik helyén a γ1-hez, ami a laminin-hálózatok további kapcsolódásait biztosítja a sejtfelületekhez (Suh és Miner, 2013).
Az alapmembrán összeállításához a sejt felületén a laminin hálózat polimerizációja szükséges. A laminin expressziójának absztrakciója az alapmembránok teljes hiányához vezet az embrióban (Smyth et al., 1999). Ezzel szemben a kollagén IV, a másik elsődleges bazális membrán fehérjehálózat deléciója nem vezet laminin hálózat hiányához, és az alapmembránok bizonyos mértékben kialakulnak a kollagén IV null egerekben (Poschl és mtsai, 2004). A kollagén IV hiányában termelődő alapmembránok azonban végül feltehetően kudarcot vallanak, mivel nem képes fenntartani a szerkezeti integritást, ami embrionális letalitást eredményez (Poschl és mtsai, 2004).
- Indirekt kalorimetria - áttekintés a ScienceDirect témákról
- Intercostal Nerve - áttekintés a ScienceDirect témákról
- Szándékos mérgezés - áttekintés a ScienceDirect témákról
- Közepes láncú triglicerid - áttekintés a ScienceDirect témákról
- Metokarbamol - áttekintés a ScienceDirect témákról