Pajzsmirigy hormon akció és energia kiadások
Sahzene Yavuz
Endokrinológiai, cukorbetegség és anyagcsere osztály, Virginia Commonwealth University, Richmond, Virginia
Silvia Salgado Nunez del Prado
Endokrinológiai, cukorbetegség és anyagcsere osztály, Virginia Commonwealth University, Richmond, Virginia
Francesco S Celi
Endokrinológiai, cukorbetegség és anyagcsere osztály, Virginia Commonwealth University, Richmond, Virginia
Absztrakt
1. Energia kiadások: Meghatározás és alkatrészek
Ülő személyeknél a pihenő EE (REE) teszi ki az összes EE (TEE) többségét (60–80%) [10]. A REE kifejezést gyakran felváltva használják a BMR-rel, és meghatározzák azt az minimális energiamennyiséget, amely szükséges ahhoz, hogy az egyén ébren legyen az energiamérleg állandó állapotában. Érdekes, hogy az energiamérleg dinamikus állapotaiban, mint például a hosszan tartó gyors, a REE jelentősen csökkenhet [10]. A szubsztrát oxidációjára (légzésre) van szükség a szervezet alapvető funkcióinak fenntartásához, amely magában foglalja a szubsztrát és az oxigén szállítását a szövetekbe, a sejt szerkezeti integritását és funkcióit, többek között az intracelluláris és az extracelluláris rekesz közötti gradiensek fenntartását.
Az önkéntes fizikai aktivitás, más néven testmozgási aktivitással kapcsolatos termogenezis (EAT), és a nem testmozgással kapcsolatos termogenezis (NEAT), spontán izgatás, valószínűleg a legtöbb módosítható változó a TEE-ben az emberek többségében, és egyénenként jelentősen változhat [ 11] és ugyanazon tantárgyon belül mindennap a fizikai aktivitással kapcsolatban [11].
Az EE további kevésbé ismert összetevője az étel termikus hatása (alternatívaként étkezés utáni termogenezisként definiálva), amely az étkezés során bekövetkező energiaveszteséget képviseli az abszorpció, a tárolás és az emésztés követelményein felül. Az ételek termikus hatását az energiacsere homeosztatikus rövid hurokjának tekintik, amely az akut kalóriaterhelések eloszlatására irányul, és általában az energiafogyasztás 8% -a és 15% -a között mozog, és a varianciát összefüggésbe hozták a fogyasztott ételek tápanyag-összetételével és energiatartalmával [12]. ].
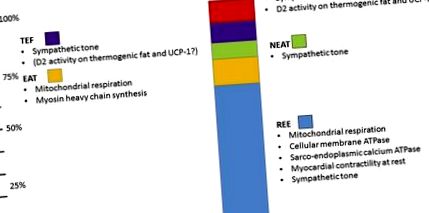
Végül az adaptív termogenezist a maghőmérséklet fenntartásához szükséges energiaszórásként határozzuk meg, amikor az egyéneket a termoneutrális zóna alatti környezeti hőmérsékletnek tesszük ki, amely az embereknél becslések szerint 28 ° C [13]. Az adaptív termogenezis a reszketõ termogenezisben is fel van osztva az izom fasciculációja és az akaratlan összehúzódás, valamint a nem reszketõ termogenezis következménye, amely a kémiai energia hõvé történõ közvetlen átalakításából származik, fõleg a mitokondriális membrán protongradiensének a protein-1 szétkapcsolásával. (UCP-1) főleg barna és bézs zsírban fejeződik ki [14]. Úgy gondolták, hogy az adaptív termogenezis csak kicsi és hibernáló emlősöknél releváns, de az elmúlt évtizedben megfigyelési és beavatkozási tanulmányok kimutatták, hogy az adaptív termogenezis az emberi TEE jelentős hányadát adhatja, akár 15% -ot nem reszketve, és nagyobb intenzív intenzív időtartam alatt. didergő termogenezis [15]. Az EE komponenseit és azok relatív hozzájárulását a TEE-hez az 1. ábra mutatja .
A TEE alkatrészeinek sematikus ábrázolása. Az ülő emberben a TEE nagyobb meghatározója a REE (világoskék). Az EAT a TEE ~ 15% -át teszi ki, de ez a TEE legváltozóbb összetevője. További komponensek a NEAT, az ételek termikus hatása (TEF) és az adaptív termogenezis (AT). Az összes TEE komponenst közvetlenül vagy közvetve modulálja a TH művelet (a részletekért lásd a szöveget).
Figyelemre méltó, hogy a TEE összes komponensét a TH modulálja (Vaitkus et al. [16] részletesen áttekintette). Röviden, a TH átterjedő szerepet tölt be a REE-n azáltal, hogy közvetlenül szabályozza (és ezzel elősegíti az ATP hasznosulását) az olyan anyagcsere-ciklusokat, mint a lipolízis/lipogenezis, glikogenolízis/glükoneogenezis, foszfofruktokináz/fruktóz-1,6-difoszfatáz, hexokináz/glükóz-6-foszfatáz és fehérjeszintézis és katabolizmus [17]. Ezenkívül a TH-művelet felgyorsítja az ionszivárgást a sejtmembránon, elsősorban a Na +/K + ATPáz és a sarcoendoplazmatikus kalcium-ATPáz révén, ami további ATP-fogyasztást igényel az iongradiensek fenntartásához [18].
Ezenkívül a TH szívizomra gyakorolt inotrop és kronotróp hatása jól le van írva, és az oxigénfogyasztás kimutatható változását fejezi ki a TH státusz változásainak következtében, mind in vitro, mind in vivo [19].
A TH-akciónak figyelemre méltó modulációs hatása van a mitokondriális légzésre is, mivel közvetlenül elősegíti a mitokondriális biogenezist [20] és stimulálja a PGC-1α [21] transzkripcióját, amelyet az aerob légzés fő szabályozójának tekintenek. Ezenkívül a TH hatásának köszönhetően a mitokondrium belső membránjában a protongradiens eltolódhat, a kémiai energiát hatékonyan hővé terelheti. Az UCP-1 mellett a TH csökkenti a mitokondriális légzés oxidatív foszforilezésének hatékonyságát a mitokondriális permeabilitás átmeneti pórusainak aktiválásával és az ADP/ATP transzlokáz modulálásával [22].
Összességében a TH-cselekvés kritikus szerepet játszik a gerincesek EE-modulációjában, és egyedülálló szerepe van a melegvérű állatok maghőmérsékletének fenntartásában. Ezek a hatások többnyire megengedőek, és fiziológiás állapotokban a hormonális jelátvitel helyi modulációja, nem pedig a keringő TH-szint változásai felelősek a légzésen és végső soron az EE-nél a sejt sejtspecifitásáért.
2. Az energiakiadások mérése
A legmegbízhatóbb módszer az EE és komponenseinek mérésére az indirekt kalorimetria, amely azon Weir-egyenleten alapul, amelyben EE = [3,94 × oxigénfelvétel térfogata (VO2)] + [1,1 × szén-dioxid-kibocsátás (VCO2)] [ 25]; ennélfogva a belélegzett és kilélegzett gáz közötti O2 és CO2 különbség mérésével kiszámítható a kalóriafogyasztás, feltéve, hogy az egyén állandó táplálkozási állapotban van, és nem folytat jelentős fizikai aktivitást. Történelmileg ez a módszer jelentette a pajzsmirigy működésének irodai alapú értékelésének arany standardját, mint BMR [26]. Ezenkívül a CO2-termelés és az O2-fogyasztás különbségének mérésével elő lehet állítani a légzési hányadost, ami viszont lehetővé teszi a szubsztrát-felhasználás becslését, amelyben 1 az összes szénhidrátot, míg 0,7 az összes zsíroxidációt jelenti [27].
A közvetett kaloriméteres EE mérések túlnyomó részét a szellőző burkolat módszerével hajtják végre, amely egy hordozható gázelemző készülékre támaszkodik, amely egy kis kupola burkolathoz csatlakozik, amely körülveszi a vizsgálati alanyot [28]. A szellőztetett burkolati módszerek „nyitottak”, amelyekkel a készülék kizárólag a lejárt levegőt méri, míg a belélegzett levegőt egy referencia-levegőminta mérésével „becsüljük meg”. Ennek az eljárásnak az előnyei a készülék hordozhatóságában és a viszonylag alacsony költségekben rejlenek. Ezzel szemben a szellőztetett motorháztető módszerrel történő felvételeket időben korlátozza az a szükség, hogy a személy mozdulatlan, ébren és nyugodt legyen. Ezenkívül a rendszer érzékenységét és pontosságát nagymértékben csökkenti az a tény, hogy a belélegzett levegőt becsülik/számolják, nem pedig mérik [29]. Ennélfogva a páratartalom vagy az O2 vagy a CO2 koncentrációjának változása (pl. Kis helyiségekben végzett felvétel több megfigyelővel együtt) negatívan befolyásolhatja a felvételek pontosságát. Ezzel szemben egy hordozható közvetett kaloriméter maszkkal történő felszerelésével rögzíteni lehet a gázcserét edzés közben.
Az egész szobás kaloriméteres „metabolikus kamra” módszer a zárt helyiségbe belépő és onnan kilépő levegő folyamatos mérésén alapszik, a levegő folyamatos keverésével (turbulens áramlás), amelyben a vizsgálati alany hosszabb ideig tartózkodhat, legfeljebb néhány napig, és végezzen szokásos napi tevékenységeket, beleértve a testmozgást is [30, 31]. Ezt a módszert jelenleg az EE mérésének arany szabványának tekintik, mivel pontossága nagyobb, mint a szellőztetett motorháztető [32], és lehetővé teszi az összes EE komponens rögzítését szinte szabad életkörülmények között [10]. Az egész szobás kaloriméter-módszer fő korlátjait a készülék költsége és a valós körülmények mérésének képtelensége képviseli.
Az EE becslésének alternatív módszere a stabil izotópokkal (2H218O) kétszeresen jelölt víz beadásán és a hidrogén és az oxigénmolekulák differenciális eltűnésének mérésén alapszik [33] tömegspektroszkópiával mérve. Ez a módszer lehetővé teszi az átlagos TEE megbecsülését hosszú időn keresztül (általában 1 hónap), és fő előnye az EE szabad életkörülmények között történő rögzítésében rejlik [33], anélkül, hogy az ionizáló sugárzásnak való kitettség kockázatot jelentene. A hátrányok összefüggenek a költségével, az EE komponensek mérésének képtelenségével és azzal a ténnyel, hogy a mérés számos feltételezésen alapul, mint például a stabil súly és az átlagos étrend.
A gyorsulásmérők vonzó alternatívát jelentenek az EE becsléséhez [34]. A technológia olcsó és nem invazív, de a mérés több feltételezésen alapul, ami alacsony pontosságot eredményez [35].
Összességében többféle módszer áll rendelkezésre az EE és komponenseinek becslésére, és jelenleg az egész szobás közvetett kaloriméter jelenti a legpontosabb eszközt, amely képes mérni az EE és komponenseinek teljes spektrumát, de annak költségeit és követelményeit magasan specializált személyzet jelentősen korlátozza alkalmazását (1. táblázat).
Asztal 1.
Az EE mérésére használt főbb módszerek összehasonlítása emberben
| Teljes szobás kaloriméter | Igen | Igen | Igen a, b | Igen c | Igen | Igen | Pontos (~ 5% -os hiba), a TEE bizonyos részei csak ezzel a módszerrel mérhetők | Drága, speciális csapatot igényel; nem képviselve a szabad életkörülményeket | ||||
| Tető/fedél (nyitott áramkör) | Igen | Igen b | Igen | Nem | Igen b | Nem | Hordozható, könnyen használható, elérhető, olcsóbb | Jó pontosság a REE számára, függő alany mobilitása, zárt téma | ||||
| Kétségtelenül felcímkézett víz | Nem | Nem | Nem | Nem | Nem | Igen | Pontos (b | Nem | Nem | Nem | Olcsó, képes hosszú távú szabad életkörülmények alkalmazására | Nagyon pontatlan, a felvevő torzításának van kitéve |
Rövidítések: AT, adaptív termogenezis; TEF, az ételek termikus hatása.
3. A pajzsmirigy-rendellenességek klinikai összefüggései az EE-n
A. Pajzsmirigy túlműködés és EE
A pajzsmirigy pajzsmirigy túlműködése példázza a TH áteresztő hatását az EE-re, és valóban, a BMR mérését használták a betegség súlyosságának és lefolyásának felmérésére [3]. A TH sejtes légzésre és ioncsatornákra gyakorolt közvetlen hatásai mellett (lásd fent) a hyperthyreosis energetikai költségei magukban foglalják a szív- és érrendszerre gyakorolt hatását [19], valamint a szimpatikus idegrendszerre gyakorolt szinergetikus hatásokon keresztül a finom remegést és a spontán mozgások, ami a NEAT jelentős növekedéséhez vezet [36]. Ezenkívül vannak kísérleti bizonyítékok arra vonatkozóan, hogy a nem rezgő termogenezis maladaptív aktiválása a BAT-ban további hozzájárulást nyújt a hyperthyroid állapotokhoz társuló EE növekedéséhez [37, 38]. Ezt valószínűleg a T3 UCP-1-re gyakorolt pozitív transzkripciós hatása közvetíti [39]. Ebben az esetben a T3 nem lokálisan keletkezik a barna adipocytában a 2-es típusú dejodináz hatására, amelyet a T3 gátol, hanem inkább a keringő hormon feleslegéből származik.
Kísérletileg Kim és mtsai. [40] hat Graves-betegségben szenvedő koreai nőt vizsgáltak a diagnózis után egy év alatt, és az indirekt kalorimetriával mérték az EE-t a kiinduláskor, majd a metimazol-kezelés után 4, 8, 12, 26 és 52 héttel. A kiinduláskor a REE az előrejelzett REE 140% -a volt, amely az 52. héten 113% -ra csökkent. A szabad T3, az összes T3 és a szabad T4 szignifikánsan korrelált a REE-vel, valamint a perifériás dejodináz aktivitással [40]. Egy másik tanulmányban a REE metabolikus változásait mérték meg (közvetett kalorimetriával) a hyperthyreosis kezelése során 21 kínai nőnél. Megállapították, hogy az EE szignifikánsan csökkent (28,7 ± 4,0 kcal/kg-ról 21,5 ± 4,1 kcal/kg-ra; P 2,5 μIU/ml). Ezzel szemben a szabad T3 szint közvetlen összefüggést mutatott az EE-vel, de az adipozitási indexekkel is, beleértve a testtömeg-indexet (BMI), a testösszetételt és a zsírmentes tömeget [49]. Ez utóbbi megfigyelés összhangban áll más keresztmetszeti vizsgálatokkal, amelyek világosan meghatározták a keringő T3 szintek és az adipozitás közötti pozitív kapcsolatot [50, 51].
Legutóbb egy kettős-vak intervenciós vizsgálatban Samuels et al. [52] 138 hypothyreosisban szenvedő betegnél vizsgálták az LT4 terápia kiigazításának hatásait. A szerzők hipotireózisban szenvedő betegeket vontak be LT4-vel (kiindulási TSH 2,21 ± 0,13 μIU/ml), és az LT4 dózist különböző terápiás célokra (0,34–2,50, 2,51–5,60 és 5,61–12,0 μIU/ml) 6 hónapig módosították. . Ez a tanulmány nem mutatta ki az EE jelentős különbségét a kezelés végén [52]. Ezzel szemben az adatok másodlagos elemzése kimutatta, hogy a REE/sovány testtömeg növekedése korrelált közvetlenül a szabad T4 és a szabad T3 szint növekedésével és fordítva a TSH szinttel.
Összességében az adatok azt mutatják, hogy az LT4 terápia változásai a klinikán általánosan használt tartományon belül nem elegendőek ahhoz, hogy mérhető változást hozzanak létre az EE felvételekben, míg a T3 és az EE keringő szintje között jó összefüggés van. Érdekesség, hogy egy kísérletben [53], amelyben az LT4-et a liothyronine farmakokvivalens dózisával helyettesítettük (amint azt a TSH 0,5–1,5 μIU/ml-en belül jelzi), a keringő T3 szintek jelentős növekedését és erőteljes fogyást figyeltünk meg. Ezzel szemben nem figyeltek meg figyelemre méltó különbséget EE-ben (szellőző burkolat módszerrel mérve). Ez a látszólagos paradoxon a készülék relatív érzékenységének viszonylagos hiányával és azzal magyarázható, hogy nem képes megragadni az EE komponensek teljes spektrumát.
C. A TH-vel szembeni rezisztencia és az energia-anyagcsere szindrómái
Az RTH szindrómákon kívül az 1A típusú pseudohypoparathyreosis [63], amelyet a G-protein szignáltranszdukciós komplex stimuláló alegységét kódoló GNAS gén anyai örökölt funkcióvesztése okoz, a TSH-val szembeni enyhe rezisztenciával és ezért a hypothyreosis relatív állapotával, ami viszont az EE csökkenéséhez vezet, hozzájárulva elhízott fenotípusukhoz. Számos más mechanizmust és kapcsolódó állapotokat is leírnak, amelyek valószínűleg hozzájárulnak a végső klinikai eredményhez, ideértve az étel csökkent termikus hatását [64] és az inzulinrezisztenciát.
Érdekes módon a deiodináz aktivitás általános csökkenése az SBP2 gén mutációi miatt a hypothyreosis, a myopathia enyhe formáját idézi elő, és a reaktív oxidatív fajok metabolizmusának általános csökkenése [65, 66] inkább a boldogulás sikertelenségével jár [67], mintsem, amint az várható volt, a T3 szint relatív csökkenésétől, ami a T4 átalakulása T3 konverzióvá vált. Legjobb tudomásunk szerint ezeknél a betegeknél nem végeztek hivatalos EE-felmérést, és lehetséges, hogy a szindróma komplex multiorganikus megnyilvánulása megdönti az EE előre jelzett csökkenését.
D. A TH tengely funkcionális adaptálása az energia állapotához
Megpróbálták a T3 pótlását súlycsökkentő beavatkozások során, vagy terápiás alkalmazásával szuprafiziológiai dózisokban, amelyek célja az EE fenntartása vagy növelése, a súlycsökkenés és a posztintervenciós testsúly fenntartásának megkönnyítése érdekében [75], és a táplálék-kiegészítőkben alkalmanként veszélyesen magas TH-dózisok találhatók [ 76], a liothyronine keskeny terápiás indexe és a kardiovaszkuláris mellékhatásokkal való összefüggése [77] megakadályozta ezt az alkalmazást. Ezzel szemben egy 29 gyakori fogyókúrás kiegészítés újabb elemzése sokkal kisebb T3 vagy T4 mennyiséget mutatott ezekben a termékekben, valószínűleg a fokozott tudatosság miatt [78]. Mindazonáltal a szövet- vagy receptor-specifikus tiromimetikumok [79] alkalmazása kiküszöbölheti ezeket a hiányosságokat.
Az energiát eloszlató szervekre gyakorolt közvetlen hatásától eltekintve a TH kulcsfontosságú szabályozó szerepet játszik a központi idegrendszerben. A legújabb tanulmányok azt mutatják, hogy a hipotalamuszban a TH hatás szabályozza a májban és a BAT anyagcseréjét a szimpatikus és a paraszimpatikus ágakon keresztül. A paraventricularis magban lévő T3 szimpatikus máj-beidegzéssel szabályozza a glükóztermelést és a máj inzulinérzékenységét. Ezzel szemben a ventromediális magban lévő T3 szimpatikus idegrendszer által közvetített BAT aktivációt vált ki. Megállapítást nyert, hogy az adagolás időzítése és az útvonal, valamint a T3 akut és krónikus alkalmazása szintén hozzájárul a TH központi idegrendszeri hatásának hatásához [80].
4. Következtetések
A TH energiacserére gyakorolt hatása átterjedt és jól felismerhető a klinikailag nyilvánvaló pajzsmirigy-diszfunkcióban. Az enyhe pajzsmirigy-diszfunkció EE-re és az energia-anyagcserére gyakorolt hatásainak relatív hiánya valószínűleg az EE és annak összetevőinek értékelésére használt eszközök relatív érzéketlenségének tudható be. A TH tengely modulálása az EE-vel kapcsolatos tevékenységeinek kiaknázására továbbra is az aktív kutatás és az ígéretes gyógyszerfejlesztés területe.
- A testösszetétel paramétereivel kapcsolatos pajzsmirigyhormonszintek eutireoid felnőtteknél
- Üdvözöljük a tudományos archívumban a neurogén elhízás energiakiadásaival és táplálkozásával kapcsolatban
- Az elhízott irodai dolgozók „walk-and-work” íróasztalának energiafelhasználása Brit
- Az egyszerűsített egyhetes alacsony jódtartalmú étrend és egyhetes pajzsmirigyhormon megvonás hatékonysága
- A sushi a pajzsmirigy betegségéhez kapcsolódik