Strukturális perspektíva a betegségekkel összefüggő genetikai változatok molekuláris funkcióinak feltárására és megváltoztatására
Absztrakt
1. A mutációk hatása a stabilitásra és a kötődésre
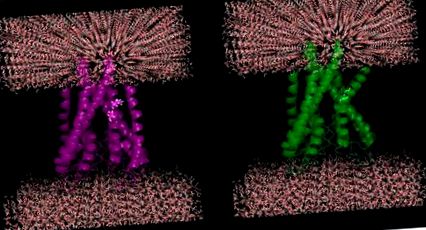
A membránfehérjék mutációinak hihető hatása: Helikális törés következik be két egymást követő maradék (100-Ile, 101-Thr) in silico mutációi miatt a glicinné (helix-megszakító) egy KcsA káliumcsatorna fehérjében (PDB ID: 1J95).
2. Mutáció és kompenzációja: Strukturális plaszticitás és konformációs relaxáció
A globuláris fehérjék mutációinak hatása: hét mag (hidrofób) metioninná mutált maradék (bal oldali panel: natív, jobb: mutáns) a T4-fág lizozim fágjában, de a redő megmarad szinte minden jelentős torzulás nélkül. Ez a fehérjék „szerkezeti relaxációja” miatt következik be, a konformációs plaszticitásuk miatt (alkalmazkodóképesség a változásokhoz).
3. Az IDP-k mutációi a globuláris és a membrán fehérjékhez képest
A rendezetlen fehérjék mutációinak hatása. Négy átmeneti (lebegő) sóhíd, amely töltéses maradékokat képez (1-Asp, 6-His, 16-Lys, 28-Lys), alaninná mutálódva a béta-amiloidban (Aβ42), ami a sóhidak szétszerelését eredményezi az egész szerkezeti együttesben ( Bal oldali panel: mutáns a jobbhoz képest: natív). Ezek az átmeneti sóhidak folyamatosan változtatják partnereiket az egész szimulációs pályán, támogatva a különböző konformációkat különböző időpontokban és ezáltal egy konformációs együttest támogatva (ezt a referencia 3. ábrája szemlélteti [19]). A bal oldali panelen (natív) sárga szaggatott vonalak mutatják az öt véletlenszerűen kiválasztott konformerben (4 Å-en belül) egyenként megtalálható sóhidakat, míg ugyanezeket a kapcsolatokat a jobb oldali panel vékonyabb cián szaggatott vonalai mutatják, amelyek ezek hiányát mutatják be. ionos kölcsönhatások (jóval nagyobbak, mint 4 Å). A molekuláris dinamika szimulációs pályái a referenciából gyűjtöttek [19]. Röviden, az explicit-víz molekuláris dinamikus (MD) szimulációt AMBER 12-vel T = 300 K hőmérsékleten hajtottuk végre, ff99SB erőtérrel, periodikus peremfeltételekkel és TIP3P vízmodellel. A Pymol-ban rekonstruált ábra.
A mutációk osztályozásának másik hatékony és fontos módja a mutáció tényleges következményén alapulhat, hogy pusztán megzavarja-e egy fehérje szerkezeti integritását [52], vagy befolyásolja-e a fehérje funkcióit. Például a proximális csoportok együtt fejlődhetnek egy fehérjehajtásban a globális stabilitás megőrzése érdekében, míg a pontmutációk (ideértve az inszerció-deléciókat) potenciálisan finomhangolhatják a fehérje működését, módosítva a funkcionális helyeket és a fehérje kölcsönhatásokat [53]. A funkcionális mutációk ismét lehetnek proximálisak vagy közvetlenek a katalitikus/aktív helyre [54,55], valamint disztálisak (alloszterikusak és szabályozók). Megállapították, hogy a disztális mutációk a fehérje egészében továbbterjednek, befolyásolva mind a dinamikáját, mind a katalízisét, ahol az alacsony frekvenciájú torziós rezgések [56, 57] kulcsfontosságúnak tűnnek. Mutációs forró pontokat [58] azonosítottak (például humán monoacil-glicerin-lipázban, humán DNS-polimeráz β-ban) a fehérje konformációs dinamikájában az ilyen nagy hatótávolságú kommunikációs csomópontok alapján [59,60,61]. Ezek az információk potenciálisan megkönnyíthetik terápiás értékű új ligandumok kifejlesztését is [59].
4. A mutációk szerepének vizsgálata a betegségekben: a termodinamikai paraméterek változásainak nyomon követése
5. A mutációk statisztikai osztályozása a károsodás mértéke alapján
6. A betegségeket okozó genetikai változatok hatásainak enyhítése és klaszterezése a kábítószer-tervezéssel kapcsolatban
A gyógyszertervezési módszertanban a betegség specifikus mutációinak célzása és a mutációs hatások együttes felismerése nagy jelentőséggel bír, különösen a célfehérje strukturális információkat igénylő megközelítéseknél. Ingyenes energiaszámítási módszereket használnak a mutációk domináns hatásainak meghatározására, függetlenül attól, hogy befolyásolják-e a fehérje stabilitását, a fehérjéhez való kötődést vagy mindkettőt. A mutációk molekuláris szintű hatásának mélyreható elemzésével a célfehérjékben a betegséget okozó mutációkat tovább csoportosíthatják azok fő hatásai, például destabilizáló mutáció, katalitikus mutációk, dimerizációt befolyásoló mutációk vagy fehérje-konformációk [102,103,104 ]. Az ilyen típusú osztályozás elősegítheti a hasonló hatású mutációk bizonyos csoportjai számára a gyógyszerek tervezését, és így a diagnózis és a terápia szélesebb spektrumára alkalmazható.
7. Szerkezet-alapú megközelítés a gyógyszertervezésben
A struktúra-alapú gyógyszertervezés (SBDD) az a számítási megközelítés, amely a biológiai célok 3D-s struktúráinak ismeretére támaszkodik (4. ábra) a klinikai vizsgálatokhoz alkalmas potenciális kémiai szerkezet azonosításához vagy megtervezéséhez [100,105]. A genomi, funkcionális és strukturális információk robbanásával az elmúlt évtizedekben a 3D szerkezetű biológiai célpontok többségét azonosították és ösztönözték a szerkezet alapú megközelítések alkalmazását a jelenlegi tervezési folyamatban. Az SBDD népszerű a virtuális szűrés során, hogy kiszűrje a gyógyszerszerű vegyületeket a kis molekulák nagy könyvtárából, beleértve a széles körben alkalmazott megközelítéseket, például a dokkolást és a struktúrán alapuló farmakofór-tervezést [105]. Míg a bevett nagy áteresztőképességű szűrés (HTS) [106] lehetővé teszi a vegyületek széles körének (akár milliók) automatikus tesztelését, az alacsony sikerességi ráta és a magas költségek együttesen korlátozzák alkalmazását. Alternatív megoldásként számítási megközelítéssel csökkenthetjük a tesztelés alá vont vegyületek számát [105,106], ahol a dokkolás és a struktúrán alapuló farmakofor tervezés a két legnépszerűbb megközelítés, amely káros mutációkat céloz meg.
A gyógyszerfelfedezési folyamat sematikus bemutatása a betegséget okozó mutációk hatásainak enyhítése érdekében.
7.1. Dokkolás
A p53 mutáns aktivitásának megmentése a sztikus sav megkötésével a nyitott L1/L3 zsebbe. A reprezentatív sémát a p53 mag domén komplex DNS-sel (PDB: 1TSR) felhasználásával állítják elő. A gömbábrázolt atomok a sztinsavhoz tartoznak egy adott dokkolt pózban (a heteroatomok színezettek a kiméra alapértelmezett színezési sémája szerint). A DNS-bázisok kék négyzetekként vannak ábrázolva.
A rákkutatás mellett a dokkoló alapú szűrést is alkalmazták ritka betegségek esetén. A Snyder – Robinson-szindróma (SRS) egy ritka, X-hez kapcsolódó mentális betegség, amelyet egy fontos emberi enzim, a spermin-szintáz hibás működése okoz [118]. A spermin-szintáz homo-dimerként funkcionál, és a dimerizációt befolyásoló mutációk, például a G56S, kimutatták, hogy megszüntetik az enzimaktivitást, és ez a betegséget eredményezi [96,118]. A legújabb munkák a dimer stabilizátorok célzott azonosítását célozták meg a mutáns homo-dimer interfészhez kötődve [119]. Ehhez a dokkoló alapú virtuális szűréshez integrált nagy kereskedelmi vegyület könyvtárakat használtak a dimer reprezentatív szerkezeteivel [119]. A legjobban rangsorolt 51 vegyületet ezután kísérleti szűrővizsgálatnak vetették alá, amelyek közül három legmagasabb rangú vegyület (más néven „ólom”) 30% -ig fokozza a katalitikus aktivitást [119, 120].
7.2. Szerkezet-alapú farmakofór-tervezés
A farmakofor modellek segítségével absztrakt szterikus és elektronikus tulajdonságok együttese állítható elő, amelyek a makromolekuláris (célfehérje) kölcsönhatásokat képviselik a gyógyszerszerű kis molekulákkal [121, 122]. Más szavakkal, ezen jellemzők, például hidrofób centridák, aromás gyűrűk és hidrogénkötések háromdimenziós elrendezése képviseli a ligand és a cél közötti kötési módot [122, 123]. A farmakoforákat az aktív ligandumok közös jellemzőiből állítják elő, amelyeket azonosíthatunk ligand-cél komplexek vagy ismert aktív molekulák konformereinek összehangolásával vagy egymásra helyezésével [123]. Több degenerált atommodell potenciálisan kinyerhető a farmakofor modellező programokból, amelyek további optimalizálást és validálást igényelnek a legjobb kiválasztásához. A farmakofor modelleket általában az aktív kis molekulák virtuális szűrésére használják nagy vegyület-adatbázisokból [121, 122, 123]. Az ilyen megközelítések hatékonyabbak lehetnek, mint bizonyos célpontok dokkolása, különösen akkor, ha nagyszámú létező ismert hatóanyag áll rendelkezésre [124,125,126].
Így a farmakofora lényegében meghatározza az aktív ligandumok közötti interakciós keretrendszert, és azok specifikus célpontjai [121, 122] és a megfelelő modellek csak az aktív ligandumok könyvtárakkal is felépíthetők, a cél 3D struktúrájának hiányában - ezt a megközelítést úgy hívják, hogy ligandum alapú farmakofor. A modellek ezután kiképezhetők az aktív és inaktív molekulák megkülönböztetésére [121]. Valójában ez szolgál a farmakofór modellek virtuális szűrés során történő széles körű alkalmazásának elsődleges okaként, különösen akkor, ha a célstruktúra hiányzik. Ezenkívül, mivel a farmakofor modell az „aktív vegyületek és a cél kölcsönhatása” kötődését (vagy kölcsönhatásának térképét) képviseli, ez elfogadható kapcsolatot biztosít a szerkezet és a ligandum aktivitása között, és segíthet az alapul szolgáló biokémiai mechanizmus tisztázásában a tervezés további irányítása érdekében. az új hatóanyagok közül [122]. Például a különböző farmakológiai tulajdonságok feltárásával a legújabb tanulmányok úgy tűnt, hogy javítják a meglévő farmakofor és a tervezett új epidermális növekedési faktor receptor (EGFR) inhibitorok hatékonyságát, amelyeket potenciálisan gátolhatnak az elsődleges mutánsok (L858R, del9) és a gyógyszerrezisztens mutánsok, mint pl. L858R/T790M [128].
8. Ligand-alapú megközelítések a gyógyszertervezésben
A célfehérje (k) strukturális információinak hiányában a fent említett struktúra alapú megközelítések nem biztos, hogy alkalmasak a gyógyszer tervezésére. Alternatív megoldásként ligandum alapú gyógyszerterv (LBDD) alkalmazható az ilyen esetek segítésére [131,132,133,134]. A ligand alapú módszerek csak az ismert ligandumok fizikai-kémiai tulajdonságainak elemzésére összpontosítanak, amelyek kölcsönhatásba lépnek az érdeklődési körrel. A legnépszerűbb megközelítések azonban a kvantitatív szerkezet-aktivitás kapcsolat (QSAR) modellek és a ligandum alapú farmakofor modellezés [134]. A mutáns fehérjék megcélzása szempontjából az LBDD hatékony lehet olyan új mutációk esetében, amelyeknek hatásait még nem vizsgálták.
9. A kábítószer-tervezés segítése a globuláris, membrános és rendezetlen fehérjék mutációinak ismeretében
A betegséggel összefüggő mutációk molekuláris mechanizmusának megértése közvetlenül alkalmazható a gyógyszer tervezésében [91, 101]. A strukturális biológia kulcsfontosságú volt az ilyen megértésben, hatékonyan hozzájárult a gyógyszer korai felfedezéséhez [140], valamint a betegséggel összefüggő mutációk és a gyógyszerekkel szembeni rezisztencia hatásait is rákos megbetegedésekben és fertőző betegségekben. A mutációk globuláris, membrános és rendezetlen fehérjékre gyakorolt különböző hatásaira vonatkozó információk előnyösen szolgálhatnak a legmegfelelőbb és leghatékonyabb stratégia kiválasztásához és alkalmazásához a potenciális gyógyszerszerű molekulák tervezéséhez minden egyes esetre. A betegségek többsége közvetlenül kapcsolódik a mutált fehérjék kötési stabilitásának vagy hajtásstabilitásának megváltozásához [63] - amelyet szabad energiák megkötése vagy hajtogatása indokol. Ezek az információk azt is jelzik, hogy a mutációk mennyiben zavarják a fehérje kölcsönhatásokat vagy a szerkezeti integritást, fontos útmutatást nyújtva a stabilizátorok és/vagy inhibitorok kialakításához a mutációk káros hatásainak enyhítése vagy megszüntetése érdekében.
Ezenkívül a célfehérjék 3D-s struktúráinak nagy előnye, hogy MD-szimulációkkal kombinálva a szabad energia számításaiban felhasználják a mutációs hatások alapjául szolgáló strukturális mechanizmus (például a hidrofób mag megszakadása vagy a hidrogénkötés elvesztése) alapos vizsgálatát. kötés vagy hajtogatás. Amint azt egy korábbi szakaszban tárgyaltuk, ezeket az információkat sikeresen felhasználták a helyes gyógyszerszerű molekulák azonosításához, amelyek a Snyder – Robinson-szindrómával (SRS) kapcsolatos mutációkat célozták meg. Az SRS-t az emberi enzim, a spermin-szintáz (egy globuláris fehérje) hibás működése okozza, ahol az ismert létező káros mutációk a molekuláris mechanizmusok széles skálájával, például dedimerizációval, a monomer destabilizálásával és a a katalitikus mag [96,119,120,141].
A kábítószerekkel szembeni mutációs ellenállás sok sikeres gyógyszer életét is korlátozza. Az ilyen ellenállás leküzdésére szolgáló új gyógyszerszerű molekulák megtervezésének alternatívájaként olyan stratégiákat fejlesztettek ki, mint például az együttes alapú fehérje kialakítása [142], amelyeket a fejlesztési folyamat elején alkalmazni kell, hogy előre jelezzék és legyőzzék a lehetséges mutációs mutációk hatásait. rezisztencia (pl. a Staphylococcus aureus dihidrofolát-reduktázában). Az ilyen tervezési protokoll kettős tulajdonsággal rendelkezik, nevezetesen pozitív kialakítással a katalitikus funkció fenntartása érdekében, és negatív kialakítással, amely egyidejűleg zavarja az ólom inhibitor kötődését.
A fehérje konformációjának és dinamikájának változása szintén szorosan összefügg az emberi betegségek jelentős számával [143 144 445]. A számítási megközelítések, például az MD vagy a Mote Carlo (MC) szimulációk, hatékony eszközök a fehérjedinamika tanulmányozására. A mutációk sokféleképpen megváltoztathatják a fehérje dinamikáját, például a helyi rugalmasság megváltoztatásával, a konformációs állapotokban való átmenetsel, az alloszterikus szabályozásokkal stb. molekulák [91]. A destabilizáló mutánsok kísérleti struktúráinak megoldása gyakran nehéz, főleg a membránfehérjék esetében, a bennük rejlő oldhatatlanság és instabilitás miatt [146, 147], és ilyen esetekben a mutáns struktúrák molekuláris modellezése adhat néhány iránymutatást a mutációs hatásokról. Az ilyen alternatív struktúrákat gyakran a vegyes könyvtárak dokkolásának vetik alá a virtuális szűrés során - ezt a módszertant „együttes alapú gyógyszertervezésnek” nevezik [148,149]. Különösen azoknak az országon belül áthelyezett személyeknek, ahol határozottan hiányzik az elrendezett struktúrák, a molekuláris modellezést és az MD szimulációt együttesen széles körben alkalmazták a reprezentatív strukturális együttes visszaszerzésére a struktúra-alapú gyógyszertervezés során [145,150].
Másrészt a nagy áteresztőképességű szűrés és a racionális gyógyszertervezés jelentősen elősegítette a gyógyszermembránfehérje kölcsönhatásokat, mivel hozzáférhetők a sejtfelszínen, és közvetlenül megváltoztathatják a sejtjelzést [151]. Valójában ez a legfontosabb ok, amiért a terápiás szerek többsége megcélozza a membránfehérjéket. Az olyan technikák, mint az alanin-szkennelés, szintén a stabilizáló mutációk azonosítását szolgálták a membránfehérjék számítási tervezésében, valamint a gyógyszerfejlesztésben [152]. Ebből a célból olyan keretrendszereket fejlesztettek ki, mint például a RosettaMP, hogy általános membránábrázolást biztosítsanak, amely kapcsolódik a pontozáshoz, a konformációs mintavételhez és a mutációs rutinokhoz, nagyszerű könnyűséget és rugalmasságot kínálva az új tervezési protokollokba történő integrálásukhoz [153]. A peptid architektonika [154] viszonylag új adalék volt a témában, ahol az ötlet egy natív peptid szekvenciáinak szelekciója volt, amely szelektíven toxikus önmagában a patogén membránfehérjék felé. A gyógyszeres kezelés alternatívájaként (mivel a transzmembrán fehérjékről gyakran hiányoznak a strukturális információk) a fehérje terápiás gyógyszerek tervezésével [147] is kísérletet tettek a fehérje célpontok membránjára, bár teljes potenciálját még fel kell tárni.
10. Következtetések
Szerző közreműködései
E.A. fogant a probléma. S.B. és Y.P. elvégezte az irodalmi felmérést, és az írást E.A. segítségével írta. S.B. megszervezte a kéziratot, és a revíziók során kiterjedten szerkesztette. Minden szerző elolvasta és jóváhagyta a végleges kéziratot.
Finanszírozás
A munkát az NIH 1R01GM125639 számú támogatásával támogatta.
- Quercetin és Epigallocatechin Gallate az elhízás megelőzésében és kezelésében a molekulától a
- A nyers Törökországhoz kapcsolódó szalmonella-járvány 26 államot sújtott, azt mondja a CDC alakja
- A csapat azonosítja az antipszichotikus gyógyszerekhez kapcsolódó súlygyarapodási receptort
- A dohányzás hiánya a „korai” és a „késői” dohányosoknál és a memória funkciói a SpringerLink
- ÉRZÉKELŐ INTENZITÁS A HEDONIKUS FUNKCIÓK KLASSZIKUS PSZICHOFIZIKAI MEGKÖZELÍTÉSEI - MOSKOWITZ - 1982