A béllúgos foszfatáz, az étrend, a bélmikrobák és az immunitás kölcsönhatása
Levelezés: Deanna L Gibson, PhD, adjunktus, Biológiai Tanszék, University of British Columbia Okanagan, Kelowna V1V 1V7, British Columbia, Kanada. [email protected]
Telefon: + 1-250-8078790 Fax: + 1-250-8078005
Absztrakt
Alap tipp: A bél lúgos foszfatáz (IAP) fontos a bél egészsége szempontjából. Az IAP szerepe a bélben egyaránt magában foglalja a szisztémás fertőzések és a krónikus gyulladásos betegségek, például a gyulladásos bélbetegségek elleni védelmet. Az IAP, az étrend, a mikrobiota és a bélhám között bonyolult kölcsönhatás lép fel, amely felgyorsította az IAP kutatását, mint potenciális terápiát ezen sérülések ellen. Jelen áttekintés célja az IAP alapvető jellemzőinek kiemelése a homeosztázis fenntartásában a belekben, miközben foglalkozik az IAP, az étrend, a mikrobiota és a bélhám komplex kölcsönhatásával.
BÉRBELI ALKALIN-FOSZFÁZIS
Az alkalikus foszfatázok (AP) olyan hidroláz enzimek, amelyek katalizálják a monofoszfát-észterek lebontását foszfátcsoportjaik eltávolításával. Az AP-ket két osztályba sorolják: a szövetben nem specifikus alkalikus foszfatázok (TNAP), amelyek csontban expresszálódnak; máj; és vese- [1] és szövetspecifikus izozimek, amelyek magukban foglalják a placenta alkalikus foszfatázt (PLAP), a csírasejt alkáli foszfatázt; és a béllúgos foszfatáz (IAP).
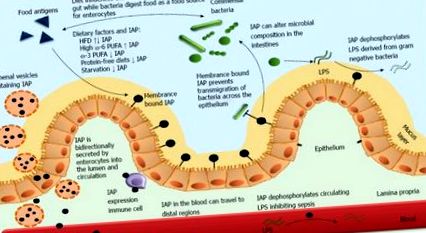
A bél lúgos foszfatáz szabályozza a bél homeosztázisát. Az enterociták által kiválasztott intesztinális alkalikus foszfatáz (IAP) létfontosságú szerepet játszik a bélben és annak körüli különböző fiziológiai funkciókban. Noha főleg membránhoz kötött, az IAP mind a lumenben, mind a vérben megtalálható. Az IAP-molekulák magas koncentrációja a fehérjében gazdag lumenális vezikulákban van jelen a hám lumenális és apikális oldalán. Az IAP mind a lumenális, mind a keringő lipopoliszacharidokat (LPS) defoszforilálja, amelyek a gram-negatív baktériumok sejtfalából származnak, és hatékonyan megszüntetik toxikus alkotórészüket. Laboratóriumunk és mások előzetes munkája azt mutatta, hogy a lamina propriában infiltrált immunocitákon expresszálódott IAP. Az IAP szintén kulcsfontosságú a baktériumok hámrétegen keresztül történő vándorlásának megakadályozásában, megakadályozva az immunociták downstream aktiválódását és az azt követő gyulladásos válaszokat. Az IAP táplálékkal, kommenzális baktériumokkal és immunsejtekkel való összetett kapcsolata révén alapvető szerepet játszik a bél homeosztázisában.
Az IAP az evolúció szempontjából leginkább konzervált AP-k között, amelyek aminosav-szekvenciájának 89,5% -át megosztják a PLAP-val [13], emberben ezek a gének a 2. kromoszómán helyezkednek el [14]. Ezzel szemben a TNAP-típusok aminosavainak csak 50% -át osztják meg az IAP-val [13], és a 4. kromoszómán helyezkednek el [14]. Ez evolúciós megosztottságot jelez a szövet-specifikus és a szövet-nem-specifikus izotípusok között. Emberekben az IAP enzimet az ALPI gén kódolja [15], míg egerekben két izozimet azonosítottak: duodenális IAP (dIAP) és globális IAP (gIAP). Az egér dIAP és gIAP 79% -ban genetikai homológiát mutat [16], ezeket az Akp3, illetve az Akp6 gének kódolják [17,18]. Patkányokban két ismert IAP izozim is létezik: az alpi1 és az alpi2 gének által kódolt IAP I és IAP II. A filogenetikai összehasonlítások azt mutatják, hogy az egér gIAP hasonlít mind az egér dIAP-hoz, mind a patkány IAP I-hez, de nem az emberi IAP-hoz. Általában a legtöbb egérvizsgálat általában az IAP-ra összpontosított, és nem a specifikus izoformákra, és ennek következtében az egyes izozimok specifikus funkciói rosszul értettek. A legutóbbi felülvizsgálatok rámutattak az IAP fontosságára a bél homeosztázisában [19,20].
IAP, lipopoliszacharid és fertőzés
IAP és gyulladás
IAP ÉS KRÓNIKUS GYULLADÓ BETEGSÉGEK
A bél homeosztázisa létfontosságú a kiegyensúlyozott anyagcsere fenntartásához, nem meglepő, hogy az endogén IAP-t nemrégiben bevonják a metabolikus szindrómákba [36]. Kaliannan és mtsai [36] elegáns vizsgálatsorozatában kimutatták, hogy az IAP knock-out (KO) egerek a metabolikus szindróma olyan jellemzőit mutatják be, mint: elhízás, emelkedett vércukorszint, endotoxémia, glükóz intolerancia és hiperinsulinémia. Az orális IAP-val történő kiegészítés mind a KO egerekben, mind a HFD által kiváltott metabolikus szindróma modelljeiben képes volt megakadályozni és visszafordítani ezeket a körülményeket.
IAP, MIKROBIOTA ÉS BELZETI HOMEOSTÁZIS
ÉLELMISZER ÉS IAP KAPCSOLAT
A fehérjefogyasztás szintén fontos szerepet játszhat az IAP szabályozásában. A fehérjetartalmú étrenddel táplált patkányok az IAP aktivitását 36-38% -kal csökkentették [43]. Ebben a kísérletben azonban a patkányok étrendje magas keményítőtartalmú volt, ezért az IAP szintje a magas szénhidrátszint miatt, és nem a fehérje hiánya miatt potenciálisan megváltozhat. Ezek az eredmények együttesen azt sugallják, hogy az étrend és az IAP aktivitása komplex kölcsönhatásban áll egymással, és hogy a testreszabott étrend előnyös lehet az IAP szintjének szabályozásában.
IAP, mint terápiás szer
Egyre több bizonyíték van arra, hogy az IAP beadása fertőzés és gyulladás során új terápiás stratégia lehet a betegség szövődményeinek csökkentésében. Az IAP-kiegészítés szintén hatékony eszköz lehet az antibiotikumokkal összefüggő fertőzések, például a C. difficile-asszociált betegségek (CDAD) növekvő problémájának leküzdésében. Ennek alátámasztására kimutatták, hogy egerekben az IAP orális adagolása antibiotikumokkal egyidejűleg teljesen megakadályozza a CDAD-ot, valamint más enterális kórokozókat, mint például a Salmonella Typhimurium [37]. Ez kritikus jelentőségű, mert az antibiotikumok beadása mikrobiális egyensúlyhiányt idézhet elő a bélben, amelyet dysbiosisnak neveznek. Ez kedvező környezetet teremt a kórokozók számára, és növeli a gazdaszervezet fertőzésre való hajlamát.
Asztal 1
Összefoglalás a befejezett és folyamatban lévő klinikai humán vizsgálatokból exogén szarvasmarha-bél lúgos foszfatáz alkalmazásával
- Magas lúgos foszfatáz tünetek; Hogyan lehet csökkenteni - SelfHacked
- A bélhibák étrendje befolyásolhatja a bélpermeabilitási tanulmányt
- Vegye fel ezt az 5 gyógynövényt az étrendjébe a jobb immunitás érdekében Health Food Manorama English
- A fekélyek gyógyítása lúgos étrenddel
- Javítsa immunitását az étrend és az életmód megváltoztatásával