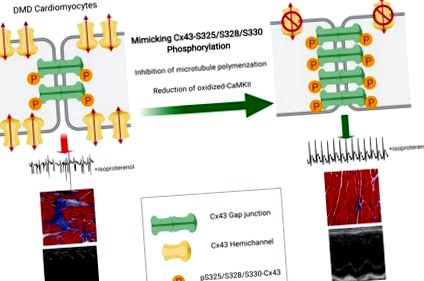
A connexin-43 átalakításának megelőzése véd a Duchenne izomdisztrófia kardiomiopátia ellen
Eric Himelman
1 Sejtbiológiai és Molekuláris Orvostudományi Tanszék,
Mauricio A. Lillo
2 Farmakológiai, élettani és idegtudományi tanszék és
Julie Nouet
1 Sejtbiológiai és Molekuláris Orvostudományi Tanszék,
J. Patrick Gonzalez
1 Sejtbiológiai és Molekuláris Orvostudományi Tanszék,
Qingshi Zhao
1 Sejtbiológiai és Molekuláris Orvostudományi Tanszék,
Lai-Hua Xie
1 Sejtbiológiai és Molekuláris Orvostudományi Tanszék,
Hong Li
3 Fejlett Proteomikai Kutatóközpont, New Jersey Medical School, Rutgers Biomedical and Health Sciences, Newark, New Jersey, USA.
Tong Liu
3 Fejlett Proteomikai Kutatóközpont, New Jersey Medical School, Rutgers Biomedical and Health Sciences, Newark, New Jersey, USA.
Xander H.T. Wehrens
4 Molekuláris élettani és biofizikai tanszék, Orvostudomány, Idegtudomány és Gyermekgyógyászat, Kardiovaszkuláris Kutató Intézet, Baylor College of Medicine, Houston, Texas, USA.
Paul D. Lampe
5 Fred Hutchinson Rákkutató Központ, Transzlációs Kutatási Program, Közegészségügyi Tudományok Osztálya, Seattle, Washington, USA.
Glenn I. Fishman
6 Leon H. Charney Kardiológiai Osztály, New York University Langone Health, New York, New York, USA.
Natalia Shirokova
2 Farmakológiai, élettani és idegtudományi tanszék és
Jorge E. Contreras
2 Farmakológiai, élettani és idegtudományi tanszék és
Diego Fraidenraich
1 Sejtbiológiai és Molekuláris Orvostudományi Tanszék,
Társított adatok
Absztrakt
Absztrakt
Bevezetés
A legutóbbi vizsgálatok során megfigyeltük a Cx43 fehérje upregulációját és lateralizációját az emberi és egér (mdx) DMD szívszövetekben (24–26). A DMD szívlizátumok a gyorsabban vándorló, nem foszforilezett Cx43 izoformák megnövekedett szintjét mutatják az SDS-PAGE-n, ami jelzi a rés junctionális szabályozás változását (27). Izoproterenol (Iso) alkalmazásával kapott β adrenerg stimuláció súlyos szívritmuszavart és korai halált okozott mdx egerekben, míg a WT egerek nem voltak hatással. A Cx43 hemicsatornákhoz szelektíven kötődő és működését gátló peptid-utánzó szerek (16) megvédték az izo-provokált mdx egereket az aritmogenezistől és a kapcsolódó halálozástól (24). Továbbá, a disztrófiás egerekben a Cx43 genetikai redukciója normalizálta a szív Cx43 fehérje szintjét a WT szintjére, csökkentette a Cx43 átalakulását és megmentette a szív fenotípusát (26).
Eredmények
Az S325/S328/S330-Cx43 hipofoszforilezése DMD szívekben.
(A) Reprezentatív Western blot és a WT és mdx kamrai lizátumok mennyiségi meghatározása, amelyeket pan-Cx43 (felső), pS-Cx43 (középső) és vinculin (terhelés kontroll, alsó) szondákkal vizsgáltunk. n = 7 mindkét csoportban. *** P 1D ábra). Továbbá megfigyeltük a Cx43 átalakulását humán DMD szakaszokban (1E. Ábra), (24), míg a pS-Cx43 az ID-kre szorítkozott (1F. Ábra). Ezek az eredmények együtt azt sugallják, hogy az S325/S328/S330 foszforiláció csökkentése, amely a Cx43 átalakulásának kulcsmechanizmusa más szívbetegségekben, szintén fontos szerepet játszhat a DMD Cx43 átalakításában.
A pS-Cx43 in vivo szerepének vizsgálatához kereszteztük a genetikailag módosított egerek bevett vonalát, ahol a szerin triplett vagy nem foszforilálható alaninná (S3A) vagy foszfo-mimetikus glutaminsavakká (S3E) mutálódott WT (20) és mdx egerekkel. . A homozigóta Cx43-S3A (Cx43 S3A/S3A), Cx43-S3E (Cx43 S3E/S3E) és Cx43-WT (Cx43 WT/WT) alomtársakat mind WT, mind mdx háttérben fenntartottuk. A Cx43-S3E mutáns egerek rezisztensek az ischaemia által kiváltott rés junkcionális átalakulással szemben (20). A foszfo-mutáns egerek szívszövetéből készített fehérjekivonatok változásokat mutattak a Cx43 fehérje migrációban SDS-PAGE-n (Kiegészítő 1B. Ábra). Mind a WT: Cx43-S3E (WTS3E), mind az mdx: Cx43-S3E (mdxS3E) lizátumok kiemelkedő lassabban vándorló P2 és P3 Cx43 foszfo-izoformákat tartalmaznak, hiányzó P0 sávval. A különféle foszfo-izoformák a Cx43-at reprezentálják, elsősorban a sejtközlésben részt vevő réspontokban (30, 32). Ezzel szemben a Wx3A és mdxS3A lizátumokban lévő Cx43 gyorsabb elektroforetikus migrációt mutat, és a P1 és a P0 foszfo-izoformákra korlátozódik. Dystrophint nem detektáltunk a kontroll és a foszfo-mutáns mdx szívekben (Kiegészítő 1B. Ábra).
Az MdxS3E egereket védjük a Cx43 átalakításától.
Az MdxS3E egereket védjük a súlyos ritmuszavaroktól a β-adrenerg fertőzés után.
A DMD-s betegeknél gyakran súlyos kamrai aritmiák jelentkeznek, amelyek hozzájárulhatnak a hirtelen szívhalálhoz (34). A felnőtt mdx egerek szintén érzékenyek aritmiákra és letalitásra az Iso β-adrenerg agonistával végzett akut szívprobléma után (24, 26, 35). Korábban kimutattuk, hogy az Iso fokozza a Cx43 lateralizációját in vivo, ami arra utal, hogy a foszforilezés (vagy annak hiánya) szintén szerepet játszhat a stressz alatti átalakítási folyamatban (24). Így teljes állati EKG-ket rögzítettünk Iso-fertőzés előtt és után 4–6 hónapos WT, mdx, mdxS3A és mdxS3E egerekben, hogy értékeljük az EKG paramétereinek változását és figyelemmel kísérjük az aritmogenezist.
Az RR intervallum által megadott kiindulási pulzus (HR) emelkedett mdx egerekben (RR = 126,9 ms) a WT-vel összehasonlítva (147,5 ms, P = 0,0004, 3A. Kiegészítő ábra), más vizsgálatokkal egyetértésben (36). Az MdxS3A mutatta a leggyorsabb alap HR értéket (RR = 122,1 ms, P 3A ábra). Az Iso (5 mg/kg) beadását követően az mdx és az mdxS3A egereknél is súlyos aritmiák alakultak ki, amelyek korai kamrai összehúzódásokból (PVC), kamrai tachycardia (VT) és atrioventrikuláris (AV) blokkból álltak. Ezzel szemben a WT és az mdxS3E egerek egyetlen, ritkán előforduló PVC-ket mutattak, vagy egyáltalán nem voltak rendellenességek a megfigyelés egy órája alatt (3A. Ábra). Ennek eredményeként az mdxS3E egereknek szignifikánsan alacsonyabb az aritmiás pontszámuk (24) (átlagos pontszám = 0,5 ± 0,17) az mdx-hez képest (átlagos pontszám = 2,78 ± 0,43, P 3B ábra). Ezek az eredmények együtt alátámasztják az átalakított Cx43 mint aritmogén szubsztrát fontosságát egy DMD állatmodellben.
Az MdxS3E kardiomiociták javított kalcium homeosztázist és csökkent ROS termelést mutatnak.
Az oxidált CaMKII hozzájárul a Cx43 hipofoszforilációjához.
Az idős mdxS3E egerek szívműködése és morfológiája javult.
45%) egerek Iso után.
Annak kizárására, hogy az mdxS3E egereknek tulajdonított túlélési előny a légzési funkció közvetett javulásának volt köszönhető, diafragma ultrahangvizsgálatot végeztünk (55). A membrán mozgásának amplitúdója az inspiráció során az összes mdx (mdx = 0,33 mm, mdxS3A = 0,33 mm, mdxS3E = 0,35 mm) genotípusban szignifikánsan csökkent a WT-vel összehasonlítva (minden P 2+ rossz kezelés (59–62). Az MT hálózat célzása megvédi az mdx-t egerek a stressz által kiváltott aritmiák ellen (35). Fontos, hogy a Cx43 intracelluláris kereskedelme nagyban függ az MT-ktől (63). A Cx43 MT-függő, az ID-khez történő előre történő kereskedelme a stressz alatt lévő kardiomiocitákban megszakad, kevesebb csatlakozási Cx43-t eredményez, és csökkent a rés csatlakozási funkciója ( 64). Azt is felvetették, hogy a beteg szívekben a Cx43 átalakulása magyarázható a kardiomiociták MT-jének az oldalsó membrán irányába történő átirányításával (65).
Ezért, hogy megvizsgáljuk az MT-k és az mdx egerekben átalakuló Cx43 közötti lehetséges ok-okozati összefüggést, három hónapos mdx egereket ültettünk be minioszmotikus szivattyúkkal, sóoldatot vagy kolcsot, ismert MT depolimerizátort, védő hatású mdx egerekben (66, 67). (0,4 mg/kg/nap), 4 hétig. A kezelés végén kamrai szövetet gyűjtöttünk. Az MT sűrűség csökkentését kolhalkezeléssel a p-tubulin csökkenésével igazoltuk mind a szöveti fehérje szintjén, mind az izolált kardiomiociták fluoreszcens szignálján (5. kiegészítő ábra, A és B). A NOX2/gp91 phox fehérje szintje szignifikánsan, 65% -kal csökkent a kolttal kezelt mdx kamrákban (P 7A. Ábra). Ezenkívül az immunblotozás a relatív ox-CaMKII szint 31% -os csökkenését mutatta ki a kolcsával kezelt szívekben (P 7B. Ábra). Ezt követően a Cx43 változását értékeltük, ahol a relatív pS-Cx43 szint kétszeres növekedését észleltük a kolhával kezelt mdx lizátumokban a sóoldattal összehasonlítva (P 7C. Ábra). Ezután a Cx43 sejtek eloszlását vizsgáltuk Triton oldhatósági vizsgálattal. Mérjük az oldhatatlan Cx43 majdnem 6-szoros növekedését a kolcsával kezelt mdx szívekben (P 7D ábra). Ezen eredmények alapján Cx43 immunhisztokémiát végeztünk kamrai kriozekciókban. A konfokális immunfluoreszcenciás képalkotás során kiderült, hogy a Cx43 átalakulása csökkent a kolcsal kezelt szívekben (7E. Ábra), ami hasonlít arra, amit korábban az mdxS3E szívekben láthattunk (2. ábra). Az ID-knél talált relatív Cx43 szignál mennyiségi meghatározása megerősítette a szignifikánsan magasabb Cx43 lokalizációt az ID-khez a kolcsával kezelt mdx szívekben (P 7E. Ábra).
A Cx43 foszforilációjának utánzása elegendő volt a disztrófiás kardiomiocitákban kiemelkedő számos rendellenesség korrigálására. Eredményeink összhangban állnak azokkal a korábbi tanulmányokkal, amelyekben a pS-Cx43 utánzása vagy fokozása kardioprotektálást biztosított a hipertrófia és a transzverz aorta összehúzódás (TAC) egérmodelljeiben (18, 20). A pS-Cx43 a kardiomiocitákban is megőrizte a rés csatlakozási kommunikációt, amely nem reagál az FGF-re, amely a kardioprotekció fontos közvetítője (68). Wang és mtsai. nemrégiben arról számoltak be, hogy a Cx43-S3E-t hordozó AAV9 injekciója a szívinfarktus utáni szívekbe javította a szívműködést és elősegítette a felnőttek kardiomiocita redifferenciálódását az infarktus helyén (69). Ez a felfedezés hiányzó kapcsolatot teremthet a Cx43 foszforilációja és a kardiomiocita sejtek halálával és fibrózissal szembeni védelem között, amelyek a DMD kardiomiopátia jellemző tulajdonságai, amelyeket enyhítettek az mdxS3E egerekben.
Fontos megjegyezni, hogy bár ennek a tanulmánynak a középpontjában a Cx43 átalakítás állt, az mdxS3E egerekben megfigyelt kardioprotekció a fokozott rés-junkcionális sejtközi kommunikációnak (GJIC) is tulajdonítható. A legtöbb olyan szívbetegség-modellben, amelyben a rés junkcionális átalakulása figyelhető meg, a Cx43 nemcsak oldalirányban oszlik el újra, hanem expressziós szintje jelentősen csökken az ID-nél (22). Ez a redukció rés junkcionális szétkapcsolódást okoz, ami lassított vezetéshez és megszakítás nélküli terjedéshez vezet, 2 kulcs aritmikus szubsztrát több állatmodellben (11). Valójában a Cx43-ra irányuló terápiás stratégiák többsége a Cx43 megőrzésére összpontosít az ID-ben, a GJIC elősegítése helyett az átalakítás megelőzése helyett (77–79). Adataink, amelyek megnövekedett Cx43 értéket mutatnak az mdxS3E szívek tritonban oldhatatlan, réspontú fehérjefrakcióiban (kiegészítő 2A. Ábra), valamint az ID régiókban talált megnövekedett relatív Cx43 jelet az mdxS3E szívek kriozekcióiban (2. ábra), fokozott Cx43 lokalizációt javasolnak az igazolványnál. A szívbetegség korrekciója dystrophiás egerekben azonban elérhető az ID-asszociált Cx43 teljes helyreállítása nélkül (26). Ez alátámasztja azt az elképzelést, hogy az ID-Cx43 átalakítása, de nem csökkentve, a kulcsfontosságú kóros esemény a dystrophiás szívekben.
A globális genetikai koppanás ellenére a dystrophiás fenotípus csak a szívben szabadul fel (6. ábra), a környező vázizmokban nem, amint ezt az idős mdxS3E egerek gyengült és láthatóan fibrotikus rekeszizma bizonyítja (4., B és C kiegészítő ábra). A késői stádiumú DMD-ben a szív- és légzőszervi diszfunkciók együtt élnek, egyikük negatívan befolyásolja a másikat (80). A szívizommal szemben a felnőtt vázizomzatnak nincs szüksége réscsomópontokra az izomösszehúzódás koordinálásához (81). A Cx43 hemichannelek de novo expressziója azonban hozzájárul az izmok degenerációjához denervált dystrophiás gyors vázizomrostokban, például a rekeszizomban (82–84). Így a Cx43 hemichanneleket javasolták a dystrophiás izmok életképes terápiás célpontjának. Mindazonáltal eredményeink alátámasztják azt az elképzelést, hogy a dystrophiás cardiomyopathia korrekciója a Cx43 átalakulásának elnyomásával függetlenül folytatódhat a dystrophiás légzőizmok jelenlététől.
Összességében a jelen tanulmány bizonyítékot szolgáltat arra vonatkozóan, hogy az S325/S328/S330 poszttranszlációs foszforilációja Cx43-ban kulcsfontosságú esemény, amely megvédi a rés junkcionális átalakulását és a kardiomiopátia kialakulását a DMD környezetében. Ez a tanulmány betekintést nyújt abba, hogy a dystrophiás pathomechanizmusok miként hatnak a Cx43 foszforilációjával, lokalizációjával és működésével a szívben. Eredményeink, a Cx43 terápiáknak tulajdonított széles körű ismeretekkel és potenciállal párosítva tovább erősítik a Cx43 alapú stratégiák lehetőségét a DMD-kardiomiopátia leküzdésére.
Mód
A kísérleti módszerek részletes leírását a Kiegészítő módszerek tartalmazzák.
Egér tanulmányok.
Emberi minták.
Három nem DMD és 3 DMD hím emberi szívmintát nyertünk a Marylandi Egyetem Brain és Tissue Bankjától, az NIH NeuroBioBank hálózatának tagjától. Az összes mintát levágták post mortem. A DMD1 halála 15 éves korban a szívelégtelenségnek, a DMD2 halálának 17 éves korban a tüdő tromboembóliának tulajdonítható, és a DMD3 halálának oka nem volt ismert.
Western blottolás.
Pattintva fagyasztott egér és humán kamrai szöveteket RIPA pufferben homogenizáltunk és a leírásnak megfelelően dolgoztuk fel (26). A következő antitesteket használtuk: Cx43 (MilliporeSigma, C6219; 1: 10000, nyúl), pS325/S328/S330-Cx43 (házon belül egyedi készítésű, 1: 1000, egér), pS365-Cx43 (házon belül egyedi gyártás, 1: 1000, nyúl), vinkulin (MilliporeSigma, V9131; 1: 2000, egér), N-kadherin (Invitrogen, 33-3900; 1: 2000, egér), α-tubulin (Abcam, ab7291; 1: 2000, egér ), β-tubulin (Sigma T8328, 1: 1000, egér), gp91-phox (Santa Cruz Biotechnology Inc., sc-130543; 1: 1000, egér), CaMKIIδ (GeneTex, GTX111401; 1: 1000, nyúl), és oxidált CaMKII (Met281/282, MilliporeSigma, 07-1387; 1: 1000, nyúl). A részletekért lásd: Kiegészítő módszerek.
Triton oldhatósági vizsgálat.
A módszert egy korábbi leírásból (71) adták át módosításokkal. A részletekért lásd: Kiegészítő módszerek.
Kamrai kardiomiocita izoláció.
Az egy kamrai kardiomiocitákat enzimatikusan izoláltuk II-es típusú kollagenázzal (Worthington, LS004176) és XIV-proteázzal (MilliporeSigma, P5147) 3-4 hónapos egérszívvel, korábban leírt Langendorff perfúziós rendszerrel (26, 44).
Intracelluláris Ca 2+ válaszok hipo-ozmotikus sokkra.
Az ép kardiomiocitákat fluo-4AM-mal (5 μM, Invitrogen) töltöttük be, deészterizáltuk és képalkotást végeztünk a korábban leírtak szerint (26). A részletekért lásd: Kiegészítő módszerek.
Citoszolos ROS termelés mérése.
Az ép kardiomiocitákat 5 μM 2 ′, 7′-diklór-fluoreszcén-diacetáttal (H2-DCFA) töltöttük be, és 120 másodpercig képalkotásnak vetettük alá, ahogy azt korábban leírtuk (26).
A szövet immunfluoreszcenciája.
Az egeret és az emberi kamrai szövetet levágtuk, feldolgoztuk és inkubáltuk a korábban leírtak szerint (24). Ezután a metszeteket Cx43-mal (MilliporeSigma, C6219, 1: 2000, nyúl) vagy pS325/S328/S330-Cx43 (lásd fent, 1: 1000) és N-kadherinnel (Invitrogen 33-3900, 1: 300, egér) inkubáltuk. antitestek blokkoló pufferben egy éjszakán át 4 ° C-on. További részletekért lásd: Kiegészítő módszerek.
A Cx43 lokalizáció számszerűsítése az interkalált lemezen.
A módszert egy korábbi leírásból (71) adták át módosításokkal. További részletekért lásd: Kiegészítő módszerek.
Fibrózis festés és mennyiségi meghatározás.
A Masson Trichrome festést a korábban leírtak szerint végeztük (25).
Echokardiográfia.
Idős (14-18 hónapos) egerek transthoracalis echokardiográfiáját hajtottunk végre és elemeztük a korábban leírtak szerint (25). A membrán ultrahangvizsgálatot érzéstelenített egereken végeztük, és a rekeszizom amplitúdóit a korábban leírtak szerint mértük (55).
Elektrokardiográfia.
A teljes állati elektrokardiogramokat ólom II konformációban rögzítették és elemezték a korábban leírtak szerint (24).
Elszigetelt szív-etídium-bromid perfúzió és festékfelvétel mennyiségi meghatározása.
Elszigetelt szív biotin perfúzió.
Mini ozmotikus szivattyú beültetése.
Az ozmotikus szivattyú beültetésére kiválasztott fiatal felnőtt (kb. 3 hónapos) mdx egereket lemértük és altattuk. Az ozmotikus szivattyúkat (Alzet 1004-es modell) a lapockák közötti kis bemetszésen keresztül helyeztük be, majd a bemetszést sebkapcsokkal lezártuk. Az ozmotikus pumpák fiziológiás sóoldatot (vivőanyag) vagy kolcsát (MilliporeSigma, C9754, sóoldatban oldva, 0,4 mg/kg/nap) tartalmaztak, és 28 napig maradtak az egerekben. A vizsgálat végén az egereket eutanizálták, és a szívszövetet összegyűjtötték a downstream immunoblotting és immunfluoreszcens elemzésekhez.
Statisztika.
Az adatokat átlag ± SEM-ben fejezzük ki. A statisztikai elemzéseket parametrikus analízissel végeztük a GraphPad Prism szoftverben. A több csoport közötti statisztikai szignifikanciát egyutas ANOVA paraméteres teszteléssel elemeztük, amelyet Tukey többszörös összehasonlító tesztje követett. Az Iso vagy kontrollal injektált egerek statisztikai jelentőségét kétutas ANOVA-val elemeztük, amelyet Tukey többszörös összehasonlító tesztje követett. 2 csoport esetében páros t teszteket hajtottunk végre. A 0,05 alatti P értékeket szignifikánsnak tekintették az összes statisztikai tesztben. A reprezentatív P értékeket és szimbólumokat az ábra jelmagyarázatai írják le. A legtöbb kísérletet és a végpont kiolvasás elemzését (immunhisztokémia, hisztopatológia, immunblottolás) vakon hajtották végre.
Tanulmány jóváhagyása.
Valamennyi állatkísérletet a Rutgers New Jersey Medical School IACUC jóváhagyta és az NIH irányelveinek megfelelően hajtotta végre. Minden emberi kísérletet a Rutgers Egyetem IRB-je jóváhagyott, és a vonatkozó irányelveknek és előírásoknak megfelelően hajtotta végre. Tájékozott beleegyezést kaptak minden olyan alany számára, akitől a szöveteket elemezték.
Szerzői hozzájárulások
EH, MAL, DF, JEC, NS és LHX tervezett kísérleteket. EH és MAL végezte a kísérletek nagy részét. EH, MAL, DF, JEC és NS elemezte az adatokat. QZ, JPG, JN, HL, TL és PDL hajtott végre néhány kísérletet. Az XHTW mdx: CaMKII (MM-VV) szívszöveteket, a PDL pedig egyedi pS325/S328/S330 antitestet biztosított. A GIF biztosította a transzgénikus S3A és S3E knockin egereket. EH írta a kéziratot. Minden szerző áttekintette és jóváhagyta a végleges tervezetet.
- A szénhidrogén-betöltés 12 lépéses terve, hogy még izomzatosabbá váljon; Fitness
- Leküzdeni a fogyás akadályainak megelőzését
- A 3 testtípus - és hogyan befolyásolják a fogyás megelőzését
- Tavasszal tisztítsd meg a fogyás tervét
- A fogyás 20 leglassabb módja - fogyás - megelőzés Ausztráliában