A dexametazon csökkenti az energiafogyasztást és növeli az étrend okozta elhízásra való hajlamot egerekben
Absztrakt
Célkitűzés
Annak vizsgálata, hogy a dexametazonnal történő hosszú távú kezelés hogyan befolyásolja az egerek energiafogyasztását és zsírosságát, és hogy ezt befolyásolja-e a magas zsírtartalmú étrend (HFD) táplálása.
Tervezés és módszerek
Az egereket 2 hétre HFD-re helyeztük, és a következő 7 hét során minden második nap 5 mg/kg dexametazonnal kezdtük.
Eredmények
A dexametazonnal végzett kezelés megnövelte a testzsír mennyiségét, amely hatás a HFD-n tartott állatoknál hangsúlyosabb volt; a dexametazon-kezelés súlyosbította a HFD által okozott máj steatosist is. Ugyanakkor a dexametazonnal végzett kezelés csökkentette az állattartást etetett állatokkal, és lassította az éjszakai anyagcserét a HFD-n tartott állatoknál. Ezenkívül a β3 adrenerg-stimulációra adott akut VO2-gyorsulás szignifikánsan korlátozott volt a dexametazonnal kezelt állatokban, ezen állatok BAT-ban megfigyelt UCP-1 mRNS jelentős csökkenésének eredményeként.
Következtetések
A dexametazonnal történő hosszú távú kezelés a diéta által kiváltott elhízás egérmodelljében csökkenti a BAT termogenezisét, és eltúlozza az adipozitást és a máj steatosisát.
BEVEZETÉS
A kortizol a fő természetben előforduló glükokortikoid az emberekben, és feleslege megnöveli a zsírszövet teljes tömegét, a zsírt a perifériáról a központi raktárakra osztja újra (1). Valójában a hosszú távú glükokortikoid-kezelés az emberek központi elhízásával jár (2, 3), amelyet általában a legtöbb Cushing-szindrómás beteg is megfigyel (4). Az elhízott betegeknél azonban nincs magas szérum kortizol-koncentráció. Ehelyett magasabb kortizolszintet jelentettek zsírszövetükben az 1-es típusú 11β-hidroxi-szteroid-dehidrogenáz (11β-HSD 1) megnövekedett aktivitásának eredményeként, amely enzim a kortizont kortizollá alakítja (5).
Azok a mechanizmusok, amelyek révén az exogén glükokortikoidok megváltoztatják az anyagcserét és súlygyarapodást váltanak ki, kevéssé ismertek. Annak ellenére, hogy stimulálja az emberekben az adipociták által a leptin szintézisét és szekrécióját (közvetlenül vagy inzulinon keresztül) (6, 7), a glükokortikoidok növelik az étvágyat azáltal, hogy korlátozzák a leptin által kiváltott jóllakottságot és elősegítik az NPY orexigén aktivitását (8, 9). Például felvetették, hogy az étrendi energia bevitel növekedése magyarázza a testtömeg és a zsírtömeg növekedését, amelyet glükokortikoidokkal kezelt egészséges önkéntes nőknél figyeltek meg (10). Másrészt a glükokortikoidok jól ismert lipolitikus hatású stresszhormonok; ezekről a szteroidokról úgy gondolják, hogy a zsírszövetből származó fokozott lipidmobilizáció révén vesznek részt a rákkal társult cachexiában (11). Ezenkívül valószínű más rendszerek bevonása is, amint azt a legutóbbi jelentés szemlélteti, hogy az oszteoblasztok közvetítik az exogén glükokortikoidok számos káros hatását az üzemanyag-anyagcserére (12).
Az egyik lehetséges mechanizmus, amellyel az exogén glükokortikoidok befolyásolják a különféle fehér zsírszövet depók nagyságát és méretét, az az, hogy lelassítják az energiafelhasználás mértékét (EE). Ez magában foglalja a pihenő EE-t és az indukálható EE-t, amely fizikai aktivitással, magas zsírtartalmú étrenddel (HFD) táplálkozik, vagy olyan környezeti ingerek váltják ki, mint a hideg expozíció (13). Míg az izmok összehúzódása és az ATP lebontása magyarázza a fizikai aktivitással összefüggő EE-t, addig a mitokondriális szétkapcsolás a barna zsírszövetben (BAT) az étrend és a hideg által indukálható EE jelentős részét képezi (13). Úgy tűnik azonban, hogy a glükokortikoidok nem játszanak nagy szerepet a pihenő EE szabályozásában. Például rossz az összefüggés az egerek bazális EE és a kortikoszteron szintje között (14), és az embereknél az EE nem változik a glükokortikoid hatás (15) vagy a glükokortikoid felesleg akut gátlásával, pl. Cushing-szindrómás betegeknél (16).
Kevéssé ismertek az indukálható EE-ről és az exogén glükokortikoidokról, egészséges férfi alanyokkal végzett rövid távú vizsgálatok az EE jelentős növekedéséről és a testmozgás során felgyorsult zsír oxidációról számoltak be (17, 18), míg más hasonló vizsgálatokban az indukálható EE-t nem befolyásolták a glükokortikoidok (19). ). Abban azonban egyetértés van, hogy a glükokortikoidok akut beadása gátolja a BAT energiafelhasználásában részt vevő kulcsfontosságú mitokondriális fehérje-1 (UCP-1) expresszióját (20, 21). A kortikoszteron patkányokban történő beadása csökkentette az UCP-1 mRNS és fehérje szintjét, valamint a hidegre való kitettségre vagy az adrenalin beadására való reagálókészséget (21). Emellett az ob/ob egereknél, amelyek magasabb kortikoszteronszintet mutatnak, csökkent az UCP-1 szint és csökkent az EE (22). Nevezetesen, ha az UCP-1 expresszió glükokortikoidok által közvetített csökkenése lassítaná az EE sebességét, akkor ez megmagyarázná, hogy a dexametazonnal való krónikus kezelés miért súlyosbítja az étrend okozta elhízást és diszlipidémiát egerekben (23). Ez potenciálisan nagy érdeklődésre számíthat annak figyelembevételével, hogy a BAT-ot felnőttkorban megtartja az ember (24, 25, 26).
Az UCP-1 egy cAMP-indukálható belső membrán mitokondriális fehérje, amely megzavarja a proton gradienst ezen a membránon, és így gyorsítja az ATP-szintézistől független energiaszubsztrátok oxidációját a BAT-ban. Mind az UCP-1, mind az adrenerg stimuláció kritikus az étrend okozta EE szempontjából a BAT-ban, mivel az UCP-1 egerek kiütnek (27), a hármas adrenerg receptorok (28) vagy a β1 adrenerg receptorok (29) ) hibás BAT termogenezist mutatnak, súlyos hideg intoleranciát és elhízást fejlesztenek ki. A jelen vizsgálatok által kitűzött fő kérdés azonban az, hogy a glükokortikoidok beadása által okozott UCP-1 csökkenés jelentősen lelassíthatja-e a bazális vagy indukálható BAT által közvetített EE-t, és ezáltal hozzájárulhat-e a metabolikus diszregulációhoz a diéta okozta elhízás egérmodelljében.
MÓDSZEREK ÉS ELJÁRÁSOK
Állatok
A Miami Miller Orvostudományi Állattenyésztési és Felhasználási Bizottság minden eljárást jóváhagyott. Két hónapos hím C57BL/6J egereket a Jackson Laboratóriumtól (Bar Harbor, ME) szereztek be, és standard körülmények között, étellel és vízzel ad libitum, 22 ° C-on és 12 órás világos/sötét ciklus alatt helyezték el. Az állatokat magas zsírtartalmú étrenddel kezeltük (HFD: 4,5 kcal/g; 42,7% szénhidrát, 15,3% fehérje, 42% zsír; TD95121; Harlan Teklad, Indianapolis, IN), vagy normál chow-étrenden maradtak (3,5 kcal/g; 58,5%) szénhidrát, 28,8% fehérje, 12,7% zsír; 5010; PMI Nutrition, Richmond IN) összesen 10 hétig. Az egereknek a diéta megkezdése előtt legalább egy hétig hagyták alkalmazkodni a környezethez. 2 hetes táplálkozás után az állatokat intraperitoneális (ip) injekciókkal kezeltük dexametazon-nátrium-foszfáttal (APP Pharmaceutical, LLC; 5 mg/kg) vagy 0,9% -os nátrium-kloriddal (Baxter, Deerfield, IL), alternatív napokon a kezelés végéig. kísérleti időszak. Amint jeleztük, az adatokat (i) a kísérleti periódus és a kísérlet vége közötti szórás (pre- és post-dexa) vagy ii) kereszt-összehasonlítással a sóoldattal vagy dexametazonnal kezelt csoportok között a kísérleti időszak végén mutatjuk be.
Anyagcsere paraméterek
A testtömeget minden második napon mértük az eutanáziáig. A kalóriabevitelt egyenként mértük 8 napos periódus alatt két hetes dexametazon- vagy sóoldat-kezelés után, és az eredményeket a testtömeg (kcal/g testtömeg-nap) függvényében fejeztük ki. A testösszetételt (sovány testtömeg, zsír% és zsírtömeg) egy éjszakán át éheztetett egereknél mértük, és ketamin és xilazinnal (200 mg/kg és 7–20 mg/kg) altattuk Dual-Energy röntgenabszorptiometriával (DXA, Lunar). Pixi, Janesville, WI) kiválasztott időpontokban.
Indirekt kalorimetria és β3-szelektív adrenerg stimuláció
E vizsgálatokhoz az állatokat átfogó laboratóriumi állat-ellenőrző rendszerbe (C.L.A.M.S .; Oxymax System, Columbus Instruments, Columbus OH) engedték be egyedi ketrecekben, és két napig hagyták őket akklimatizálódni. A következő öt nap során 24 órás metabolikus profilokat kaptunk. A berendezéseket O2 és CO2 meghatározott gázkeverékével kalibráltuk (Airgas, Tampa, FL). A légzési hányadost (RQ) a CO2-termelés (liter) és az O2-fogyasztás (liter) arányaként számítottuk ki. Az oxigénfogyasztást (VO2) ml O2/perc-ben fejezték ki, és a DXA által meghatározott sovány testtömeg normalizálta. A VO2-értéket szintén 4 órán át értékeltük a β3-szelektív adrenerg receptor agonista-CL 316243 szubkután (sz.c.) injekciói előtt és után (Sigma Chemical Co. St Louis, MO; 1mg/kg).
Eutanázia és post-mortem elemzés
A kísérleti periódus végén egy éjszakán át éheztetett egereket szívszúrással elpusztítottunk rövid CO2-expozíció után. Az interscapularis BAT-ot és a májat eltávolítottuk, súlyoztuk és folyékony nitrogénben gyorsan lefagyasztottuk. A szövet súlyát normalizáltuk a comb hosszúságával, amelyet elektronikus digitális féknyereggel mértünk (Control Company, Friendswood, TX, vásárolt a VWR-n keresztül). A máj trigliceridjeit kloroform: metanol (2: 1) és 0,05% kénsav extrakció után mértük 0,2 g fagyasztott máj mintából, kereskedelemben kapható készlet (Sigma-Aldrich, St. Louis, Mo) segítségével, amint azt korábban publikáltuk (30). ).
Az UCP-1 expresszió mérései
A teljes RNS-t a QuiagenRNeasy kit segítségével extraháltuk a gyártó protokollja szerint (Qiagen, Valencia, CA), és a koncentrációt Nanodrop spektrofotométerrel határoztuk meg. A cDNS-t 1 μg mRNS-ből készítettük nagy kapacitású cDNS reverz transzkripciós készlet felhasználásával a gyártó protokollja szerint (Applied Biosystems, Foster City, CA). Az érdekes gént RT-qPCR-rel értékeltük összegyűjtött egérminták kalibrációs görbéjével (Bio-Rad iCycleriQ Real-Time PCR Detection System), és a ciklofilin A háztartási génnel normalizáltuk, amint azt korábban leírtuk (31). Az alkalmazott primer szekvenciák a következők: UCP-1: 5'AGGTGTGGCAGTGTTCATTGG-3 ', 3' CTGTCCTGGGAGAGAGTTGATG-5 '. Cyclo-A: 5 ′ GCCGATGACGAGCCCTTG-3 ′, 3 ′ TGCCGCCAGTGCCATTATG-5 ′.
Adatelemzés
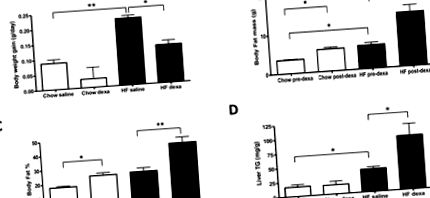
A kéziratban az összes adatot átlag ± átlagos átlaghibaként (SEM) fejezzük ki. Az adatokat PRISM Parallel GraphPad szoftverrel (San Diego, Kalifornia) elemeztük. A Student t-tesztjét két független csoport közötti különbségek összehasonlítására használták. A statisztikai szignifikanciát p szinten figyeltük meg (1A. Ábra). A testzsír-tömeg (1B ábra), a test testzsírszázaléka (1C ábra) és a máj triglicerid-tartalma (1D ábra) szintén jelentősen megnőtt; nem figyeltek meg szignifikáns HFD-hatást a kalóriabevitelre (0,50 ± 0,06 vs. 0,42 ± 0,01 kcal/g testtömeg/nap; chow-étrend HFD-vel szemben; n = 3/csoport) a sóoldattal kezelt állatokban, a a kísérlet.
(A) A testtömeg-növekedés látható. A testösszetételt a DXA értékelte a DEXA-val végzett kezelés előtt (pre-dexa) és után (post-dexa után), és a következőképpen fejezte ki: (B) Testzsírtömeg, és (C) teljes testzsír. (D) A máj trigliceridek (TG) tartalma. Az eredményeket átlag ± SEM-ben fejezzük ki (n = 3-6). HF, magas zsírtartalmú étrend. Dexa, dexametazon. * P ** P 1A. Ábra), miközben növeli a testzsír tömegét (1B. Ábra) és a zsír százalékát (1C. Ábra), mindkét étrendtípuson; a hatások azonban kifejezettebbek voltak a HFD-n tartott állatoknál (1B – C. ábra). Hasonlóképpen, csak a HFD-n tartott dexametazonnal kezelt egerekben a máj trigliceridtartalma megközelítőleg megduplázódott (1D. Ábra). Nevezetesen a dexametazon testtömeg-gyarapodás csökkentésére gyakorolt hatásának legalább egy része a lineáris növekedés csökkenésének volt köszönhető, amelyet a csökkent combcsont-hossz bizonyít (14,6 ± 0,20 vs. 15,5 ± 0,04 mm; n = 3/csoport; p ábra. 2A), de jelentősen csökkentette az éjszakai RQ-t (2C – D ábra). Ez arra utal, hogy a zsírsav oxidációja felgyorsult a dexametazon kezelésével. A HFD-n tartott állatoknál azonban a dexametazonnal végzett kezelés elősegítette a VO2 jelentős csökkenését, amely statisztikai szignifikanciát ért el az éjszakai időszakban (2A – B. Ábra). Ez azonban nem volt összefüggésben az RQ további csökkenésével, valószínűleg azért, mert a zsírsav oxidációja már felgyorsult az állatok HFD-n tartásával (2C. Ábra).
- Energiaegyensúly és elhízás cisztás fibrózisban szenvedő egyéneknél - PubMed
- Az elhízott nők energiafogyasztása a fogyás előtt és alatt, újratáplálás után és a
- Az energiafogyasztás változásai súlygyarapodással és fogyással az embereknél - PubMed
- A határok EGCG csökkenti az elhízást és a fehér zsírszövet nyereségét részben az egerek AMPK-aktiválásával
- Energiaegyensúly és elhízás cisztás fibrózisban szenvedőknél - ScienceDirect