A diéta során a HSP60 iránti autoimmunitás elhízást váltott ki egerekben
Tárgyak
Absztrakt
Az adaptív immunitás szerepet játszik a zsírszövet gyulladásában, az elhízásban és annak káros anyagcsere-következményeiben. Az elhízással kapcsolatos autoantigént még nem sikerült azonosítani, bár a 60-as hősokk-fehérjét (HSP60) más autoimmun betegségeknél is érintették. Megvizsgáltuk, hogy a magas zsírtartalmú étrend C57BL/6J egerekkel történő táplálása okozhat-e autoimmun immunitást a HSP60-val szemben, és hogy a HSP60 peptidjeivel végzett immunmoduláció visszafordítja-e a kialakuló elhízást vagy metabolikus diszfunkciót. Az elhízott egereknél magasabb volt a keringés HSP60 szintje, ami a fokozott T-limfocita proliferációs válaszokkal és a keringő IgG1 és IgG2c antitestszintek megjelenésével társult a HSP60 ellen. Három bevált immunmoduláló HSP60 peptid keverékének emelésével történő kezelés nem csökkentette a súlyt, hanem teljesen megfordította a VLDL/LDL szint növekedését és részben visszafordította az elhízott egerek glükóz intoleranciáját. Az elhízott egerek autoimmun reakciót váltanak ki a HSP60-ra, amely részben megalapozza az ebből eredő anyagcserezavarokat.
Bevezetés
Az elhízás világszerte növekszik, a 2-es típusú cukorbetegség és a metabolikus szindróma, a zsíros májbetegség, az emlő- és a vastagbélrák, a mozgásszervi rendellenességek és a szív- és érrendszeri betegségek, köztük az érelmeszesedés és agyvérzés emelkedésével. 1, 2 Az elhízás számos káros hatását a zsírszövet (AT) gyulladásának tulajdonítják, 3 mind veleszületett, mind adaptív immunitással. 4 A T-limfociták hozzájárulnak az AT gyulladásához: (1) A T-sejtek még a makrofágok előtt is felhalmozódnak az AT-ban. 5., 6., 7. (2) korlátozott VAz α repertoárok antigénspecifikus klonális terjeszkedést jelentenek. 8 (3) Az MHC II. Osztályú molekulák globális vagy makrofágokon történő törlése csökkenti az elhízást, az inzulinrezisztenciát és az AT gyulladást. 9, 10 (4) Ezzel szemben az antigént bemutató sejtfunkció fokozása kedvez az AT gyulladásának és elősegíti az inzulinrezisztenciát. 11 Ez a bizonyíték az elhízás autoimmun komponensére utal, de a bűnös autoantigéneket eddig nem sikerült azonosítani.
A HSP60 egy evolúciósan konzervált mitokondriális chaperonin, amely transzlokálódhat a citoszolba és a sejtmembránba, és stressz körülmények között a keringésbe engedhető. A HSP60 számos gyulladásos betegség, köztük az érelmeszesedés autoimmun komponensével társult. Újabban bebizonyosodott a HSP60 felszabadulása az AT-ból, valamint annak képessége, hogy inzulinrezisztenciát és gyulladásgátló citokin (TNF-α, IL-6 és IL-8) adipociták által szabadul fel. 13 A keringő HSP60 szintet magasabbnak találták elhízott egyéneknél, mint a sovány kontrollokat. Mindezek a megfigyelések a HSP60-t az elhízás autoantigénjelöltjévé teszik, bár ezt még nem igazolták. Ezért megvizsgáltuk, hogy a magas zsírtartalmú étrend (HFD) táplálása autoimmunitást eredményez-e a HSP60 ellen egerekben, és hogy a HSP60-specifikus peptidekkel végzett immunmoduláció csökkentheti-e az elhízást vagy a kapcsolódó anyagcserezavarokat.
Anyagok és metódusok
További részleteket az International Journal of Obesity honlapján elérhető Supplementary Methods fájl tartalmaz. Röviden: A Charles River Laboratories-tól (Margate, Egyesült Királyság) vásárolt C57BL/6J (6 hetes) egereket normál chow-val (ND) vagy 21% zsírral és 0,15% koleszterinnel kiegészített HFD-vel etették (Special Diets Services, Witham, Essex, Egyesült Királyság) ) 16–20 hétig az elhízás kiváltására. A peptidkezeléshez a 6 hetes egereket szubkután adagolták HSP60 peptidekkel (GL Biochem, Shanghai, Kína), egérenként 0,1 μg-tól kezdve. Az adagot minden héten tízszeresére emelték egérenként 100 μg-ig, amelyet hetente még háromszor, majd a vizsgálat végéig kéthetente adtak be. A HFD-t 11 hetes korban kezdték (a harmadik legnagyobb adag után), és 20 hétig tartott 14, amikor a méhnyak diszlokációja megölte a 70/22957 számú belügyminisztériumi engedély alapján. Útmutató a laboratóriumi állatok gondozásához és használatához, nyolcadik kiadás (2011) (http://grants.nih.gov/grants/olaw/guide-for-the-care-and-use-of-laboratory-animals.pdf ) követve volt. Az eljárásokat a 30/3064 és a 70/22957 belügyminisztériumi licencek alapján hajtották végre. Minden állat túlélésig élt, és bekerült az elemzésbe.
Leölés után epididymális zsírpárnákat gyűjtöttünk, lemértünk, és a stromalis vascularis frakciót (SVF) izoláltuk kollagenáz emésztéssel. A makrofágpopulációk elemzéséhez áramlási citometriás elemzéssel 1 millió SVF-sejtet vizsgáltunk CD11b, F4/80, CD11c és CD206 elleni antitestek felhasználásával. A T-sejt populációkat CD45, CD3, CD4, CD25 és FoxP3 elleni antitestek segítségével elemeztük.
A szérum HSP60 szintjét egér HSP60 ELISA-val (NeoScientific, Cambridge, MA, USA) mértük. A szérum anti-HSP60 antitest szintjét egyedi gyártású ELISA-val mértük rekombináns, endotoxinhiányos egér HSP60 fehérjével (Enzo Life Sciences, Farmingdale, NY, USA), Nunc Immuno MaxiSorp 96 üregű lemezekhez kötve. A HSP60 reaktív T-sejtproliferációs vizsgálathoz a homogenizált lépekből származó összes sejtpelletet 18 órán át 3H-timidinnel pulzáltuk, miután előkezeltük pufferkontrollal, rekombináns HSP60-mal vagy peptidekkel.
A glükóz tolerancia teszteket 16 hét ND vagy HFD után végeztük. 6 óra böjt után intraperitoneálisan 2 g kg -1 testtömegű glükózt injektáltunk, és a farokrészből származó vér glükózkoncentrációját 0, 15, 30, 60 és 90 perccel később mértük. Az inzulin tolerancia tesztet egy héttel később végeztük. 4 órás gyors, gyors hatású humán inzulint (NovoRapid; Novo Nordisk A/S, Bagsvaerd, Dánia) intraperitoneálisan injektáltunk, így a végső dózis 1 U kg -1 testtömeg volt. A vércukorszintet ugyanabban az időpontban mértük. Egér ultrahangos szelektív inzulin ELISA készletet (Alpco, Salem, NH, USA) használtunk az éhomi inzulinszint meghatározásához.
Normál eloszlású változók (Kolmogorov – Smironov-teszt) esetén kétfarkú, párosítatlan Student t-tesztet használtunk a 2 átlag közötti szignifikáns különbségek meghatározására. Többszörös összehasonlítás céljából egyirányú ANOVA-t vagy kétirányú ANOVA-t hajtottak végre, adott esetben Bonferroni-korrekcióval. A különbségeket akkor tekintették jelentősnek, ha P
Eredmények
Megnövekedett keringő HSP60 szint, HSP60 elleni antitestek és HSP60-ra adott T-sejt válaszok HFD-vel táplált C57BL/6J egerekben
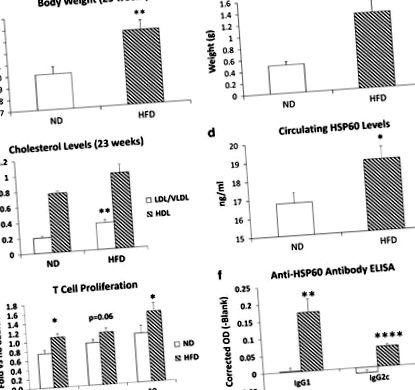
A 16 héten át HFD-vel táplált C57BL/6J egerek 3 g-mal nehezebbek voltak, mint az ND egereknél (1a. Ábra), és epididymális zsírpárnáik majdnem háromszor nehezebbek voltak (1b. Ábra). Az LDL/VLDL plazmaszintjét a HFD szignifikánsan (74%) növelte, bár a HDL szintje nem változott (1c. Ábra). A HFD jelentősen, 12% -kal növelte a keringő HSP60 szintet (1d. Ábra), ami arra utal, hogy az elhízás olyan stressztényező, amely képes stimulálni a HSP60 felszabadulását.
A HFD hatása a súlygyarapodásra, az anyagcserére és a HSP60 elleni autoimmunitásra. Egércsoportok (n= 7) HFD-vel vagy ND-vel tápláltuk 16 hétig. (aTesttömegek (P= 0,007) és (b) epididymális zsírpárna súlyok (P= 0,004) a HFD szignifikánsan megnövelte. (c) A keringő LDL/VLDL szint szintén jelentősen megnőtt (P= 0,005). (d) A szérummintákban ELISA-val mért egér HSP60-szintje szignifikánsan magasabb volt a HFD-ben az ND-vel táplált egerekhez képestP= 0,039; n= Egyenként 19). (e) A T-sejtek proliferációja (kizárólag a tápközeg negatív kontrolljához viszonyítva) szignifikánsan megnőtt a HFD-ben az ND lépekhez képest, amikor 0,1 μg ml-1 stimulálta őket (P= 0,013) vagy 10 μg ml −1 (P= 0,038) rekombináns egér HSP60. (f) A HFD mind az anti-HSP60 IgG1, mind az IgG2c keringő antitest szintjét jelentősen megemelte (Pmax = 0,008 az IgG1 esetében; Pmax = 0,00009 az IgG2c esetében).
A HSP60 elleni autoimmun reakció bizonyítékaként a rekombináns HSP60 20–40% -kal növelte a lép T-limfociták szaporodását a puffer kontrollokhoz viszonyítva a HFD-ben, mint az ND egerekben. Ez a növekedés szignifikáns volt 0,1 és 10 μg ml-1 értéknél, és határértéknél szignifikáns volt (P= 0,063) 1,0 μg ml -1 koncentrációnál (1e. Ábra). A HSP60-ra adott válasz sokkal gyengébb volt, mint a pozitív kontroll ConA (13-szoros, nem látható), nem meglepő, mert az egereket nem hiperimmunizálták. A keringő anti-HSP60 szintek nem voltak kimutathatók az ND egerekben, de a HFD szignifikánsan megemelte mind az anti-HSP60 IgG1-et, amely főleg a Thelper2 (Th2) limfocitáktól függ, mind az IgG2c-t, amelyet a Th1 limfociták hajtanak 15 (1f. Ábra). A HFD és az ND egerek közötti különbségek 1/16 hígítás felett nagyon szignifikánsak voltak; a hiperimmun szérumnál várhatónál jóval alacsonyabb (általában> 1/1000). Nyilvánvaló, hogy az elhízás rövid periódusai autoimmunitást váltottak ki az egér HSP60 ellen, bár alacsony szinten.
A HSP60 peptid kezelés hatása az elhízásra és a kapcsolódó metabolikus diszfunkcióra
A HSP60 autoimmunitás hatásának vizsgálatához szubkután HSP60 peptidkezelést alkalmaztunk három peptid azonos koncentrációjának kombinációjával, amelyekről ismert, hogy kedvező immunmodulációt okoznak az autoimmun cukorbetegség vagy az érelmeszesedés modelljeiben. Ezek vlgggcallrcipaldslkpaned, 16 aelkkqskpvt 17 és dgealstlvlnrlkvg voltak. Ezen peptidek mindegyike vízben jól oldódik (az eredményeket nem mutatjuk be). Olyan dózisemelés protokollt alkalmaztunk, amely biztonságosnak és hatékonynak bizonyult a kísérleti autoimmun encephalomyelitis ellen. 14
A HSP60 peptidkezelés nem fordította meg a HFD által kiváltott súlygyarapodást (2a. Ábra) vagy az epididymális zsírtömeg növekedését (2b. Ábra), amelyek ennél a kísérletnél nagyobbak voltak a HFD táplálás hosszabb időtartama miatt. A peptidkezelés azonban megfordította a jelentősen megnövekedett keringő LDL/VLDL szintet a HFD egerekben (2c. Ábra).
A glükóz tolerancia jelentősen romlott a HFD-ben az ND egerekhez képest. A HSP60 peptidkezelés a HFD egereket lényegesen jobban tolerálta a glükóz ellen, bár nem annyira toleráns, mint az ND egerek (2d. Ábra). Az éhomi inzulinszintet ugyanolyan mértékben emelték az ND-hez képest (0,64 ± 0,05 ng ml -1) a HFD által, függetlenül a peptidkezeléstől (1,01 ± 0,22 és 1,18 ± 0,22 ng ml -1), és nem tudták figyelembe venni a javult glükóz toleranciát . Az inzulin-tolerancia tesztben mért inzulinérzékenység hasonló volt az ND, HFD és a peptid kezelési csoportokban is (2e. Ábra).
Annak megvizsgálására, hogy a HSP60 peptidkezelés elnyomja-e az elhízással járó gyulladást, az SVF sejteket áramlási citometriának vetettük alá. Jelentős növekedést regisztráltunk a makrofágokban (2f. Ábra), a teljes CD4 + vagy CD4 - T limfocitákban nem történt változás (nem látható) és a Treg sejtek csökkenését (2g ábra) a HFD-ben az ND egerekhez képest, de a HSP60 nem volt hatással peptidkezelés (2f. és g. ábra). Nem figyeltünk meg különbséget a lép T-sejtek proliferációs válaszaiban a rekombináns HSP60-ra HFD-vel táplált egerekben HSP60 peptidkezeléssel és anélkül. A spontán vagy a HSP60-fertőzés hatására felszabaduló IL-2, IL-4, IL-6, IL-10, IL-17, IFN-y vagy TNFa szintjeiben sem találtunk különbséget (az eredményeket nem mutatjuk be). A HSP60 peptidkezelés azonban növelte az anti-HSP60 IgG1 (2h. Ábra), de nem az IgG2c antitestek (2i. Ábra) titerét, ami a Th2-vezérelt antitesttermelés fokozását vonja maga után.
Vita
A HFD növelte az AT makrofágokat és csökkentette a Treg értékét, ahogy mások korábban beszámoltak róla (Lolmede áttekintette et al. 4), de a HSP60 peptid kezelés során nem láttunk változásokat. Sem a peptid által kiváltott lép T-sejtproliferáció, sem a citokin felszabadulás hatását nem tapasztaltuk. Láttunk azonban egy váltást a Th2-vezérelt IgG1-termelés felé, ami azt jelenti, hogy a HSP60 peptidkezelés immunmodulációt váltott ki immunimmunáció helyett, ami szélesebb körű vizsgálatot igényel. Összefoglalva, először mutattuk meg, hogy a HSP60 elleni alacsony szintű autoimmunitás hozzájárul, és a HSP60 peptidkezelés részben megfordítja a metabolikus zavarokat egér elhízási modelljében.
Hivatkozások
Raghavan VA. Inzulinrezisztencia és érelmeszesedés. Szívelégtelenség Clin 2012; 8.: 575–587.
Hotamisligil GS. Gyulladás és anyagcserezavarok. Természet 2006; 444: 860–867.
Gregor MF, Hotamisligil GS. Gyulladásos mechanizmusok az elhízásban. Annu Rev Immunol 2011; 29.: 415–445.
Lolmede K, Duffaut C, Zakaroff-Girard A, Bouloumie A. Immunsejtek a zsírszövetben: az anyagcsere-rendellenességek kulcsszereplői. Diabetes Metab 2011; 37: 283–290.
Duffaut C, Galitzky J, Lafontan M, Bouloumie A. Az immunsejtek váratlan kereskedelme a zsírszövetben az elhízás megjelenése során. Biochem Biophys Res Commun 2009; 384: 482–485.
Kintscher U, Hartge M, Hess K, Foryst-Ludwig A, Clemenz M, Wabitsch M et al. T-limfocita infiltráció a zsigeri zsírszövetben: elsődleges esemény a zsírszövet gyulladásában és az elhízás által közvetített inzulinrezisztencia kialakulásában. Arterioscler Thromb Vasc Biol 2008; 28.: 1304–1310.
Wu H, Ghosh S, Perrard XD, Feng L, Garcia GE, Perrard JL et al. A T-sejtek felhalmozódása és az aktiváció által szabályozott normális T-sejt expresszálja és szekretálja a zsírszövetben az elhízás során fellépő upregulációt. Keringés 2007; 115: 1029–1038.
Winer S, Chan Y, Paltser G, Truong D, Tsui H, Bahrami J et al. Az elhízáshoz kapcsolódó inzulinrezisztencia normalizálása immunterápiával. Nat Med 2009; 15: 921–929.
Cho KW, Morris DL, DelProposto JL, Geletka L, Zamarron B, Martinez-Santibanez G et al. A zsírszöveti makrofágok és a CD4 + T-sejtek közötti MHC II-függő aktivációs hurok szabályozza az elhízás okozta gyulladást. Cell Rep 2014; 9.: 605–617.
Deng T, Lyon CJ, Minze LJ, Lin J, Zou J, Liu JZ et al. A II. Osztályú fő hisztokompatibilitási komplex alapvető szerepet játszik az elhízás okozta zsírgyulladásban. Cell Metab 2013; 17.: 411–422.
Moraes-Vieira PM, Yore MM, Dwyer PM, Syed I, Aryal P, Kahn BB. Az RBP4 aktiválja az antigént bemutató sejteket, ami zsírszöveti gyulladáshoz és szisztémás inzulinrezisztenciához vezet. Cell Metab 2014; 19.: 512–526.
Wick G, Jakic B, Buszko M, Wick MC, Grundtman C. A hősokk fehérjék szerepe az érelmeszesedésben. Nat Rev Cardiol 2014; 11.: 516–529.
Marker T, Sell H, Zillessen P, Glode A, Kriebel J, Ouwens DM et al. A 60-as hősokkfehérje a zsírszövet-gyulladás és az inzulinrezisztencia közvetítőjeként. Cukorbetegség 2012; 61: 615–625.
Burton BR, Britton GJ, Fang H, Verhagen J, Smithers B, Sabatos-Peyton CA et al. A szekvenciális transzkripciós változások biztonságos és hatékony antigén-specifikus immunterápiát diktálnak. Nat Commun 2014; 5.: 4741.
Petrushina I, Tran M, Sadzikava N, Ghochikyan A, Vasilevko V, Agadjanyan MG et al. Az IgG2c izotípus jelentősége a béta-amiloid elleni immunválaszban amiloid prekurzor fehérje/transzgenikus egerekben. Neurosci Lett 2003; 338: 5–8.
Jin L, Zhu AH, Wang Y, Lu Y, Liu JJ. A HSP65 immunogén vivőanyagként szolgál a diabetogén P277 peptidhez, amely orr-beadással gyulladáscsökkentő immunválaszt vált ki NOD egerekben. Vakcina 2010; 28.: 3312–3317.
Mundkur L, Mukhopadhyay R, Samson S, Varma M, Kale D, Chen DX et al. Az ApoB és a HSP60 peptidek kombinációjával szembeni nyálkahártyatolerancia szabályozza a plakk progresszióját és stabilizálja a sebezhető plakkot Apob (tm2Sgy) Ldlr (tm1Her)/J egerekben. Plos One 2013; 8.: e58364.
van Puijvelde HM, van Es T, van Wanrooij EJA, Habets KLL, de Vos P, van der Zee R et al. A HSP60 vagy HSP60-peptid orális toleranciájának indukálása aktiválja a T-sejtek szabályozását és csökkenti az érelmeszesedést. Arterioscl Thromb Vasc Biol 2007; 27.: 2677–2683.
Krauss RM, Winston M, Fletcher BJ, Grundy SM. Elhízás: hatás a szív- és érrendszeri betegségekre. Keringés 1998; 98: 1472–1476.
Klingenberg R, Gerdes N, Badeau RM, Gistera A, Strodthoff D, Ketelhuth DF et al. A FOXP3 + szabályozó T-sejtek kimerülése elősegíti a hiperkoleszterinémiát és az érelmeszesedést. J Clin Invest 2013; 123.: 1323–1334.
Köszönetnyilvánítás
A munkát a török oktatási minisztérium MES-hez nyújtott posztgraduális ösztöndíja és a British Heart Foundation elnöke támogatta CH95/001.
Szerzői információk
Jelenlegi cím: 4 Jelenlegi cím: Immunológiai és Immunterápiás Intézet, Orvostudományi és Fogtudományi Főiskola, Birminghami Egyetem, Birmingham B15 2TT, Egyesült Királyság.,
Hovatartozások
Klinikai Tudományok Iskola és Bristoli Szívintézet, Bristoli Királyi Kórház, Bristoli Egyetem, Bristol, Egyesült Királyság
M E Şelli & A C Newby
Kísérleti Patológiai és Immunológiai Osztály, Autoimmunitás Laboratórium, Biocenter Innsbruck Orvostudományi Egyetem, Innsbruck, Ausztria
Celluláris és Molekuláris Orvostudományi Kar, Bristoli Egyetem, Bristol, Egyesült Királyság
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
Levelezési cím
Etikai nyilatkozatok
Versenyző érdekek
A szerzők nem jelentenek összeférhetetlenséget.
További információ
Kiegészítő információk kísérik ezt a cikket az International Journal of Obesity weboldalán
- A táplálkozási szokások és az elhízás fenotípusai közötti összefüggések International Journal of Obesity
- Az elhízott gyermekek lábai kövérek vagy laposak Az International Journal of Obesity vita újbóli megnyitása
- Az antiretrovirális terápia erősíti a magas zsírtartalmú étrend okozta elhízást és glükóz intoleranciát -
- Alpha Lipid Ultra Diet 2 New Image International New Image International Új-Zéland
- Nagy-Britannia új étrendje, a 400-600-600 az elhízás leküzdésére irányul