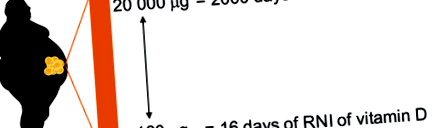A D-vitamin mobilizálása a zsírszövetből: A testmozgás lehetséges hatása
Egészségügyi Tanszék, Bathi Egyetem, Bath, Egyesült Királyság
Egészségügyi Tanszék, Bathi Egyetem, Bath, Egyesült Királyság
Egészségügyi Tanszék, Bathi Egyetem, Bath, Egyesült Királyság
Egészségügyi Tanszék, Bathi Egyetem, Bath, Egyesült Királyság
Metabolizmus és Rendszerkutatás Intézet, Birminghami Egyetem, Birmingham, Egyesült Királyság
Metabolizmus és Rendszerkutatás Intézet, Birminghami Egyetem, Birmingham, Egyesült Királyság
NIHR BRC Nutritional Biomarker Laboratory, Cambridge University, Cambridge, Egyesült Királyság
NIHR BRC Nutritional Biomarker Laboratory, Cambridge University, Cambridge, Egyesült Királyság
Egészségügyi Tanszék, Bathi Egyetem, Bath, Egyesült Királyság
Levelezés: Prof. Dylan Thompson, Egészségügyi Tanszék, Bath Egyetem, Claverton Down, Bath BA2 7AY, Egyesült Királyság.
Egészségügyi Tanszék, Bathi Egyetem, Bath, Egyesült Királyság
Egészségügyi Tanszék, Bathi Egyetem, Bath, Egyesült Királyság
Egészségügyi Tanszék, Bathi Egyetem, Bath, Egyesült Királyság
Egészségügyi Tanszék, Bathi Egyetem, Bath, Egyesült Királyság
Metabolizmus és Rendszerkutatás Intézet, Birminghami Egyetem, Birmingham, Egyesült Királyság
Metabolizmus és Rendszerkutatás Intézet, Birminghami Egyetem, Birmingham, Egyesült Királyság
NIHR BRC Nutritional Biomarker Laboratory, Cambridge University, Cambridge, Egyesült Királyság
NIHR BRC Nutritional Biomarker Laboratory, Cambridge University, Cambridge, Egyesült Királyság
Egészségügyi Tanszék, Bathi Egyetem, Bath, Egyesült Királyság
Levelezés: Prof. Dylan Thompson, Egészségügyi Tanszék, Bath Egyetem, Claverton Down, Bath BA2 7AY, Egyesült Királyság.
Absztrakt
Bevezetés
A D-vitamin hatása jóval meghaladja a kalcium homeosztázisra és a csontanyagcserére gyakorolt klasszikus hatásait, és a D-vitamin-elégtelenségről úgy gondolják, hogy sok fiziológiai rendszert és az emberi egészség széles skáláját érinti (Dobnig et al. 2008; Ginde et al. 2009; Semba et al. 2010). A D-vitamin állapotát általában a D-vitamin keringő fő formájának, a 25-hidroxi-D-vitamin [25 (OH) D] koncentrációinak mérésével határozzák meg. Az Egyesült Királyság lakosságának körülbelül 30–40% -a kering 25 (OH) D 2016), és a 25 (OH) D alacsony szisztémás koncentrációinak korrekciója elismert közegészségügyi prioritás (Palacios & Gonzalez 2014; Cashman et al. 2016).
D-vitamin: áttekintés
A D-vitamin két fő formája a D2-vitamin (ergokalciferol) és a D3-vitamin (kolekalciferol) (Askew et al. 1930; Windaus et al. 1936). A D3 previtamint a bőr szintetizálja, amikor a nap ultraibolya (UV) sugárzás (290–320 nm hullámhossz) behatol a bőrbe, és a 7-dehidrokoleszterin (Maclaughlin) elnyeli et al. 1982), majd spontán és gyorsan izomerizálódik D3-vitaminná. A D3-vitamin a májban 25 (OH) D-re metabolizálódik - a D-vitamin (Blunt et al. 1968; Blunt & Deluca 1969). A D2-vitamin és a D3-vitamin az étrendből és a kiegészítőkből nyerhető (Holick 2007). A D2-vitamint az ergoszterin UV-besugárzása szintetizálja, a bevitel elsősorban az UV-besugárzott gombák vagy kiegészítők fogyasztásával történik. Ezzel szemben a D3-vitamin szélesebb körben oszlik el az élelmiszerekben, és gyakrabban használják a kiegészítőkben és a dúsított élelmiszerekben, mint a D2-vitamin. Az egyik oka annak, hogy a szérum 25 (OH) D-t a D-vitamin állapotának mérésére használják, felezési ideje kb
2-3 hétig, ezért ennek a metabolitnak a mennyiségi meghatározását nem befolyásolják az étrendi D-vitamin átmeneti változásai vagy az akut napsugárzás ugyanolyan mértékben, mint a többi D-vitamin metabolit (Jones et al. 2015). A 25 (OH) D értékelésének módszereit Le Goff vizsgálja felül et al. (2015). Ebben az áttekintésben a „D-vitaminra” való hivatkozás vagy a D3-vitamint (kolekalciferol) vagy a 25 (OH) D-vitamint jelöli.
A D-vitamin metabolikusan aktív formája in vivo a szek-szteroid 1,25-dihidroxi-D-vitamin [1,25 (OH) 2D], más néven kalcitriol. Ez 1,25 (OH) 2D az, amelyet általában a D-vitamin fiziológiai funkcióiért felelősnek tekintenek. Az 1,25 (OH) 2D termelése túlnyomórészt a vesében zajlik, és hatását a D-vitaminhoz való kötődés közvetíti. receptor (VDR), amely általában a célsejtek magjaiban helyezkedik el, és amely 1,25 (OH) 2D-hez kötődve szabályozza a célgén expresszióját (Haussler et al. 2013). A VDR-ablált egerek vizsgálata a D-vitamin (Bouillon et al. 2013).
A szérumban található D - vitamint kötő fehérje (DBP) különböző affinitással kötődik a különböző D - vitamin metabolitokhoz (Daiger et al. 1975). A D - vitamin a DBP - hez kötődik a releváns szövetekbe történő szállításhoz és a biológiai hozzáférhetőség szabályozásához (Safadi et al. 1999). Normális esetben
A keringő 1,25 (OH) 2D 85% -a DBP-hez kötődik
0,4% szabadon kering (Bikle et al. 1984, 1985) és
A keringő 25 (OH) D 88% -a kötődik DBP-hez
0,04% ingyenes (Bikle et al. 1986). A D-vitamin alacsony affinitás mellett kötődhet az albuminhoz és a lipoproteinek kilomikronjaihoz is (Haddad et al. 1993). Bár a keringő D-vitamin metabolitok többsége DBP-hez vagy albuminhoz kötődik, jelenleg jelentős vita folyik arról, hogy a D-vitamin kötött vagy nem kötött formái biológiailag aktívak-e (Bikle et al. 2017), egyes szöveteknél a DBP-hez kötött D-vitamin felvétele szükséges, mások pedig úgy tűnik, hogy hozzáférnek a szabad vagy nem kötött D-vitaminhoz (Chun et al. 2014).
Potenciálisan jelentős mennyiségű D-vitamint figyeltek meg az emberek bőrében, májában, vázizomzatában és zsírszövetében (Mawer et al. 1972), bizonyítékkal arra, hogy a vesén kívüli szövetek (például a placenta) képesek a D-vitamin metabolizálására (Weisman et al. 1979; Adams és Hewison 2012). Jelen áttekintés a zsírszövet szerepére összpontosít, feltárva a D-vitamin felhalmozódását ebben a méretes raktárban, és feltárja a D-vitamin zsírból történő mobilizálásának lehetséges mechanizmusait a jól megalapozott fiziológiai koncepciók összefüggésében.
A D-vitamin felhalmozódása a zsírban
Míg a zsír a D3-vitamint és a 25 (OH) D-vitamint egyaránt felhalmozhatja, a rendelkezésre álló korlátozott adatok arra utalnak, hogy a D3-vitamin koncentrációja sokkal nagyobb (Piccolo et al. 2013; Didriksen et al. 2015). A szubkután zsírszövetben jelenlévő D3-vitamin mennyiségének közzétett értékei jelentősen változnak, a következőktől:
500 ng/g, ami nagy egyéni változékonyságra és a kiegészítési státus függőségére utal (Didriksen et al. 2015). 100 kg testsúlyú, 40% testzsírral rendelkező egyén esetében ez 160–20 000 μg D3-vitaminnak felelhet meg, ami megegyezik a teljes étrendi D-vitamin napi tápanyag-bevitelének (RNI) 16–2000 napja közötti értékkel. (10 μg) az Egyesült Királyság lakossága számára (1. ábra). A D3-vitamin mediánértéke a zsírban nem kiegészítő a túlsúlyos vagy elhízott emberek 32 ng/g (Didriksen et al. 2015), amely az RNI 128 napjának felel meg. Így a zsírszövet jelentős mennyiségű D-vitamint képes felhalmozni, különösen akkor, ha a zsírtömeg bővül (azaz. túlsúly és elhízás esetén).
Elhízás és D-vitamin állapota
Korai tanulmányok szerint a megnövekedett keringő 1,25 (OH) 2D elhízással csökkenti a szérum 25 (OH) D-t azáltal, hogy negatív visszacsatolás révén csökkenti a 25 (OH) D májszintézisét (Bell et al. 1984, 1985). A zsírtömeg és a keringő 1,25 (OH) 2D (Parikh et al. 2004), megkérdőjelezve egy negatív visszacsatolási mechanizmus létezését, amelynek révén az 1,25 (OH) 2D feleslegének termelése és felhalmozódása csökkentené a 25 (OH) D szintézist. Alternatív megoldásként az alacsony keringésű D-vitamin az elhízásban szenvedőknél a megnövekedett metabolikus clearance-nek és a D-vitamin zsírszövet általi fokozott felvételének tulajdonítható (Liel et al. 1988). A 25 (OH) D 1,25 (OH) 2D-dé történő metabolizálásáért felelős enzimek szabályozása valószínűleg nem járul hozzá a szérum 25 (OH) D csökkenéséhez, mivel a keringő 1,25 (OH) 2D szintje lényegesen alacsonyabb, mint a 25 (OH) D (
1: 400) (Ajkak 2007). Wamberg et al. (2013) számos D-vitamin-hidroxiláz expresszióját elemezte karcsú és elhízott nők zsigeri és szubkután hasi zsírszövetében. A sovány és az elhízott egyének között nem volt különbség a CYP24A1 expresszióban (a D-vitamin katabolizálásáért felelős fő enzim). Hasonló eredményeket azóta megismételtek az elhízással küzdő egyének csoportjában (Di Nisio et al. 2017). Ezek a tanulmányok együttesen azt sugallják, hogy az elhízott egyének zsírszövetében a CYP2J2-25-hidroxiláció és az 1α-hidroxiláció károsabb, mintsem szabályozott, ezért nem támogatják azt az elképzelést, hogy az elhízásban megfigyelt csökkent szisztémás 25 (OH) D koncentráció a zsírban lévő D-vitamin fokozott metabolizmusa okozza. Stabil izotópok alkalmazásával végzett újabb, nemrégiben végzett vizsgálatok azt mutatják, hogy az elhízással járó teljes 25 (OH) D felezési idő nincs különbség (Walsh et al. 2016). Ezért úgy tűnik, hogy a zsír nem aktív metabolizál több D-vitamint elhízott egyéneknél, és úgy tűnik, hogy az elhízásnak nincs hatása az általános 25 (OH) D anyagcserére és forgalomra. Ehelyett az elhízás legszembetűnőbb hatása az látszik, hogy a zsír a D-vitamin mosogatójává vagy tározójává válik.
A D-vitamin szerepe a zsírban?
A zsírszövet heterogén sejteket tartalmaz, beleértve az adipocitákat, a különféle immunsejteket és a preadipocitákat. A zsírsejtek sejtösszetétele hatással van a zsírgyulladásra (Bourlier et al. 2008) és a gyulladásos mediátorok szekréciója (Maury & Brichard 2010), amely különösen releváns az elhízással küzdő egyének számára, mivel hozzájárul a szisztémás alacsony fokú gyulladáshoz (Trim et al. 2018).
Humán adipociták kezelése in vitro 1,25 (OH) 2D-vel csökkenti az interleukin 6 szekrécióját (Mutt et al. 2012), ami azt sugallja, hogy az 1,25 (OH) 2D gátolja az IKBα foszforilációját, amelynek gátló hatása van az NF-кB-re (Baeuerle & Baltimore 1988). Az NF ‐ кB a pro-gyulladásos utak transzkripcióját indukálja (Baldwin 1996), így a D-vitamin potenciálisan gyulladáscsökkentő a zsírszövetben, ha rendelkezésre áll fiziológiai hatások kifejtésére. A D-vitamin szintén fontos lehet az új zsírsejtek képződéséhez, és ezt másutt részletesen áttekintették (Dix et al. 2018). Úgy gondolják, hogy a peroxisome proliferátor-aktivált gamma receptor (PPARγ) az adipogenezis „fő szabályozója”, a differenciálódást a PPARγ és a CCAAT enhancer-kötő fehérje α egyidejű expressziója tartja fenn (Rosen et al. 2002). Az emberi preadipociták vizsgálata azt sugallja, hogy 1,25 (OH) 2D elősegíti az adipogenezist (Nimitphong et al. 2012). Narvaez et al. (2013) hasonló hatásokat talált az emberi mezenhimális progenitor sejtekben (hMPC), ahol 1,25 (OH) 2D fokozta az adipogén marker gének expresszióját, beleértve a zsírsav szintetázt, a zsírsavat megkötő fehérjéket és a PPARγ.
In vitro tanulmányok érdekes betekintést nyújtanak a D-vitamin potenciális funkcióiba magában a zsírszövetben. Sajnos nagyon keveset tudunk a D-vitamin metabolitok mennyiségéről/eloszlásáról és az 1,25 (OH) 2D zsírszövetben kifejtett hatásáról in vivo. Továbbá fontos megjegyezni, hogy a D3 vagy a 25 (OH) D-vitamin egyszerű mérése zsírbiopsziás mintákban nem tárja fel, hogy az aktív 1,25 (OH) 2D milyen mértékben áll rendelkezésre biológiai aktivitáshoz.
A D-vitamin potenciálisan pozitív hatása a zsírszövet fiziológiájára és működésére nagyon érdekes utat jelent a további kutatások számára. Mivel azonban a D-vitamin valószínűleg elkülönül az adipociták lipidcseppjeiben, várható, hogy csak a citoszolba és/vagy az interstitiumba mobilizálódva gyakorol fiziológiai hatásokat a zsírban. Érdekes paradoxon, hogy az elhízott egyéneknél a D-vitamin úgy tűnik, hogy „csapdába esik” az adipociták lipidcseppjeiben olyan helyek közelében, amelyek potenciálisan előnyösek lehetnek, ha csak biológiailag elérhetővé tehetők.
Fizikai aktivitás/testmozgás és D-vitamin állapota
A lipolízis, mint a D-vitamin mozgás kulcsfontosságú mechanizmusa a testmozgással?
A testmozgás során emelkedik a plazma glükagon, az adrenalin és a pitvari natriuretikus peptid (ANP) (Galbo et al. 1975; Virágzás et al. 1976; Gyntelberg et al. 1977; Jezova et al. 1985; McMurray et al. 1987; Moro et al. 2007) és a plazma inzulin csökkenése (Hodgetts et al. 1991), fokozott zsírszöveti véráramlással egyidejűleg (Thompson et al. 2012). A glükagon, az adrenalin és az ANP stimuláló lipolitikus hormon (Arner et al. 1990; Perea et al. 1995; Moro et al. 2007) és az inzulin elnyomása a lipolízis erőteljes növekedéséhez vezet (Jensen et al. 1989). Ez az adipociták lipidcseppjeiből a triacil-glicerin hidrolíziséhez vezet a zsír-triglicerid-lipáz (ATGL) hatására (Jenkins et al. 2004; Villena et al. 2004; Zimmermann et al. 2004) és hormonérzékeny lipáz (HSL) (Vaughan et al. 1964). Az éhgyomri vagy táplált állapotban végzett testmozgás a zsírszöveti lipolízis hozzávetőleges kétszeres-háromszorosához vezet (Wolfe et al. 1990; Klein et al. 1994; Enevoldsen et al. 2004), és amikor a tárolt triacil-glicerin hidrolizálódik, a D-vitamin metabolitok is felszabadulhatnak a lipidcseppekből (3. ábra).
Az elhízott egyéneknél a zsírszövet lipolitikus válasza a testmozgásra káros. Ex vivo Az elhízással küzdő egyének zsírszövet-explantánsai csökkentik az adrenerg stimulációra adott maximális lipolitikus válaszokat, szemben az elhízás nélküli egyének zsírjával (Reynisdottir et al. 1994; Nagy et al. 1999; Hellstrom & Reynisdottir 2000), egybeesve az ATGL és a HSL csökkent génexpressziójával (Large et al. 1999; Langin et al. 2005; Jocken et al. 2007; McQuaid et al. 2011). Ezeket a megállapításokat alátámasztják in vivo, mivel az elhízott egyéneknél alacsonyabb a lipolízis gyakorisága edzés közben, mint a sovány kontrolloknál (Stich et al. 2000; Mittendorfer et al. 2004). Míg ez megvédheti az elhízott embereket az emelkedett keringő zsírsavaktól (McQuaid et al. 2011), hozzájárulhat a D-vitamin megkötéséhez is. Ennek az állításnak az alátámasztása érdekében az elhízást szenvedő egyénekből származó zsír explantánsok kevesebb D-vitamint szabadítanak fel, ha lipolitikus hormonokkal stimulálják őket, mint a sovány kontrollokból származó explantátok (Di Nisio et al. 2017). Ebben a tanulmányban a D-vitamin mobilizálása arányos volt mind a béta-adrenerg receptorok lipolitikus válaszával (glicerin felszabadulás), mind a fehérje expressziójával (Di Nisio et al. 2017); alátámasztva azt az elképzelést, hogy a D-vitamin mobilizálása eredendően a lipolízishez kapcsolódik.
A testmozgás a zsírszövet diszfunkcióját is célozhatja elhízás esetén. Megalapozott, hogy a fizikai aktivitás növekedése krónikusan javítja az adipocita funkciót (Thompson et al. 2012). A testedzés növeli a túlsúlyos/elhízott zsírszövet érzékenységét különböző mediátorok, például inzulin és adrenalin iránt (Thompson et al. 2012). Nemrégiben bebizonyosodott, hogy a képzett személyek nagyobb mennyiségű lipolitikus enzimet tartalmaznak a szubkután hasi zsírszövetben (Bertholdt et al. 2018). Így az egyes testmozgásokkal járó D-vitamin felszabadulásra gyakorolt akut hatás mellett a rendszeres testmozgás javítja az adipocita működését és az ingerléskor bekövetkező válaszadás képességét, amely magában foglalhatja a D-vitamin mozgatásának képességét többféle ingerre válaszul (például. fizikai aktivitás, böjt és stressz).
A testmozgás hatása a D-vitamin mobilizálására: A VitaDEx projekt
Az edzés közbeni beavatkozások során egy másik potenciális kockázat az energiaegyensúly változása és a fogyás változatos étrend-kompenzáció következtében (Turner et al. 2010), ezért kompenzálni fogjuk az energiafogyasztás növekedését az előírt ételekkel, hogy teljes mértékben ellensúlyozzuk a testmozgás során elköltött energiát (így fenntartva az energiaegyensúlyt). Az energiafogyasztást az edzés során figyelemmel kísérjük, hogy az elköltött energiát D-vitamint nem tartalmazó ételekkel pótolhassuk, és a testösszetétel változásának kettős röntgenabszorpció-méréssel (DEXA) történő ellenőrzésével ellenőrizzük ennek az energiapótlásnak a megfelelőségét. Az étrend bevitelét 3 napos súlyozott étrend-nyilvántartással kell rögzíteni a beavatkozást megelőző héten és annak utolsó hetében, valamint egy retrospektív táplálék-gyakorisági kérdőívet mindkét időpontban, hogy pontosabban rögzítsük a D-vitamin táplálékforrásait fogyasztják.
Következtetések
Köszönetnyilvánítás
Ezt a munkát a BBSRC támogatása finanszírozza (BB/R018928/1). A KSJ-t és az AK-t az Országos Egészségügyi Kutatóintézet (NIHR) Cambridge Biomedical Research Center (IS ‐ BRC ‐ 1215–20014) támogatja. Az NIHR Cambridge Biomedical Research Center a Cambridge University Hospitals NHS Foundation Trust és a Cambridge-i Egyetem közötti partnerség, amelyet az NIHR finanszíroz. A kifejtett nézetek a szerzők véleménye, nem feltétlenül az NHS, az NIHR vagy az Egészségügyi és Szociális Gondozási Minisztérium véleményei.
Összeférhetetlenség
A szerzőknek nincs összeférhetetlenségük.
Szerző hozzájárulás
AH és DT konceptualizálta a munkát; AH és DT írta az első tervezetet; A JTG kezdeti szellemi betekintést nyújtott; KSJ és MH további intellektuális betekintést nyújtott; az összes szerző szerkesztette a kéziratot, és minden szerző a benyújtás előtt megállapodott a kézirat végleges változatáról.
- A peri-hasnyálmirigy zsigeri zsírszövetének robusztus korai gyulladása az étrend okozta
- A perivascularis zsírszövet szerepe a magas vérnyomásban és az ateroszklerózisban antioxidánsok és redox
- A többszörösen telítetlen zsírsavak toborozzák a barna zsírszövetet, ami megnövelte az UCP-tartalmat és az NST-kapacitást
- A zsírréteg nemcsak a zsírraktározás egy összetett endokrin szerv, a De Gruyter Science
- Táplálkozás A táplálkozás teljes, teljes szövegű hatásai Az étrend a barna zsírszöveten embernél szisztematikus