A ghrelin szerepe az ételjutalomban: a ghrelin hatása a szacharóz önadagolására, valamint a mezolimbikus dopamin- és acetilkolin-receptor gén expressziójára
Absztrakt
BEVEZETÉS
Megalapozott, hogy a keringő ghrelin hormon fontos szerepet játszik az energiaegyensúly szabályozásában (Kojima et al. 1999; Nogueiras, Tschöp & Zigman 2008). Elsősorban a gyomor által szabadított fel (Dornonville de la Cour et al. 2001), a ghrelin a központi idegrendszer (CNS) receptorának stimulálásával erős orexigén hatásokat vált ki mind rágcsálókban, mind emberben (Wren és mtsai 2000, 2001). 2009a), a növekedési hormon szekretagóg receptor (GHS-R1A) (Howard és mtsai 1996). Valójában a ghrelin a táplálkozásban és az energia homeosztázisában részt vevő hipotalamusz és agytörzs áramköröket célozza meg (Dickson, Leng és Robinson 1993; Bailey és mtsai 2000; Hewson és Dickson 2000; Faulconbridge és mtsai, 2003, 2008). A táplálkozási magatartást azonban nemcsak a tápanyag-utánpótlás igénye (vagyis a homeosztázis helyreállításának szükségessége) motiválja; az ízletes, magas zsírtartalmú és/vagy cukros ételek a jóllakottság állapota ellenére is motiválhatják a bevitelt (Zheng et al. 2009). Az ízletes természetes erősségek, például a cukor túlfogyasztása a jelenlegi elhízási járvány fő tényezője. Meg kell még határozni, hogy a központi ghrelin jelzőrendszer fontos-e a nem homeosztatikus cukorfogyasztás szempontjából, ezáltal potenciálisan fontos terápiás célpontot biztosítva a kalóriatartalmú, ízletes és kifizetődő édes ételek fogyasztásának elnyomásához.
A legújabb eredmények alapján, hogy a ghrelin kölcsönhatásba lép a nem homeosztatikus/jutalomtáplálásban részt vevő mezolimbikus területekkel (Jerlhag et al. 2007), arra törekedtünk, hogy felmérjük a ghrelin és receptora szerepét az élelmiszer-motivációban és a szacharóz jutalom célirányos viselkedésében. Ezek a mezolimbikus területek már régóta a kábítószer-függőségi kutatások középpontjában állnak, mivel ezek jelentik a legtöbb visszaélés kábítószerének célpontját (Engel 1977; Koob 1992). A ghrelin mezolimbikus célútja magában foglalja a ventrális tegmentális terület (VTA) és a nucleus accumbens (NAcc) közötti dopamin vetületet (Jerlhag et al. 2006, 2007), amely utat ad mind az addiktív kémiai gyógyszerek, mind a természetes jutalmak, beleértve az ételt is (Koob 1992). Érdekes módon a GHS-R1A dopaminerg neuronokon expresszálódik (Abizaid és mtsai. 2006), ami a ghrelin lehetséges közvetlen hatásait vonja maga után a VTA dopamin rendszerre. Ezeket az immunhisztokémiai adatokat kiegészítik a ghrelin hatásának halmozódó viselkedési és elektrofiziológiai bizonyítékai a VTA-ban. Például a ghrelin VTA-n belüli beadása növeli a VTA dopamin neuronok aktivitását (Abizaid et al. 2006), és növeli a dopamin felszabadulását a NAcc-be (Jerlhag et al. 2007). A Ghrelin emeli a kolinerg – dopaminerg kapcsolat aktivitását is, ami egy fontos jutalomút. Úgy tűnik, hogy a ghrelin dopaminra gyakorolt hatásainak legalább egy részét a kolinerg rendszer közvetíti (Jerlhag et al. 2007).
MÓD
Állatok
Felnőtt hím Sprague-Dawley patkányokat (200–250 g, Charles River, Németország) 12 órás világos/sötét ciklusban helyeztünk el rendszeres chow-val és ad libitum vízzel, hacsak másképp nem jelezzük. Minden állatkísérletet etikai engedéllyel és a Göteborgi Egyetem Állatgondozási és Felhasználási Bizottságának irányelveivel összhangban hajtottak végre.
Sebészet
Operáns kondicionáló modell
Berendezés
Az operáns kondicionálási kísérleteket nyolc patkányoknak tervezett operáns kondicionáló kamrában (30,5 × 24,1 × 21,0 cm; Medical-Associates, Georgia, VT, USA) végeztük, amelyeket hangtompított, gyengén megvilágított szekrénybe helyeztünk. Mindegyik kamrának volt egy fémrács-padlója, két visszahúzható kar fölött fehér izzókkal és egy élelmiszerpellet-adagolóval, amely 45 mg szacharóz-pelletet (GlaxoSmithKline, Test Diet, Richmond, IN, USA) tud szállítani az ételtálcára. Az adatgyűjtést és -feldolgozást a MED-PC szoftver vezérelte (Medical-Associates, Georgia, VT, USA).
Kiképzés
Kísérleti terv
Valamennyi patkány intraperitoneális (IP) vagy egy különálló patkánycsoportban kapott harmadik kamrai (harmadik ICV) injekciót a fényciklus elején (a ghrelin teszteknél) és a fényciklus végén a ghrelin antagonista kísérleteknél 20 perccel a kezdés előtt. az operáns tesztelésének. Minden körülményt legalább 48 órával elválasztottunk, és ellensúlyoztuk őket (mindegyik patkány minden vizsgálati napon külön feltételeket kapott).
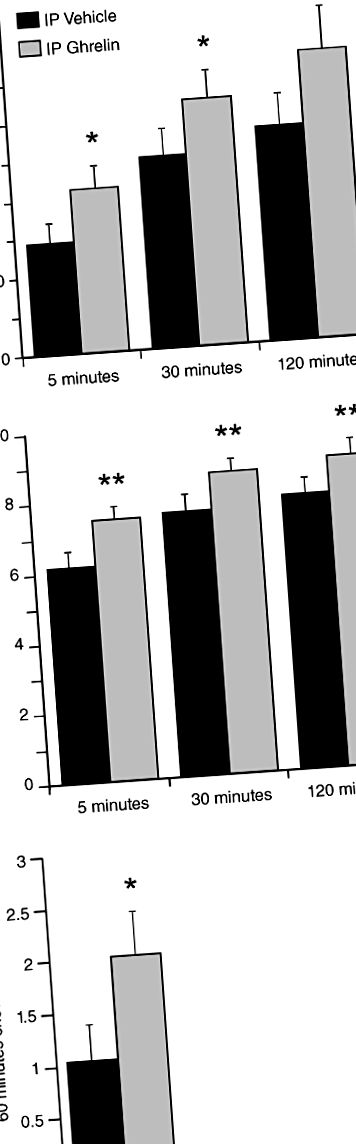
1. kísérlet: A perifériás vagy központi ghrelin beadásának hatása a PR-operánsra, amely patkányokban reagál a szacharózra
Valamennyi patkány esetében a karnyomásos válaszokat két körülmény után vizsgáltuk: sóoldattal vagy acilezett patkány grelinnel végzett IP-kezelést (Tocris, Bristol, Egyesült Királyság; 0,33 mg/testtömeg-kg 1 ml/kg-nál). A kiválasztott IP ghrelin dózisról korábban kimutatták, hogy patkányokban táplálkozási választ vált ki (Wren és mtsai. 2000), valamint egerekben accumbalis dopamin felszabadulást és mozgásszervi aktivitást vált ki (Jerlhag 2008). Az operáns tesztelés után a patkányoknak szabad hozzáférést biztosítottak a chow-hoz, és egy órán át mértük a chow bevitelt. Ezután egy külön patkánycsoportban megvizsgáltuk a válaszokat a célzott központi idegrendszeri gyógyszer bejuttatása után három körülmény után, az alábbiak szerint: kontroll állapot harmadik kamrai sóoldattal, 0,5 µg vagy 1,0 µg acilezett patkány ghrelin (Tocris) 1 µl térfogatban. A kiválasztott ghrelin dózisokról korábban kimutatták, hogy táplálékreakciókat váltanak ki (Nakazato és mtsai 2001). Mind az ICV, mind az IP ghrelin vizsgálat során a kar megnyomásával végzett kísérleteket telített állapotban hajtották végre (vagyis amikor az étel bevitelét az étel jutalmazó tulajdonságai, nem pedig a homeosztatikus hajtások hajtják). Ezenkívül mindkét vizsgálatban, az operáns tesztelés után, a patkányoknak szabad hozzáférést biztosítottak a chow-hoz, és a chow bevitelt egy órás periódus után mértük.
2. kísérlet: A ghrelin receptor (GHS-R1A) antagonistával (JMV2959) végzett perifériás vagy központi kezelés hatása a szacharóz jutalom ösztönző motivációjára patkányokban
A PR operáns válaszokat három körülmény után vizsgáltuk: a kontroll állapot IP sóoldattal, 1 mg/kg vagy 3 mg/kg JMV2959 (AEZS-123, AeternaZentaris GmBH, Frankfurt, Németország). A JMV2959 dózisokat Jerlhag et al. (2009) és Egecioglu és mtsai. (2010) és előzetes adatok, amelyekről korábban kimutatták, hogy csökkentik a feltételes helypreferencia-viselkedést, de nincsenek független hatással a mozgásszervi aktivitásra. Az operáns tesztelés után a patkányoknak szabad hozzáférést biztosítottak az állathoz. A közvetlen akut központi antagonista hatás hatásainak értékeléséhez egy különálló patkánycsoportban az operáns viselkedését a következő három körülmény után vizsgáltuk: kontroll állapot harmadik kamrai sóoldattal, 5 µg vagy 10 µg JMV2959 1 µl térfogatban. A JMV2959 dózis kiválasztott ICV-dózisai Saloméet al. (2009a), amelyben blokkolták az 1 µg ghrelin által beadott ICV orexigén hatását. Az operáns vizsgálat után a patkányoknak szabad hozzáférést biztosítottak a chow-hoz, és a chow bevitelt egy órás periódus után, valamint a kezdeti injekció után 24 órával mértük. A GHS-R1A antagonistával végzett vizsgálatokat, ellentétben a ghrelinnel végzett vizsgálatokkal (lásd korábban), az injekciókat megelőző 16 órás táplálékkorlátozást követően a patkányokon végeztük az endogén keringő ghrelin magas szintjének biztosítása érdekében (Cummings et al. 2001).
3. kísérlet: ghrelin által kiváltott változások a dopamin- és acetilkolin-rokon gének expressziójában a VTA-ban és NAcc-ben
Itt két hétig meghatároztuk a krónikus ICV ghrelin infúzió hatását a dopaminerg és kolinerg transzmisszióban részt vevő szelektált gének expressziójára két kulcsfontosságú mezolimbikus jutalomút-csomópontban, a VTA és NAcc. A kiválasztott dopaminnal kapcsolatos gének a dopamin-receptorokat (D1A, D2, D3, D5), a katekol-O-metil-transzferázt, a tirozin-hidroxilázt (csak VTA-ban) és a monoamin-oxidáz A-t kódoló gének voltak. Az acetilkolinhoz kapcsolódó gének a következők voltak: nikotin-receptor alegységek (α3 α6, β2, β3). Azok a gének, amelyeket kiértékeltünk, korábban szerepet játszottak a ghrelin hatásaiban és/vagy a jutalmazási/motivációs viselkedésben (Kelley et al. 2002; Figlewicz et al. 2006; Jerlhag et al. 2006, 2007; Sibilia et al. 2006; Dalley et al. al. 2007; Kuzmin és mtsai 2009; Lee és mtsai 2009; Nimitvilai és Brodie 2010; Perello és mtsai 2010). Krónikus ghrelin/fiziológiás sóoldat infúziós protokollt alkalmaztak az akut injekció helyett, annak érdekében, hogy növeljék annak esélyét, hogy a génexpresszióra hatással legyenek; ráadásul, ha a ghrelin hosszú távon fontos szabályozója a jutalmazási rendszernek, elősegítve a túlevést és az elhízást, akkor a legfontosabb jutalmazási mechanizmusokat megváltoztató krónikus hatásai valószínűleg jelentősek lesznek.
Gyógyszeradagolás és szöveti boncolás
A katétert és az ozmotikus pumpát acetilezett humán ghrelin (ajándék a Rose Pharma, Koppenhága, Dánia) oldattal (8,3 ug/patkány/nap) vagy fiziológiás sóoldathoz (0,9% NaCl) töltöttük; ez a dózis és a kezelés hossza korábban kimutatták, hogy befolyásolja a hipotalamusz génexpresszióját (Saloméet al. 2009b). Tizennégy nappal a minipumpák beültetése után a patkányokat lefejezéssel leöltük. Az agyakat gyorsan eltávolítottuk, és a VTA-t és a NAcc-t agyi mátrix segítségével boncoltuk (az egyes régiók határait Paxinos és Watson 1986 alapján határoztuk meg), folyékony nitrogénben lefagyasztottuk és –80 ° C-on tároltuk, hogy később meghatározzuk az mRNS expresszióját.
RNS izolálás és mRNS expresszió
A génexpressziós értékeket a ΔΔCt módszer alapján számítottuk ki (Livak & Schmittgen 2001), ahol a sóoldattal kezelt csoportot jelöltük ki kalibrátornak. Röviden: ΔCt a célgén küszöbciklusát (Ct) jelenti a mínusz a referenciagéné, és ΔΔCt a ghrelinnel kezelt csoport ΔCt-jét mínusz a kalibrátoré. A relatív mennyiségeket a relatív mennyiség = 2 −ΔΔCt egyenlet alkalmazásával határoztuk meg. A kalibrátorminta esetében az egyenlet relatív mennyiség = 2 −0, ami 1; ezért minden más mintát ehhez viszonyítva fejezünk ki. Gliceraldehid-3-foszfát-dehidrogenázt használtunk referencia génként.
Statisztika
3. kísérlet: ghrelin által kiváltott változások a dopamin- és acetilkolin-rokon gének expressziójában a VTA-ban és NAcc-ben
Jelen tanulmányban azt is megvizsgáltuk, hogy a ghrelin megváltoztatja-e a dopamin- és acetilkolin-rokon géneket a kulcsfontosságú mezolimbikus csomópontokban, a VTA és NAcc, megvizsgálva a krónikus központi ghrelin-kezelés hatását a kiválasztott dopamin-receptorok és az érintett enzimek expressziójára. a dopamin termelésében és anyagcseréjében, egy olyan paradigmában, amelyet már kialakítottak a ghrelinhez kapcsolódó változások előállítására a hipotalamuszban a génexpresszióban (Saloméet al. 2009b). A VTA dopaminreceptorában a D5 és a nikotin-acetilkolin-receptor (nAChRβ2) mRNS-expressziója megnövekedett a ghrelinnel kezelt patkányokban a sóoldattal kezelt csoporthoz képest (5a. Ábra). Az NAcc-ben a D1A, D3 és D5 dopamin receptorokat kódoló gének és a nikotin-acetilkolin-receptor nAChRα3 mRNS-expressziója csökkent volt a ghrelinnel kezelt patkányokban a sóoldattal kezelt csoporthoz képest (5b. Ábra).
- A Nutrition létfontosságú szerepe a mentesítés tervezésében Gordon Food Service
- Elhízás és a környezet - a gyorsétterem hatása - Közegészségügy
- Parmigiano Reggiano; s Az élelmiszer-kultúrára gyakorolt hatás
- Tápanyagok Ingyenes teljes szöveges intraluminalis hatása az ételnek Új betekintés az MRI HTML-ből
- NOBL Foods Kutya kutyaeledel We; ve rúgta ki a vacakokat Kibble-ből!