A glikolízis és a glükóz oxidációjának leválasztása a megőrzött ejekciós frakcióval járó szívelégtelenség kialakulását kíséri
Absztrakt
Háttér
A szívenergia-anyagcsere változásai hozzájárulnak a szívelégtelenség (HF) kialakulásához és súlyosságához. Súlyos HF esetén az összes mitokondriális oxidatív anyagcsere jelentősen csökken, ami csökkent energiatartalékot eredményez. Annak ellenére, hogy társadalmunkban a HF tartós ejekciós frakcióval (HFpEF) igen elterjedt, nem világos, hogy a szív energia-anyagcseréjében milyen változások következnek be a HFpEF-ben, és az energia-anyagcsere változásai hozzájárulnak-e a kontraktilis diszfunkció kialakulásához.
Mód
Közvetlenül értékeltük a teljes energia-anyagcserét a HFpEF kifejlődése során Dahl-sóérzékeny patkányokban, magas sótartalmú étrenddel (HSD) táplálva 3, 6 és 9 hétig.
Eredmények
9 hét alatt a HSD a diasztolés funkció progresszív csökkenését okozta (az E ’/ A’ echokardiográfiás értékelésével értékelték). Ez a szívglikolízis sebességének fokozatos növekedésével járt (a HSD 3., 6. és 9. hetében kapott izolált dolgozó szívekben értékelve). Ezzel ellentétben a glikolízisből következő glükóz-oxidáció (glükóz-oxidáció) nem változott, ami a glükóz-anyagcsere függetlenítését és a protontermelés jelentős növekedését eredményezte. A megnövekedett glükóz transzporter (GLUT) 1 expresszió kísérte ezt a glikolízis emelkedést. A szívzsírsav oxidációjának és az adenozin-trifoszfát (ATP) termelésének csökkenését a korai HF-ben nem figyelték meg, de mindkettő szignifikánsan csökkent, mivel a HF alacsonyabb EF-vel (azaz 9 hét HSD-vel) HF-vé fejlődött.
Következtetések
Összességében megmutatjuk, hogy a fokozott glikolízis a legkorábbi energia-anyagcsere-változás, amely a HFpEF fejlődése során következik be. A glikolízis és a glükóz oxidáció szétválasztása eredményeként megnövekedett protontermelés hozzájárulhat a HFpEF kialakulásához.
Háttér
A glikolízis és a glükóz oxidációs sebességének specifikus változásai szívelégtelenségben azért fontosak, mert a glikolízis és a glükóz oxidáció szétválasztása kimutatták, hogy károsítja a szívműködést. A glikolízis szelektív növekedése a glükóz oxidációjához viszonyítva elválasztja a glikolízist a glükóz oxidációjától, ami laktát és protonok termelését eredményezheti (Liu et al. 1996; Liu et al. 2002; Folmes et al. 2006). A protonok emelése és a pH csökkenése csökkentheti a felnőtt szív kontraktilitását azáltal, hogy rontja a troponin I kalciumérzékenységét és gátolja a lassú kalciumáramot (Chesnais et al. 1975; Vogel and Sperelakis 1977; Steenbergen et al. 1977; Schiaffino et al. 1993; Morimoto és Goto 2000). Ezenkívül az ATP-t mind a protonok eltávolítására, mind a nátrium- és kalcium homeosztázis fenntartására használják, ami csökkenti a szív hatékonyságát és hozzájárul a szívműködés csökkenéséhez (Lopaschuk et al. 2010).
Bár jelentős mennyiségű bizonyíték utal arra, hogy a csökkent ejekciós frakcióval (HFrEF) rendelkező szívelégtelenségre általában az oxidatív anyagcsere általános csökkenése és a glikolízis relatív növekedése jellemző (ami a glikolízis és a glükóz oxidációjának fokozottabb leválasztását eredményezheti), a szívelégtelenség másik gyakori formája, a konzervált ejekciós frakcióval járó szívelégtelenség (HFpEF) anyagcseréjével kapcsolatos kutatások szűkössége. Ebben a tanulmányban ezért megvizsgáltuk a mitokondriális oxidatív anyagcserét és a glikolízist a HFpEF kialakulása során. Ezt a Dahl-sóérzékeny patkány segítségével vizsgálták, a HFpEF jól jellemzett modelljével (Horgan és mtsai 2014; Rapp és Dene 1985; Klotz és mtsai 2006), és a szívenergia-anyagcserét 3 hét, 6 hét vagy 9 hét magas sótartalmú étrenden (HSD).
Mód
Állati protokoll
Nyolc hetes hím Dahl-sóérzékeny patkányokat vagy szokásos, alacsony sótartalmú étrenddel etettek, amely 0,3% NaCl-ot tartalmaz (Research Diets, D10012G), vagy magas sótartalmú étrendet (HSD) (Research Diets, D11021901), amely 8% NaCl-ot tartalmaz, a HFpEF indukálásához. A kontroll patkányokat alacsony sótartalmú étrenden tartottuk, míg a kezelési csoportok 3, 6 vagy 9 hétig táplálták a HSD-t. Az ételt és a vizet ad libitum szolgáltatták. A patkányokat 12 órás fényben tartottuk: 12 órás sötét ciklusban. Az állatokkal kapcsolatos összes eljárást az Alberta Egyetem Egészségtudományi Állatvédelmi Bizottsága hagyta jóvá, és megfelelt a Kanadai Állatgondozási Tanács irányelveinek (Canadian Council on Animal Care 2017).
Echokardiográfia
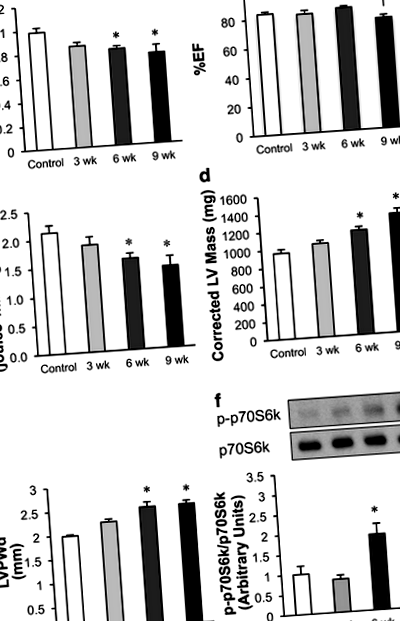
Az in vivo szívműködést 1–1,5% izofluránnal altatott patkányokon értékeltük Vevo 770 nagyfelbontású echokardiográfiai képalkotó rendszerrel (VisualSonics, Toronto) 30 MHz-es jelátalakítóval (Zhong et al. 2010). Doppler és szöveti doppler képalkotással értékelték a diasztolés funkciót: E ’/ A’, E ’, E/A, E’/E és az izovolumetrikus relaxációs idő (IVRT). M-módú képeket használtunk a% Ejection frakció (% EF) és a% Fractional shortening (% FS) mérésére, a bal kamra (LV) falának mérésére [Interventricularis septum end diastole (IVSd), LV belső átmérőjű vég diastole (LVIDd)], LV hátsó falvastagságú végdiasztolé (LVPWd), Interventricularis septum végi szisztolé (IVSs), LV belső átmérőjű végrendszer (LVIDs), LV hátsó falvastagságú végrendszer (LVPWs)], valamint az LV átmérőjének és térfogatának mérése [bal kamrai vég diasztolés átmérő, bal kamra végi szisztolés átmérő, LV térfogat végi diasztólia (LV Vol; d), LV térfogat vége sistol (LV Vol; s) és a korrigált LV tömeg].
Elszigetelt működő szívfúziók
Western blot elemzés
Statisztikai analízis
Az értékeket átlag ± SEM formában mutatjuk be. Az egyirányú varianciaanalízist (ANOVA) Bonferroni posthoc teszttel hajtottuk végre, vagy Kruskal-Wallis tesztet Dunn Multiple Comparison teszttel Prism szoftver segítségével a statisztikai szignifikancia meghatározásához. A különbségeket akkor tekintjük jelentősnek, ha p
Eredmények
Magas sótartalmú étrend (HSD) táplálása Dahl sóérzékeny patkányoknak a hipertrófia és a diasztolés diszfunkció progresszív kialakulását eredményezi
A diasztolés diszfunkció kialakulása a szív mitokondriális oxidatív anyagcseréjének csökkenésével jár dahl sóérzékeny patkányokban
A teljes energia-anyagcsere sebességét izolált, működő szívekben mértük, amelyeket a HSD 3, 6 és 9 hetében kaptunk. A zsírsav oxidációs sebességének progresszív csökkenését figyelték meg a HSD után (2a. Ábra), bár a zsírsav oxidációs sebességének jelentős csökkenése csak a HSD 9 hetében következett be. Inzulin jelenlétében a zsírsav-oxidáció hasonló időfüggő csökkenését is megfigyelték (3. táblázat). Ezzel szemben a diasztolés diszfunkció kialakulása során nem változott a glükóz oxidációs sebessége (2b. Ábra) vagy a laktát oxidációs sebessége (2c. Ábra), függetlenül attól, hogy jelen volt-e inzulin (3. táblázat), vagy hiányzott-e. A teljes szív ATP termelésének elsődleges forrása minden szívben a zsírsav oxidációból származik (2d. Ábra). Ennek eredményeként a teljes szív ATP termelési arányának csökkenését figyelték meg a HSD 9 hete, ami elsősorban a zsírsav oxidációs sebességének megfigyelt csökkenésének volt köszönhető (2d. Ábra).
A csökkent glikolízis korai energia-anyagcsere-változás a HSD-vel táplált Dahl-sóra érzékeny patkányok szívében
A legkorábbi energia metabolikus változás, amely Dahl-érzékeny, HSD-vel táplált patkányokban következett be, a glikolízis növekedése volt, amely a HSD 3 hete alatt már több mint 300% -kal nőtt (2e. Ábra). Ez a növekedés akkor is megfigyelhető volt, amikor az inzulin jelen volt a perfuzátumban (3. táblázat), vagy a HFpEF vagy a HFrEF megjelenése előtt (1. ábra). Mivel a diasztolés diszfunkció kialakulása során bekövetkezett növekedés a glikolízissel nem járt a glükóz oxidációjának növekedésével (2b. Ábra), a glikolízis és a glükóz oxidációja szétkapcsolódása következett be, ami a protontermelés jelentős növekedését eredményezte, még a HSD (2f. Ábra). Ez a fokozott glikolízis és a glükóz oxidáció szétválasztása és a protontermelés növekedése az inzulin jelenlétében perfundált szívekben is fennmaradt (3. táblázat). Mivel a glikolízis és a glükóz oxidációjának szétválasztása és a protontermelés emelkedése a diasztolés diszfunkció kialakulásának korai szakaszában fordul elő, lehetséges oksági kapcsolat áll fenn a glikolízis és a glükóz oxidáció szétválasztása és a HFpEF kialakulása között.
Annak ellenére, hogy a szívben a glikolízis aránya továbbra is magas maradt a HFrEF kifejlődésével (azaz a HSD 9 hetével), a glikolízisből származó ATP-termelés növekedése nem kompenzálta a zsírsavcsökkenés következtében bekövetkezett ATP-termelés csökkenését. oxidáció (2d. ábra, 3. táblázat).
A megnövekedett GLUT1 expresszió hozzájárulhat a glikolízis és a diasztolés diszfunkció kialakulása során megfigyelt fokozott szétválasztásához a glükóz oxidációjától
A glükóz metabolizmusában szerepet játszó különféle fehérjék expressziójának vizsgálata azt mutatta, hogy a glükóz transzportjának változása hozzájárulhat a diasztolés diszfunkció kialakulása során megfigyelhető glikolízis emelkedéséhez. A GLD1 expresszió fokozatos növekedését tapasztaltuk Dahl sóra érzékeny patkányszívekben a HSD alatt (3a. És b. Ábra). Mivel a GLUT1 az inzulintól függetlenül közvetíti a glükózfelvételt, azt sugallja, hogy a megnövekedett GLUT1 expresszió szerepet játszhat az emelkedett glikolízis arányokban, még akkor is, ha a szíveket perfundálták inzulin nélkül (2e. Ábra). Míg a PGAM1 és a GLUT4 (az inzulinfüggő glükóz transzporter) expressziója nem változott szignifikánsan a diasztolés diszfunkció kialakulása során, az LDHA szignifikánsan megnőtt 3 hét után a HSD-n (3d. Ábra). Az LDH ezen izoformája kedvez a piruvát laktáttá történő átalakulásának. Ez arra utal, hogy az LDHA hozzájárulhat a glikolízis és a glükóz-oxidáció szétválasztásának kezdeti növekedéséhez, amelyet a HSD-re adott válaszként figyeltek meg. A HIF1α-t, a glikolízist szabályozó transzkripciós faktort a HSD nem változtatta meg (3e. Ábra).
Megvizsgáltuk továbbá a mitokondriális enzimek expresszióját, amelyek hozzájárulhatnak a szív energia metabolizmusának a HSD-re adott válaszként észlelt változásaihoz. Nem figyeltünk meg jelentős változásokat a PDH-expresszióban, a glükóz oxidáció sebességét korlátozó enzimben (4a. Ábra). Míg a PDH PDH kináz általi foszforilációja csökkenti a PDH aktivitását, a pszt-diszfunkció kialakulása során a pPDH változását nem figyeltük meg (4a. És b. Ábra). A pPDH változásának ez a hiánya korrelál a glükóz-oxidációs sebesség változásának hiányával a diasztolés diszfunkció kialakulása során (2b. Ábra). Megvizsgáltuk a mitokondriális piruvát hordozó expresszióját is. Érdekes módon az MPC1 expressziója 6 hét elteltével nőtt a HSD-n, de az MPC2 expressziója nem változott jelentősen (4c. És d. Ábra). Ezenkívül a citokróm c fehérje expressziója nem változott szignifikánsan (4f. Ábra). Mivel az acetilezésről kimutatták, hogy szabályozza a mitokondriális oxidatív anyagcserét, felmértük a HSD hatását a teljes acetilezésre is. HSD-vel táplált Dahl-sóra érzékeny patkányok szívében azonban a lizin acetilációja nem változott szignifikánsan (1. kiegészítő fájl).
Vita
Míg gyakran idézik, hogy szívelégtelenség esetén a szív a zsírsavról a glükóz anyagcserére vált, adatunk szerint pontosabb azt sugallni, hogy a teljes szív mitokondriális oxidatív metabolizmusának csökkenése következik be a HFrEF-ben, a glikolízis relatív növekedésével együtt. Annak ellenére, hogy a glükóz oxidációja a glükóz eredetű ATP termelés fő forrása, a szisztolés diszfunkció kialakulása során a glükóz oxidációs sebessége nem növekszik (Kato és mtsai 2010; Lopaschuk és mtsai 2010; Zhabyeyev és mtsai 2013; Zhang és mtsai 2013; Liu és mtsai 1996; Liu és mtsai 2002). Valójában a HFrEF egérmodelljeiben valóban a glükóz oxidációs sebességének csökkenését figyeltük meg (Zhabyeyev et al. 2013; Zhang et al. 2013).
A megnövekedett glikolízis vagy glükóz transzport képesség szintén felelős lehet a glikolízis növekedéséért a diasztolés diszfunkció és a szívelégtelenség kialakulása során. Bár nem figyeltünk meg változást a glikolitikus enzim PGAM1 expressziójában, az LDHA fehérje expressziójának növekedését találtuk 3 hét után a HSD-n és később a GLUT1 fehérje expressziójának növekedését (4. ábra). Az LDHA-t tartalmazó LDH izoformák nagyobb valószínűséggel alakítják a piruvátot laktáttá, szemben az ellenkező reakció katalizálásával. Ezért a megnövekedett LDHA fehérje-expresszió hozzájárulhat a glikolízis korai növekedéséhez, valamint a glikolízis és a glükóz-oxidáció fokozott leválasztásához a HSD-re reagálva.
A fokozott szív GLUT1 expresszió szintén hozzájárulhat a glikolízis növekedéséhez. Ennek alátámasztásaként a glikolízis megemelkedik a GLUT1-t túlzott mértékben expresszáló szívekben, és csökken a GLUT1-hiányos szívekben (Liao és mtsai 2002; Pereira és mtsai 2014). A GLUT1 expresszióját szabályozó tanulmányok azonban vegyes eredményeket közölnek a GLUT1 szerepéről a szívelégtelenség kialakulásában. Míg beszámoltak arról, hogy a GLUT1 túlzott expressziója megakadályozza az egér szívében a túlterhelés okozta szívelégtelenséget, a GLUT1 törlése nem befolyásolja a nyomás túlterhelés által kiváltott szívelégtelenség kialakulásának sebességét. A GLUT1 knockout egér fokozott zsírsav-oxidációval és csökkent glükóz-oxidációval rendelkezik, ami várhatóan csökkenti a szív hatékonyságát, és megmagyarázhatja, hogy ezek a szívek miért nem rezisztensek a nyomástúlterhelés okozta szívelégtelenségben (Pereira et al. 2014). E két vizsgálat eredményei azonban nem zárják ki annak lehetőségét, hogy a GLUT1 expresszió hevesebb felfelé történő szabályozása fokozhatja a glikolízist és károsíthatja a szívműködést.
Ezen eredmények alapján feltételezzük, hogy a glükóz-oxidáció stimulálása ígéretes stratégia lehet a HFpEF kezelésében és potenciális megakadályozásában. Mint korábban említettük, a szívcukorszint oxidációjának stimulálása a szív hatékonyságának növekedésével és a szívműködés javulásával jár (Kato et al. 2010; Masoud et al. 2014; Yamashita et al. 2009; Ussher et al. 2012; Stanley et al. 2005; Lopaschuk és mtsai 2003; Dyck és mtsai 2006; Dyck és mtsai 2004). A szívcukorszint oxidációjának stimulálása az elhízás és a cukorbetegség összefüggésében is előnyös lehet, ami szívelégtelenséghez vezethet (Ussher et al. 2009; Lewis et al. 2016; Nicholl et al. 1991). Ezenkívül a Dahl-sóra érzékeny patkányok diklór-acetáttal (DCA) történő kezelése csökkenti a plazma laktátszintjét (az emelkedett glikolízis közvetett jele) és javítja a szívműködést (Kato és mtsai 2010). Ebben a tanulmányban azonban a DCA-val történő beavatkozás a szívelégtelenség kialakulásának egy későbbi szakaszában volt, amely a szisztolés funkció változásával is társult. A jövőben fontos lesz meghatározni, hogy a glükóz-oxidáció hatékonyabb PDK-gátlókkal történő stimulálása csökkentheti-e vagy akár megakadályozhatja-e a HFpEF kialakulását.
Következtetések
Ez a tanulmány közvetlenül jellemezte a szívenergia-anyagcserében a diasztolés diszfunkcióban bekövetkező változásokat. Bemutatjuk, hogy a diasztolés diszfunkció kialakulása során bekövetkező legkorábbi kardiális anyagcsere-változás a glikolízis növekedése, a szénhidrát- vagy zsírsav-oxidáció változása nélkül. A glikolízis növekedése a glikolízis és a glükóz oxidáció fokozott leválasztását és a protontermelés fokozódását eredményezte, ami a diasztolés diszfunkció kialakulásának korai szakaszában jelentkezik. Megállapításaink a korábbi munkákkal kombinálva arra utalnak, hogy a glikolízis és a glükóz oxidáció összekapcsolása fontos a normális szívműködés fenntartásában, és hozzájárulhat a HFpEF kialakulásához. Míg ezek az eredmények arra utalnak, hogy a glikolízis és a glükóz-oxidáció szétválasztásának csökkentése ígéretes stratégia lehet a szívelégtelenség kezelésében, további munkára van szükség annak eldöntésére, hogy a glikolízis és a glükóz-oxidáció kapcsolásának terápiás javítása képes-e kezelni a HFpEF-et.
- A terhességgel összefüggő szívelégtelenség fenotípusainak spektruma Echokardiográfiai vizsgálat
- Miért olyan magas a vércukorszintem, amikor felébredek- Hogyan lehet csökkenteni a reggeli vércukorszintet?
- Az egészségtelen növényi étrend növelheti a szívbetegségek kockázatát
- Milyen ételeket fogyasszak a szív egészséges étrendjéhez
- Miért okozhatja késő esti étkezés a szívét az élő tudomány?