A gyantasavak, mint a fenyő palántáinak indukálható kémiai védelme a rágó rovarok ellen
Xosé López-Goldar
1 Ökológiai és Evolúciós Biológiai Tanszék, Cornell Egyetem, Ithaca, New York, Amerikai Egyesült Államok
2 Misión Biológica de Galicia (MBG-CSIC), Pontevedra, Galícia, Spanyolország
Lina Lundborg
3 Kémiai Tanszék, Kémiai, Biotechnológiai és Egészségtudományi Egyetem, Királyi Műszaki Intézet (KTH), Stockholm, Svédország
Anna Karin Borg-Karlson
3 Kémiai Tanszék, Kémiai, Biotechnológiai és Egészségtudományi Egyetem, Királyi Műszaki Intézet (KTH), Stockholm, Svédország
Rafael Zas
2 Misión Biológica de Galicia (MBG-CSIC), Pontevedra, Galícia, Spanyolország
Luis Sampedro
2 Misión Biológica de Galicia (MBG-CSIC), Pontevedra, Galícia, Spanyolország
Társított adatok
Minden lényeges adat a kéziratban és annak kiegészítő információs fájljaiban található.
Absztrakt
Bevezetés
A védekezés indukálhatóságát a biotikus ingerekre reagálva a növények rezisztenciájának fontos tulajdonságának tekintik [21, 22]. Az indukálható válaszok a kulcsfontosságú másodlagos metabolitok kémiai profiljában és koncentrációjában specifikus változásokat vonhatnak maguk után, amelyek a támadó azonosságától függhetnek [9, 23, 24]. A másodlagos metabolitok indukálhatóságának különbségei a genotípusok, populációk vagy fajok között magyarázhatják az ellenségekkel szembeni ellenállás különbségeit [21, 22, 25]. Annak ellenére, hogy folyamatos erőfeszítéseket teszünk a másodlagos metabolitok indukált válaszainak változékonyságának és a tűlevelűek biotikus rezisztenciájára gyakorolt hatásának megértésére [lásd például a 26., 27–29. azonosságát, és hogy ezek a válaszok mennyiben különböznek a fenyőfajok között.
A fenyőfák indukált védekező képességeiről szóló meglévő ismeretek ellenére gyakran figyelmen kívül hagyták a növény disztális részeiben a károsodás helyéről származó szisztémás indukált válaszokat [30, 31]. A biotikus kihívás hatékonyan kiválthatja a helyi védekező reakciókat - és gátolhatja az ellenség bejutását a sebesült zónába -, de gátolhatja a növény disztális részeinek további agresszióit is szisztémás indukált ellenállás révén [32], vagy elősegítheti a kapcsolódó szisztémás érzékenységet [30, 33]. A tűlevelű gyanta savak szisztémásan indukált válaszait gombafertőzés [22], mechanikus sebesítés [34] vagy kémiai előhívás [35] után vizsgálták, de a rovar növényevőire adott szisztémás válaszok nagyrészt felderítetlenek.
Kísérleti
Természettudomány
Két fenyőfajra összpontosítottunk, amelyek jelenleg együtt élnek Dél-Európában. A tengeri fenyő (Pinus pinaster Ait.) Az Ibériai-félsziget őshonos faja, amelynek elterjedése Dél-Franciaországtól és Délkelet-Európától Észak-Afrikáig terjed. A monterey fenyő (P. radiata D. Don) Kaliforniából származik, Spanyolországban 1840 körül hozták be. Manapság mindkét faj átfedésben van az Ibériai-félsziget Atlanti-óceáni régiójában, 0–800 m közötti magasságban. a. s. l.
Kísérleti terv
Faktori üvegházi kísérletet végeztünk két fő tényezővel: fenyőfajokkal (P. pinaster és P. radiata) és valódi növényevő kezeléssel a növényvédelem kiváltására (védekezés, fenyő zsizsik etetés és fenyő hernyó táplálás). A kísérlet egy randomizált split-plot tervet követett, amelyet 10 blokkban replikáltunk, a növénytani kezelést az egész faktort és a fenyőfajokat az split faktort. A minta mérete összesen 60 fenyő növény volt (3 indukciós kezelés × 2 faj × 10 blokk).
Növényi anyag
A fenyőmagokat fungiciddel (Fernide®, Syngenta Agro, Spanyolország) kezeltük, hogy elkerüljük a káros kórokozók okozta interferenciát, és egyenként 2 literes edénybe vetettük, szubsztrátként perlit és tőzeg keverékét használva (1: 1, v: v) 12 g-mal. lassan felszabaduló műtrágya (Multicote®). A palántákat üveges üvegházban növesztettük, ellenőrzött fényviszonyokkal (minimum 12 óra naponta) és hőmérsékleten (naponta 25 ° C, éjszaka 10 ° C), és naponta öntöztük, ahogy azt Moreira et al. [9] egyéves korig (az átlagos fenyőmagasság 41,2 ± 2,4 cm volt a P. pinaster és 62,7 ± 4,0 cm a P. radiata esetében). Ezután az összes növényt gondosan nejlon hálóval borítottuk be, hogy elkerüljük a rovarok szökését, és véletlenszerűen kiosztottuk a növényevő kezelésekre (kontroll, fenyő zsizsik és fenyő hernyó).
Növényevő kezelések
A felnőtt fenyő zsizsikeket 2009 nyarán Nordlander csapdákkal [46] fogták el a szántóföldön, 15 ° C-on tenyésztőkamrákban tartották, és két hétig friss fenyő gallyakkal etették őket. A zsibbadás-indukciós kezelés előtt a zsizsikeket 48 órán át éheztettük Petri-csészékben nedvesített szűrőpapírral (15 ° C és sötét), majd lemértük. Minden fiatal fenyőre egy mintát tettek, hagyták táplálkozni 5 napig, majd eltávolították és újra lemérték.
A fenyő hernyókkal ellátott fészkeket 2009 nyarán gyűjtötték be a fertőzött fákról a mezőn, jéghűtőkben szállították a laboratóriumba, azonnal kinyitották, és a második csont lárvákat óvatosan elválasztották. A 10 hernyóból álló csoportokat a fentiek szerint 12 órán át éheztettük, és lemértük. Két, 10 hernyóból álló csoportot helyeztünk mindegyik növénynél, egyet a tűkön a felső részen, a másikat az alsó részen. A hernyókat 6 napig etetni hagyták, majd eltávolították, megszámolták és lemérték.
Az etetési időszak alatt egyetlen rovar sem halt meg, és minden növény károsodott. A fenyőfélék és a hernyók által okozott károk nem különböztek szignifikánsan a fenyőfajok között [47].
Mintavétel és kémiai elemzés
A növényevő-indukciós kezelések után az egyes növényeket a szár felszínének levágásával gyűjtöttük be. A középső részből származó friss 1,5 cm hosszú szárszegmenst és a véletlenszerűen kiválasztott tűmintát (kb. 0,2 g) minden növényből összegyűjtöttük, lemértük, flash-fagyasztva és kriogén fiolákban -80 ° C-on tartósítottuk terpenoid analízishez.
A terpenoidok extrakcióját a floémban és a tűkben a Sampedro és mtsai. [48] módosításokkal. A mintákat tefloncsövekben finomra őröltük folyékony nitrogénnel, és terpéneket extrahált n-hexán alkalmazásával ultrahangos fürdőben 25 ° C-on extraháltunk. Ezen kivonatok alikvotjait (500 μl) állandó N2 áram alatt szárítottuk, lehetővé téve a mono- és szeszkviterpének elpárolgását, és a fennmaradó diterpéneket és gyanta savakat szuszpendáltuk 750 μl metanolban, 0,1 mg · ml -1 heptadekánsav felhasználásával (# H3500 Sigma-Aldrich) mint belső standard. Ezután a diterpéngyanta savakat metil-észtereikké 75 μl tetrametil-ammónium-hidroxiddal derivatizáltuk (# 334901, Sigma-Aldrich).
Az extraktumokban lévő gyanta savakat KTH-ban (Stockholm, Svédország) gázkromatográfia-tömegspektrometriával (GC-MS) azonosítottuk teljes ionáramú (TIC) módban (pásztázási tartomány 40–400 m/z). A GC-MS rendszer egy Agilent HP6890 GC-ből állt, 5793 MS-szel párosítva. Az elválasztást DB-5 kapilláris oszlopon (30 m, azaz 0,25 mm, filmvastagság 0,25 μm, Agilent Technologies, CA, USA) végeztük. Mindegyik mintából 1 μl térfogatot injektáltunk osztatlan módban, hordozógázként héliumot használva, 1 ml · min -1 áramlási sebességgel. A sütőprogramot 152 ° C-ra állítottuk 2 percre, majd 3 ° C-min -1 és 260 közötti hőmérsékleti rámpát követtünk, és ezen a hőmérsékleten tartottuk 5 percig. Az injektor hőmérsékletét 250 ° C izotermre állítottuk be. Az egyes TIC-kromatogramokon jelenlévő csúcsokat (lásd az S1 ábrát) úgy azonosítottuk, hogy összehasonlítottuk spektrumaikat az MSD Enhanced Chemstation szoftverben (E.02.01.1177 verzió, Agilent Technologies, CA, USA) található NIST és Wiley Mass Spectra könyvtárakban találhatóakkal. ) és az irodalomban [49], és összehasonlítva számított retenciós indexüket az irodalomban találhatókkal [50].
A gyanta savakat mennyiségileg meghatároztuk MBG-n (Pontevedra, Spanyolország) egy Elc-5 kapilláris oszloppal (30 m, ID 0,25 mm, filmvastagság 0,25 μm, Perkin Elmer, MA) felszerelt Perkin Elmer Clarus 500 GC-láng-ionizációs detektorral (FID)., USA) egyenértékű az előző DB-5-tel. Az összes GC elválasztási paramétert ugyanúgy konfiguráltuk, mint a KTH korábbi elemzését. Hidrogént használtak hordozógázként. A FID hőmérsékletét 300 ° C-ra állítottuk be. A gyantasavak mennyiségi meghatározását az abietsav kereskedelmi standardjának (# 00010, Fluka) kalibrációs görbéjének felhasználásával végeztük. Az egyes gyantasav-koncentrációkat mg/g -1 száraz tömegben adtuk meg. Az extrahált gyantasavak arányát végül összehasonlítottuk az ugyanazon fenyőfajokon végzett korábbi kutatásokkal (a P. pinaster-re vonatkozóan eddig csak adatok álltak rendelkezésre), amelyek hasonló vagy különböző oldószereket használtak, mint a miénk, kisebb eltéréseket találtak [21, 51–54] . Ez alátámasztja a gyanta savakkal végzett extrakciós eljárásunk megbízhatóságát és reprodukálhatóságát.
Az elemzés előtt kiválasztási kritériumként egyértelmûen azonosított gyantasavak jelenlétét alkalmaztuk az indukciós kezelés legalább három mintájában (sértetlen kontrollok, fenyõzsák vagy fenyõ hernyó). Kilenc gyantasavat választottunk ki (S2 ábra). Az analitikai szétválasztások során két fő gyantasav koelúciót folytatott, és a statisztikai elemzések során egy vegyületként kezelték őket (levopimarinsav + pálinsav).
Statisztikai analízis
Minden rovar növényevő esetében vegyes modellel, korlátozott maximális valószínűséggel (PROC MIXED eljárás a SAS 9.4-ben, Cary, NC) elemeztük a növényevő kezelés hatásait az összes és az egyes gyanta savak koncentrációjára a szárban és az egyes fenyőfajok tűin. . Az indukciós kezelést (T), a fenyőfajokat (SP) és kölcsönhatásukat (T × SP) fix tényezőknek tekintették. A blokkot (B) és az interakciót (B × T) véletlenszerű tényezőként kezeltük annak érdekében, hogy a T fő hatást a megfelelő hibataggal teszteljük [55]. Független elemzéseket végeztünk minden rovar növényevőre és szövetre. Specifikus kontrasztpróbákat is végeztek minden fenyőfaj esetében, hogy megvizsgálják az egyes rovar növényevők hatásait az összes fenyőszövet összes és egyedi gyantasav koncentrációjában a kontroll növények vonatkozásában. A maradék normálist a nyers adatok log-transzformálásával értük el, ha szükséges, és a T faktor heterogén varianciamodelljeit alkalmaztuk, amikor a modell jelentősen javult. Két esetet eltávolítottak mintavételi hibák miatt. Az eredményeket a legkisebb négyzetes átlag ± standard hiba (s. E.) Formájában mutatjuk be.
A gyantasavak profiljának és koncentrációjának többváltozós változásait a fajok, a növényevő kezelések és a növényi szövetek között egy fő komponens elemzéssel elemeztük a SAS 9.4 PROC PRINCOMP alkalmazásával. A fő gyantasavakat az első két komponensben foglaltuk össze, amelyeket a T, SP és a T × SP kölcsönhatásnak a gyantasavak többváltozós profiljára gyakorolt hatásának tesztelésére a fenti vegyes modell felhasználásával.
Eredmények
Az összes gyantasav koncentrációja a növényevő növényekre reagálva
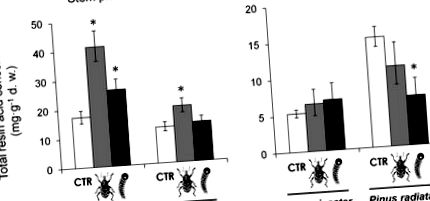
A gyantasavak összes koncentrációja mindkét növényi szövetben szignifikánsan különbözött a fenyőfajok között (1. táblázat). A gyanta savak teljes koncentrációja a szárban magasabb volt a P. pinaster-ben, mint a P. radiatában, míg a P. radiata magasabb gyanta-savkoncentrációt mutatott a tűkben, mint a P. pinaster (1. ábra). A fenyő zsizsik táplálása jelentősen megnövelte az összes gyanta sav koncentrációját mindkét fenyőfaj szárában (1. táblázat, 1A. Ábra), de a tűkben nem (1. táblázat, 1B. Ábra). Az összes gyantasav helyi indukciója a szárban a zsizsik táplálása után nagyobb volt a P. pinaster-ben, mint a P. radiata-ban (1A. Ábra). Ezek a különbségek az indukált válaszban marginálisan szignifikáns faj × zsizska kölcsönhatást eredményeztek a teljes gyanta savak koncentrációjában a szárban (1. táblázat).
Két rágó rovar növényevő, a fenyő zsizsik (szürke rúd, kéregrágó) és a fenyő hernyó (fekete rúd, defoliator) károsodásának lokális és szisztémás hatása a gyanta savak teljes koncentrációjára a szárhagymában és a kéregben (a) és a tűkben (b) fenyő palánták két faj. LS jelentése ± s.e. (N = 9–10). Az oszlopok fölötti csillag az egyes fajokon belül szignifikáns különbségeket mutat a kontroll növényekkel szemben (P 1. táblázat). Érdekes és jelentős faj × hernyó interakciót találtak azonban a tűkben lévő összes gyanta savak esetében (1. táblázat). A gyanta savak koncentrációjának 55% -os csökkenését találták a hernyó táplálása után a P. radiata tűkben, de a P. pinasterben nem észleltek egyértelmű választ (1B ábra). Az egyes fajokon belüli specifikus kontrasztok azt is jelezték, hogy a hernyó etetése után a P. pinaster száraiban az összgyanta savak szisztémás növekedése jelentős volt, a P. radiata-ban azonban nem reagáltak (1A. Ábra).
Az egyes gyantasavak koncentrációja a növényevő növényekre reagálva
A két fenyőfaj szár- és tűkivonatában lévő diterpének teljes mennyiségének több mint 95% -a a 2. ábrán bemutatott gyantasavakból állt. A pimarsavat a P. radiata tűin nem észlelték, míg a P. radiata tűin csak a miltiradiénsav nyomát mutatták ki (2. táblázat). A tűkben lévő két vegyület statisztikai elemzését a P. pinasterre korlátoztuk.
A fenyő zsizsik (szürke rudak) és a fenyő hernyó (fekete rudak) növényi indukciójának hatása az egyes gyantasavak koncentrációjára a szárflémában és két fenyőfaj tűjében. LS jelentése ± s.e. (N = 9–10). A sávok fölötti csillag szignifikáns különbségeket mutat a növényevő kezelés között a kontroll növények tekintetében az egyes vegyületekre az egyes fajokon belül (a diterpének teljes mennyiségének P 95% -a. A konstitutív koncentrációk (mg · g -1 száraz tömeg, átlag ± se) és az ellenőrző növények szárából és tűiből származó egyes gyantasavak mintanagysága (n) az egyes fenyőfajok esetében.
RT: retenciós idő.
Az összes gyantasav koncentrációja a szárakban, az izopimarinsav és a dehidroabietsav kivételével, magasabb volt a P. pinasterben, mint a P. radiatában (táblázatok (3A és 4A, 4A, 4A, 2A és 2B. Táblázatok). A P. radiata tűk azonban az összes gyantasav koncentrációja magasabb volt, mint a P. pinaster tűké, kivéve a pimársavat, a szandaracopimarinsavat és a miltiradiénsavat (táblázatok (3B és 3B és 4B, 4B táblázatok, 2C és 2D ábrák).
3. táblázat
FenyőfajokFenyő zsizsikFaj × zsizsikDfFPDfFPDfFP| a) Szár | |||
| Pimaric | 1,17 | 46.28 | 3. táblázat). Az indukált gyantasavak a szárban átlagosan 1,4-szeresek és 0,6-szor magasabbak voltak, mint a P. pinaster és a P. radiata megfelelő kontroll növényeiben (2A. És 2B. Ábra). Ezek a fajok közötti indukált válaszok mennyiségi különbségei a legtöbb gyantasav esetében szignifikáns faji × zsibbadási kölcsönhatásokban tükröződtek: pimársav, szandaracopimar, izopimár, dehidroabiet és abiet savak (3A. Táblázat). A specifikus kontrasztok azt mutatták, hogy az összes vegyület a P. pinaster szárában indukálódott (2A. Ábra), a P. radiata szárában pedig csak dehidroabietikus és abietsav indukálódott a zsizsák etetése után (2B. Ábra). A tűkben a gyanta savak koncentrációja szempontjából nem észleltünk szignifikáns faji × zsizska kölcsönhatást (3B. Táblázat). A kontroll és a zsizsik által kiváltott növények közötti összes specifikus kontraszt azt mutatta, hogy a zsizsik táplálkozása nem mutat szignifikáns szisztémás hatást az egyes gyanta savak koncentrációjára a két fenyőfaj tűjében (2C. És 2D. Ábra). |
A specifikus kontrasztok azt mutatták, hogy a hernyó etetése után a legtöbb gyanta sav szignifikánsan növelte koncentrációját a P. pinaster szárában, a P. radiata nem. (2A. És 2B. Ábra). Jelentős faj × hernyó kölcsönhatásokat azonban csak a szárban lévő miltiradién- és neoabietsavak esetében találtunk (4A. Táblázat). Ezenkívül a tűkben a gyantasavak redukciójának általános tendenciája a hernyó táplálkozására reagálva a P. radiata-ban, de a P. pinasterben nem volt tapasztalható (2C és 2D ábra), annak ellenére, hogy a fajok × hernyó kölcsönhatások csak a dehidroabietikus és az abietikus savak (4B. táblázat). A specifikus kontrasztok szignifikáns csökkenést mutattak a sandaracopimarin (-72%), az izopimar (-43%) és a dehidroabietic savak (-48%) koncentrációjában a fenyő hernyójának etetése után a P. radiata tűin a kontroll növényekhez képest (2D ábra). Gyenge válaszokat észleltek a P. pinaster tűkben. A fenyős hernyó növényevők után csak a pimasav jelentette szignifikáns csökkenést (-39%) ennél a fajnál (2.C ábra).
A gyanta savak profiljának és koncentrációjának többváltozós változásai a növényevő növényekre reagálva
a) Az egyes alkatrészek változó terhelésének grafikus ábrázolása; b) a gyantasavak kémiai profilja és koncentrációja a fenyőfajok, a növényevő kezelések és a növényi szövetek által ábrázolt többváltozós térben (színes szimbólumhatárok és hibasávok: piros = szárfloem, kék = tű). Az egyes szimbólumok és hibasávok a fenyőfajok, a növényevő kezelések és a növényi szövetek (N = 9–10 növények) kombinációinak átlagát jelentik a PC1 és a PC2 átlagát, illetve azok standard hibáit. Az egyes komponensek magyarázatát (% -ban) és sajátértékét (Ev) zárójelben tüntettük fel. Abi = abietikus, Deh = dehidroabietikus, Iso = izopimaric, Lev + Pal = levopimaric + palustric, Neo = neoabietic, Pim = pimaric, San = sandaracopimaric, Mil = miltiradienic.
- Narancssárga változat Slimex 15 zsírégető kémiai fogyókapszula a legjobb áron, Guangzhou,
- Az omega-3 zsírsavak mellékhatásai - Times of India
- A zöld bambuszból származó cellulóz szintézise és jellemzése kémiai kezeléssel mechanikával
- Nincs jelölés és a szokatlan fogyás megegyezik azzal, amit a Pine Knoll Sheep és a Wool Hillsville Virginia
- Fehérje, kreatin, aminosavak Mit csinálnak mind