‘Haláltól, vezessen a halhatatlanságig’ - az öregedő csontvázizom mantrája
Amarjit Saini
1 Sport-, Testmozgás- és Egészségtudományi Iskola, Loughborough Egyetem, Loughborough, Egyesült Királyság;
Sarabjit Mastana
1 Sport-, Testmozgás- és Egészségtudományi Iskola, Loughborough Egyetem, Loughborough, Egyesült Királyság;
Fiona Myers
2 Biológiai Tudományok Iskolája, Portsmouth Egyetem, Portsmouth, Egyesült Királyság
Mark Peter Lewis
1 Sport-, Testmozgás- és Egészségtudományi Iskola, Loughborough Egyetem, Loughborough, Egyesült Királyság;
Absztrakt
BEVEZETÉS
Az öregedésnek súlyos fiziológiai következményei vannak a vázizomzatra. A „Sarcopenia” kifejezést az életkor előrehaladtával az izomtömeg lassú, progresszív csökkenésének leírására használták [1]. Operatív szempontból a szarkopénia egy vakbélváz izomtömeg, amelyet a fiatal normálátlag alatti két szórásnál több standard szórással osztanak el méter magassággal osztva. Ehhez a feltételhez kapcsolódik az izom funkcionális tulajdonságainak fokozatos csökkenése, ideértve az erőtermelő képesség és a rövidülés maximális sebességének csökkenését, valamint az összehúzódás és relaxáció általános lassulását [1].
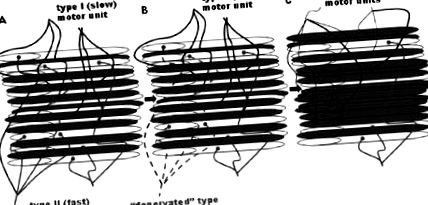
Az életkorral összefüggő izomműködés csökkenése feltételezhető, hogy mind az izom mennyiségének (tömegének), mind az izom minőségének csökkenésével függ össze (ez a kifejezés számos tényezőt felölel, beleértve az izom keresztmetszeti területre vetített erőt (CSA), a rost arányait és anyagcsere jellemzői). Az izommennyiség csökkenése a kontraktilis fehérjetartalom csökkenésével, az egyes izomrostok elvesztésével és a megmaradt izomrostok méretének csökkenésével jár (ábra. 1 1 ) [2]. Ezek a változások szelektíven befolyásolják a különböző izomrost típusokat, ezt a folyamatot „életkorral kapcsolatos motoros egységek átalakításának” nevezik (1. ábra). 1 1 ) [3]. Az idős izom lassabb fenotípus felé történő átalakításán túl a II. Típusú (gyors) rostokban a CSA jelentősen csökken, míg az I. típusú (lassú) rostok viszonylag változatlanok maradnak [4]. Hasonlóképpen leginkább az II. Típusú szálak vesznek el az öregedéssel, és az izomban nagyobb arányban maradnak az I. típusú szálak [5].
Az életkorral kapcsolatos motoros egységek átalakítása [2]. Az izomrostok denervációjának és a reinnervációnak a folyamata az egész életen át tart, és az öregedéssel felgyorsul [2, 85]. Az öregedés előrehaladtával vélhetően a gyors, II-es típusú motoregységek szelektív vesztesége következik be, és az denervált szálak vagy elvesznek, vagy pedig lassú, I-es típusú motoros egységek újból beidegződnek. A fehér szálak azok, amelyeket a közelmúltban denerváltak, és amelyek elpusztulnak, vagy egy másik (I. típusú) motoros idegsejt újraterveződik. Úgy gondolják, hogy a fennmaradó rostok CSA-értéke is csökken. Így az izmok az életkor előrehaladtával kisebbek (az általános rostveszteség miatt) és lassabbak (az I. típusú rostok megnövekedett aránya miatt) [1, 2]).
A teljes izomtömeg változásának magyarázatára különféle mechanizmusok kerültek bemutatásra (lásd 1 1 ). A javasolt mechanizmusok általában magukban foglalják a rendszeres fizikai aktivitás hiányát (mozgásszegény életmód), az endokrin funkció megváltozását (inzulin, tesztoszteron, növekedési hormon, kortizol), a neuromuszkuláris funkció elvesztését (denerváció vagy reinnerváció), a fehérje anyagcseréjének változását (hiány között fehérjeszintézis és lebontás), táplálkozás (elsősorban aminosavak), apoptózis és betegség vagy trauma [2, 6].
Asztal 1.
Az életkorral összefüggő izomtömeg-veszteség lehetséges okai (átdolgozva: [2])
| Fokozott ülő életmód |
| Csökkent a trofikus hormonok szintje és reagálóképességük |
| Csökkent növekedési hormon szint |
| Csökkent androgének (tesztoszteron) |
| Csökkent inzulinszerű növekedési faktor-I és növekedési faktor jelátvitel |
| Csökkentett dehidroepiandroszteron-szulfát (DHEAS) |
| Csökkent ösztrogének (ösztron, ösztradiol) |
| Csökkent 25-hidroxi-ergokalciferol (D-vitamin) |
| A fehérje anyagcseréjének csökkenése vagy egyensúlyhiánya |
| A neurodegeneratív folyamat növekedése |
| Izomrost atrófia |
| Gyulladás |
| A fogyatékosság fokozott előfordulása |
| Csökkent funkcionális kapacitás |
| Csökkent bazális anyagcsere sebesség |
| A génexpresszió megváltozása |
Az életkor előrehaladtával (> 85 év) a tömeg és az erő elvesztése jelentős hatással lehet a funkcionális függetlenségre [7]. Az idősek epidemiológiai tanulmányainak megállapított populációi (EPESE) adatai azt mutatják, hogy az 50–67 éves kor közötti testtömeg legalább 10% -ának csökkenése 60% -os mortalitási növekedéssel jár a stabil testsúlyú személyekhez képest [ 8]. Az intézményesített idősek otthonában a teljes testtömeg 10% -os csökkenése 6 hónapos időközönként erősen megjósolta a halálozást az azt követő 6 hónapban [9]. Azoknál a lakosoknál, akik testtömegük legalább 5% -át elveszítették, 5-10-szeresére nőtt a halálozás kockázata [10]. Az életkorral összefüggő izomtömeg-csökkenés meglehetősen állandónak tűnik, 50 éves kor felett évente körülbelül 1-2% -kal [11]. Az izomtömeg csökkenése mind ülő, mind aktív idős embereknél jelentkezik [6]. Ezzel szemben egészséges fiatal felnőtteknél nincs nettó változás a fehérjeszintézis és lebomlás sebességében. Míg az öregedés vázizomra gyakorolt hatása elkerülhetetlen, nem világos, hogy ezek a belső változások megváltoztathatatlanok vagy visszafordíthatók-e.
Vázizom-javítás
A műholdas sejtek reakciója a myotraumára ([86] -tól adaptálva). A felnőtt izmokban nyugvó műholdas sejteket a Pax7 expresszió jellemzi. Sérülés vagy terhelés után a műholdas sejtek aktiválódnak és aszimmetrikusan osztódnak, ezáltal egy önmegújuló sejtet és egy elkötelezett progenitort hoznak létre, amely elkezdi kifejezni a Myf5 izomszabályozó tényezőt. A Myf5-expresszáló sejtek belépnek a sejtciklusba, szaporodási fordulatokon mennek keresztül, amelyek MyoD-expresszáló myoblastokká válnak, amelyek később a Myogenint expresszálják és a Pax7-et csökkentik. Ez a sejtkészlet differenciálódik és összeolvad, hogy új myofibereket képezzen a felnőttek izomregenerációja során.
EPIGENETIKAI VÁLTOZÁSOK: A SZATELLIT SEJTEK SZABÁLYOZÁSÁNAK PIVOTÁLIS MECHANIZMUSA SKELETAL IZOMREGENERÁCIÓBAN az öregedés során?
Az őssejtek és környezetük életkorral kapcsolatos változásai két csoportba sorolhatók: irreverzibilis és reverzibilis (táblázat 2 2 ) [30]. Az öregedő őssejtek visszafordíthatatlan károsodása magában foglalja a belső változásokat, amelyek a nukleáris/mitokondriális DNS károsodásával és a telomer rövidülésével járhatnak, amelyeket korábban részletesen áttekintettek [30-35]. Ezzel szemben a szisztémás és lokális jelzőkörnyezetben az öregedés során is bekövetkező változások visszafordíthatók.
2. táblázat.
A műholdas őssejt öregedésének mechanizmusai: Irreverzibilis versus reverzibilis változások [30]
| Jelzési útvonalak | |
| DNS károsodás | Transzkripciós faktor aktivitás |
| Telomer erózió | Chromatin State |
| Mitokondriális diszfunkció | DNS-metilezés |
Javasoljuk, hogy az öregedés során a környezeti tényezők erősen befolyásolják a felnőtt őssejtek, például az izom műholdas sejtek életkorral kapcsolatos változásait. Amint fentebb említettük, a rendszeres fizikai aktivitás hiánya (mozgásszegény életmód), az endokrin funkció megváltozása (inzulin, tesztoszteron, növekedési hormon, kortizol)/növekedési faktor jelátvitel, a neuromuszkuláris funkció elvesztése (denerváció vagy reinnerváció), a fehérje anyagcseréjének változása ( hiány a fehérjeszintézis és a lebomlás között), a táplálkozás (elsősorban aminosavak), az apoptózis és a betegség vagy trauma között (táblázat 1 1 ) [2, 6] hatással lehet a vázizomzatra és a műholdas sejtek aktiválódási képességére, ami arra utal, hogy az életkor függő változások reverzibilisek lehetnek ezekben a szövetekben, és az öregedő vázizomzat regenerációs képességének csökkenése az idős vázkörnyezet következménye lehet a műholdas sejtek működésében és nem elsősorban a belső öregedés.
Következésképpen, ha a környezeti jelek valóban döntő szerepet játszanak az őssejtek működésében, érdemes megfontolni azokat a mechanizmusokat, amelyek révén az epigenetikus módosítás közvetítheti ezeket a válaszokat. Az „epigenetika” a kifejezés szigorú meghatározása szerint a DNS-szekvenciától független sejtosztódás útján örökölhető fenotípusos vagy génexpressziós minták tanulmányozása [36]. Újabban az epigenetika szélesebb körű meghatározását javasolták, mint a génexpresszió dinamikus szabályozását szekvenciafüggetlen mechanizmusokkal, amelyek magukban foglalják a DNS-metiláció változását és a hiszton-módosításokat [37-39]. Az áttekintés következő szakaszában a műholdas őssejtek epigenetikus szabályozását tárgyaljuk, különös tekintettel a kromatinállapot kromatint módosító komplexek szabályozására, valamint a műholdas őssejtek szaporodásában és fúziójában kulcsfontosságú DNS-metiláció szerepére. Javasoljuk, hogy az epigenetikai mechanizmusok összehangoltan irányítsák a felnőtt őssejt génexpressziós programokat az öregedés során, és hogy az integrált környezeti ingerek, amelyek a kromatin és a DNS metilációja révén kiváltják az őssejteket, reverzibilisek lehetnek, és így ideális helyzetben lehetnek a műholdas sejtek fiatalításának molekuláris hatásai. 'és az izomregeneráció.
CHROMATIN REMODULÁLÁSA SZATELLIT SEJTEKBEN
A műholdas sejtek aktiválásában, szaporodásában és differenciálódásában szerepet játszó transzkripciós faktorok hálózatának meghatározásakor nyilvánvalóvá vált, hogy az epigenetikus és a kromatatin gépezet különböző elemei vesznek részt. Molekuláris szinten a DNS négy hisztonfehérje (2A, 2B, 3 és 4 hiszton) magjából álló nukleoszómára van tekerve (ábra. 3 3 ) kromatin képződéséhez, amely nemcsak szerepet játszik a kromoszóma stabilitásában, hanem szabályozza a környező gének expresszióját is [40]. A hiszton által szabályozott génexpresszió mechanizmusai a hiszton farokjának transzláció utáni módosításainak tulajdoníthatók [40]. Ezek a módosítások vagy „epigenetikai jegyek” magukban foglalják a hisztonfarkban lévő aminosavmaradékok metilezését, acetilezését, szumoilezését és foszforilezését. A jelölés típusa és az aminosavmaradék a transzkripciós aktiváció vagy az elnyomás kulcsfontosságú meghatározói [40].
A nukleoszóma elrendezése. A nukleoszóma alegységekből kiemelkedő hiszton farok kémiai csoportok kapcsolódását teszi lehetővé. A metilcsoportok szorosabban kondenzálják a nukleoszómákat, megakadályozva a génátírást. Az acetilezés lazítja a nukleoszóma csomagolását, a DNS-t RNS-polimeráznak és transzkripciós faktoroknak teszi ki, amelyek aktiválják a géneket.
DNS-METILÁLÁS SZATELLIT SEJTEKBEN
A hisztonok poszttranszlációs módosítása mellett a CpG dinukleotid-metiláció az epigenetikai információk fő forrása, és a CpG-t tartalmazó promóterek metilezése elnyomja a specifikus gének expresszióját. A DNS-metiláció előnyösen a citozin C5-helyzetében történik (1. ábra). 4 4 ) a CG összefüggésében a kisebb bázisokat, az 5-metil-citozinokat képezve, amelyek az emlős genomjában körülbelül 1% -ot tesznek ki [56, 57].
- A diéta okozta hiperglikémia, hiperinsulinémia és a vázizom inzulinrezisztenciájának korrekciója
- A fizikai aktivitás és a fogyás hatása a csontvázizmok mitokondriumára és a velük való kapcsolatra
- A csontváz izomlazítóinak megfelelő alkalmazásának szempontjai az akut alacsony szint kezelésére
- Elektromos izomstimulációs áttekintés; Megpróbáltam elektromos izomstimulációs terápiát az edzés helyreállításához
- ELEKTROMOS IZMAI STIMULÁCIÓ - Marion Mizzi