A hármas ismétlődő betegségek rövid története
Absztrakt
Az ismétlődő DNS-szekvenciák instabilitása a genomban számos emberi betegséggel jár. A trinukleotidismétlések kiterjedését a neurológiai és neuromuszkuláris betegségek egyik fő okaként ismerik el, és a mutációk megértésében az elmúlt 20 évben jelentős előrelépés történt. Itt röviden összefoglaljuk az előrehaladást, különös hangsúlyt fektetve a technikai fejlődésre a különböző szakaszokban.
1. Bemutatkozás
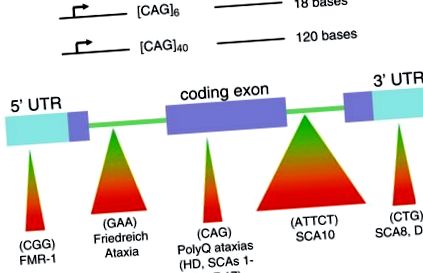
Az egyszerű ismétlődő elemek instabil és dinamikus továbbadása a DNS-ben egy új típusú mutáció, amely megváltoztatta a genetika arcát [1]. A „trinukleotidismétlés (TNR) tágulásának” nevezett mutáció akkor fordul elő, ha a mutált génben jelen lévő triplettek száma nagyobb, mint egy normál génben található szám [1–3]. Ezenkívül a betegség génjének tripléinek száma tovább növekszik, mivel a betegség génje öröklődik (1a. Ábra). A TNR szám növekedésével a növekvő hármas traktus megváltoztatja a génexpressziót és/vagy a géntermék funkcióját; A gén kódoló szekvenciájában elhelyezkedő TNR-ek általában hibás fehérjét termelnek, míg a TNR kiterjesztése egy nem kódoló gén régióban elnyomja a fehérje expresszióját, megváltoztatja annak splicingjét vagy befolyásolhatja az antiszensz szabályozás szempontjait (1b. Ábra) [1–3] . Például Huntington-kórban (HD) a nem érintett egyének nagyjából 6–29 CAG-hármasban lehetnek mindkét allélban; HD betegeknél azonban a betegség allélje 36-100 CAG tripletet tartalmazhat. Ahogy a TNR ismétlődő száma növekszik, a növekvő poliglutamin traktus egyre aberránsabb tulajdonságokkal rendelkező HD génterméket (úgynevezett huntint) termel, amely a mozgást kontrolláló agysejtek halálát okozza [1–3].
A trinukleotid ismétlődési rendellenességei, amelyeket a triplett ismétlések okoznak a kódoló és nem kódoló gén régiókban. (a) A betegség génjeinek öröklése és a szülő-gyermek átvitel az ismétlődő régiók gyors terjeszkedését okozza. (b) A gén kódoló és nem kódoló szekvenciáiban található hármas ismétlések jelentős hatással vannak az emberi egészségre, és számos súlyos neurológiai rendellenesség mögött állnak
A trinukleotid ismétlődési rendellenességek kórélettana és az ismétlés számának hatása. Az érintett agyrégiók és a neuronvesztés régiói a TNR expanzióval járó neurológiai rendellenességekben a bal oldalon láthatók. A vörös régiók jelzik a leginkább érintett területeket és az idegsejtek veszteségének területeit. HD-ben a 36–120 CAG ismétlődésű betegeket érinti a betegség, és neuronveszteséget mutatnak az agy mozgásszabályozó régióiban. Az érintett gének sematikus ábrázolása a bal oldalon látható. Az egyes gének ismétlődő régióit a gén kódoló régiójában található kis sáv jelzi. A fordított háromszög egyre több ismétlést jelent. A háromszög alapja nem érintett egyéneket ábrázol; a pontozott vonalak a betegség nem érintett hordozóit jelzik, a háromszög piros része pedig az érintett egyéneket jelöli. C/P caudate/putamen, CTX kéreg, GP globus pallidus, STN szubtalamuszos mag, VL ventrolaterális talamuszmag, SN substantia nigra
Az expanziós betegségek megértésének előrehaladása a felfedezési folyamat minden egyes lépésében új módszerek és megközelítések kidolgozására támaszkodott. A trinukleotid ismétlési protokollok első kiadásában [12] kiemelték a transzgénikus állatok előállítására szolgáló módszereket és a sejtekre vonatkozó betegségmodelleket, valamint a triplett ismétlési hosszúság számszerűsítésére szolgáló módszereket sejtekben, emberekben és állatokban. A trinukleotid ismétlődő protokollok második kiadása ezekre a témákra épít és kiterjeszti azokat a kifinomultabb TNR kimutatási módszerekre, az expanzió számszerűsítésére szolgáló új állatmodellekre és az új kísérleti megközelítésekre, amelyek mind a TNR betegség patogenezisével, mind a terápiával foglalkoznak.
2 A TNR-k korai klinikai kimutatása és történelmi perspektíva
A CAG expanziójának hatásai a hunttin génben. Egy HD család reprezentatív két generációs törzskönyve. A négyzetek hímek; körök nőstények. A piros négyzetek az érintett személyeket jelzik. A nyílt körök nem rokon házastársak. A fekete számok az érintett családtagok minden alléljében a CAG ismétlődő számát képviselik. Kis fekete betűk jelzik az apa-fiú átvitelben jelenlévő allélokat. A zárójelben lévő szám a CAG öröklés közbeni bővítésének méretét jelenti. A HD és a CAG ismétlődő szám kapcsolata (balra). A HD gén ezen sematikus ábrázolásánál a nyitott sáv a Huntington gén kódoló régióját (az úgynevezett Huntingtin-t) képviseli; a kis piros sáv jelzi a kódoló szekvencia N-terminális részében elhelyezkedő CAG ismétlődő szakasz helyzetét. A fordított háromszög egyre több CAG ismétlést jelent. A háromszög alapja a 6–26 CAG ismétléssel nem érintett egyéneket ábrázolja; a vonalak 27-35 CAG ismétléssel járó betegség nem érintett hordozóit jelzik; és a háromszög felső része 36–120 CAG ismétléssel érintett egyéneket jelez
Az ismételt szám hatása a megjelenés korára és a várakozásra. (a) A kezdet kora fordítottan korrelál az ismétlés számával. A HD betegség génjének növekvő CAG ismétlődése csökkenti a betegség tüneteinek megjelenési korát. A korai/juvenilis HD tünetek a 60 feletti ismétlődéseknél láthatók. (b) Várakozási fenotípus egy három generációs családban, amely az egymást követő generációk fokozott súlyosságát mutatja. Nagyapa (balra), a myotonia tünetei 50 éves kora óta, de nincs jelentős fogyatékosság. Anya (középső), myotonia késői tinédzserek óta. Fia (jobbra), veleszületett myotonikus dystrophia
3 betegség genetikai módosítója: szomatikus expanzió és kromatin
Az a képesség, hogy összekapcsolják a kezdeti klinikai életkort a trinukleotid traktus pontos hosszával, napvilágra hozta az expanziós betegség második kulcsjellemzőjét (4. ábra); kezdete nagyon változó [2, 19–21]. Például HD-ben az öröklődő ismétlési hossz megjósolhatja a megjelenés átlagos életkorát (4. ábra), de egy adott ismétléshosszúságú beteg kezdete akár négyszeres is lehet (kezdete 18 és 80 év között). az előre jelzett átlagtól (4. ábra). A nagyfokú változékonyság a genetikai módosítók létezésére utal, és ezeknek a tényezőknek a vadászata jelentős figyelmet keltett [25–29]. Mindazonáltal a mai napig a betegség kialakulását befolyásoló legfontosabb módosító tényező maga a CAG traktus hosszának változékonysága tűnik [30, 31].
Az elmúlt évtizedben az ismétlődő példányszám szomatikus variációit mértük a legtöbb emberi hármas betegségben [32–39], és a legtöbb egér modellben hármas betegségek esetén, ideértve az FXS-t [40, 41], DM-1 [42, 43], SCA1 [44] és HD [45–48], többek között. De vajon az ismétlés hosszának szomatikus eltérései befolyásolják-e a betegség kialakulását? Sok esetben a szomatikus tágulások nagysága összehasonlítható az öröklöttekkel. HD-ben például a patofiziológia annyira függ az öröklődő ismétlés nagyságától, hogy egyetlen CAG-ismétléssel történő növekedés 5 évvel csökkentheti az érintett beteg megjelenésének életkorát. Heterogén és kiemelkedő, akár ezernyi kiterjedés is előfordulhat a striatumban, az agy legkiszolgáltatottabb régiójában [30, 32]. Így a HD agyban a CAG ismétlődő kiterjesztéseinek egy része jóval meghaladja az öröklődést. Logikai kiterjesztéssel tehát az emberi agysejtekben a megismétlődés szomatikus növekedése várhatóan az életkor előrehaladtával súlyosabb betegségfenotípust okoz, mivel a hosszabb poliglutamintraktusok betegségfehérjei fokozatosan termelődnek. Állatokban a CAG traktus szomatikus expanziója az állatok egész élete során fokozatosan folytatódik, miközben toxikus fenotípusok alakulnak ki bennük.
Azt azonban, hogy a szomatikus expanzió befolyásolja-e a betegség kialakulását, nehéz szigorúan meghatározni az embereknél, mivel agyuk halálig nem értékelhető. Mindazonáltal a humán postmortem HD agyban a legfrissebb bizonyítékok arra utalnak, hogy a szomatikus ismétlés hossza számít [48]. A HD egyének kohorszának szomatikus instabilitása az agy kéreg régiójában fiatal és idős betegség kialakulásának fenotípusos szélsőségeit mutatta, amint azt a kisagyban mért referenciaallél hossza megjósolta [48]. A referencia-ismétlési hossz elszámolása után nagyobb ismétlési hosszúság-növekedés társul a betegség korábbi megjelenésével. Számos változót kell rendezni, mielőtt határozott következtetéseket lehet levonni. Az emberek eltérőek az étrendjükben, az életmódjukban és a stressz kezelésében. Ráadásul az öröklődő ismétlés és a szomatikus allélek hatása a betegség kialakulására nem különíthető el tisztán a halálozás utáni agyakban. Az emberi adatok azonban összhangban állnak azzal a hipotézissel, hogy a szomatikus HD CAG ismétlődő hosszának kitágulása a célszövetekben hozzájárul a HD patogén folyamathoz.
Sokkal kevésbé ismert egy második genetikai módosító, a kromatin-csomagolás hatása a triplett ismétlődő instabilitására [49]. A terjeszkedésnek a kromatinnal összefüggésben kell működnie, és egyre nagyobb az érdeklődés annak feltárása iránt, hogy a kromatin szerkezete és az epigenetikus módosítások hogyan befolyásolják a terjeszkedést [49]. Például egy transzgenikus egerekben végzett humán Ataxin-7 lokusz vizsgálata összefüggést hozott létre a CCCTC kötődési faktor (CTCF, a DNS konformációjába és a genomi imprintingbe bevont szabályozó fehérje) kötődése és az ismétlődő instabilitás szabályozása között [50]. A CCCTC szekvencia mutációja az Ataxin-7 lokuszban, egy CTCF kötőhely a kibővített ismétlődő szekvencia mellett, fokozott instabilitás [50]. Jelenleg az epigenetikus változások és a terjeszkedés közötti kapcsolatok továbbra is rejtélyesek, de a genom lokuszának, a hisztonok poszttranszlációs módosításának és a DNS metilációjának hatása a TNR terjeszkedésére kulcsfontosságú kérdés lesz.
4 A terjeszkedés genetikai mechanizmusa
A triplett ismétlődő mutáció hosszának és dinamikájának összekapcsolása áll a triplett ismétlődési rendellenességek középpontjában, és az expanzió genetikai mechanizmusai iránti érdeklődés a betegség gének felfedezésével egyidejűleg felrobbant. Az 1995 és 2005 közötti strukturális és molekuláris elemzések kulcsfontosságúak voltak annak a hipotézisnek a megerősítésében, miszerint a stabil másodlagos struktúrák a terjeszkedés köztitermékei [2, 3, 49]. A terjeszkedés gyakorisága a szerkezetet alkotó szekvenciáktól függ, és a CGG [51], CAG [52], CTG [53] és GAA [54] traktusok hosszával növekszik. A hajtűszerkezet in vivo megjelenítése a jelenlegi felbontási határértékeken nem lehetséges. A modell azonban összhangban van a legtöbb genetikai adattal, és a triplett ismétlődéseket tartalmazó struktúraképző heteroduplex hurkok refrakterek az élesztő meiózisa során történő javításra, míg más ismétlődések és véletlenszerű szekvencia hurkok eltávolításra kerülnek [55].
5 A triplett ismétlődő expanziós rendellenességek fehérje és RNS által közvetített toxicitása
6 Terápiák
A fehérjefüggő toxicitást és az oxidatív DNS károsodást csökkentő vegyületek szűrésére irányuló erőfeszítések intenzívek voltak, de még nem hoztak olyan terápiát, amely hatékonyan ellensúlyozta volna a betegség kialakulását [81–83]. Bár a kis molekulák keresése folytatódik, a hármas ismétlődő betegség új terápiás stratégiái három fronton fejlődtek: DNS, RNS és fehérje. Ha a szomatikus expanzió tényező a betegség kialakulásában és előrehaladásában, akkor a szomatikus expanzió blokkolásának előnyösnek kell lennie. Így a terjeszkedés csökkentésére irányuló terápiás megközelítések intenzív érdeklődést váltottak ki, bár a DNS-expanzió hatékony molekuláris inhibitorait még nem sikerült azonosítani. A DNS-javító fehérjék elősegítik a terjeszkedést, és gátlásuk lehetséges stratégia a triplett ismétlési hosszának szabályozására. A DNS helyreállítása azonban alapvető szerepet játszik a mutációk elkerülésében más helyeken. Így ebben az erőfeszítésben kihívás lesz olyan molekulák azonosítása, amelyek gátolják a terjeszkedést anélkül, hogy megváltoztatnák a DNS-helyreállítás normális szintjét.
A hármasok terén talán a leggyorsabban fejlődő technológiák az aberrált fehérjetermékeket vagy az RNS-t célzó terápiák, siRNS segítségével [84, 85]. a mutáns hunttin fehérje siRNS „leütése” azt jelzi, hogy a mutáns HD transzgén elnémítása jelentősen gátolja a neurodegenerációt, javítja a motoros kontrollt és meghosszabbítja a HD egerek túlélését [86, 87]. A normális gén terméke szükséges a sejtek túléléséhez és fejlődéséhez. Ezért minden siRNS-megközelítésben a fő kihívás a mutáns gén expressziójának gátlása, miközben lehetővé teszi normális megfelelőjének expresszióját. A mutáns allélszelektivitás (a neuroprotektív vad típusú allél expressziójának megőrzése), a célspecifitás, a hatékonyság és a biztonság, valamint a bejuttatási módszerek optimalizálásának jövőbeni javulásával a kicsi, nem kódoló RNS-alapú terápiás alkalmazások hatékonysága valószínűleg javulni fog [88].
Az RNS által kiváltott toxicitás elleni további stratégiák közé tartozik az antiszensz RNS alkalmazása. A CAG ismétlődő antiszensz oligonukleotidok hatékonyak a DM1 modellekben azáltal, hogy megváltoztatják a toxikus RNS fehérje kölcsönhatásait vagy anyagcseréjét [89]. A CAG ismétlődő antiszensz oligonukleotidokat úgy tervezték, hogy kötődjenek a CUG ismétlődő RNS-hez, és blokkolják a toxikus RNS – fehérje kölcsönhatásokat. A kibővített CUG-átírások felszabadulása a nukleáris gócokból feltehetően megkönnyíti a citoplazmába történő transzportjukat, ahol gyorsan lebomlanak. További előnyként a CTG ismétlések szomatikus instabilitása a DMPK génben elnyomódik az antiszensz oligonukleotidokkal végzett kezelés után [89]. Ezek az eredmények felvetik annak lehetőségét, hogy az antiszensz oligonukleotidokkal végzett korai beavatkozás csökkentheti az RNS vagy a fehérje toxicitását, és további előnye lehet a CTG stabilizálásának: A CAG szubpatogén hosszúságban ismétlődik meg.
Az indukálható pluripotens őssejtek (iPS) megjelenésével az őssejtpótló terápia ígéretes út [90, 91]. Az őssejtek magzati szövetből származnak, de képesek normális agysejtekké fejlődni, ha műtéti úton beültetik őket az agyba [92], és az őssejtek átültetésére szolgáló műtéti stratégiákat vizsgálják az agyban az elveszett idegsejtek pótlására [90–92]. . A pluripotens őssejtek (iPS) indukcióját transzkripciós faktor „koktélok” hozzáadásával tesztelik az emberi szomatikus sejtek közvetlen átprogramozására a helyettesítő terápia céljából [93, 94]. Így az iPS sejtek reményt adnak arra, hogy a haldokló idegsejtek megújuló sejtekkel való helyettesítése miatt a patofiziológia súlyossága csökkenhet, vagy késleltethető annak kezdete. Ezek az eljárások kísérleti jellegűek, és még nem világos, hogy hatékonyak-e. Az embrionális oltványok azonban mind az állatokban, mind az emberekben javították a motoros funkciókat [90, 93–95].
7 Következtetések
A trinukleotidismétlés (TNR) terjeszkedésének kórokozó mechanizmusainak megértése az elmúlt években jelentősen előrehaladt. Noha a toxicitás és a mutációs mechanizmusok számos aspektusa rejtélyes marad, a DNS, az RNS és a fehérje új modelljei egyre nagyobb képességet biztosítanak a halálos betegségek csökkenésének gátlására. Bár még nincs hatékony terápia a sarkon, a beavatkozás reménye a láthatáron van.
Köszönetnyilvánítás
Szeretnék köszönetet mondani Christie A. Canaria, Virginia Platt (NIH/NIA T32-AG00266), Do Yup Lee, Nelson Chan, Ella Xun, James Lim, valamint az NS069177, NS40738, NS062384 és az Egészségügyi Nemzeti Intézmények támogatásának. NS060115.
- Az emberi vércsoportok rövid története
- Hadsereg diétás asztala; Asztal; Penn földje és rengeteg történelmet hoz az asztalra
- ABC a máj, a hasnyálmirigy és az epeúti rendszer betegségei Gallstone-betegség
- Hólyagos betegségek
- 6 dolog, amit nem tudhat a Butch Cassidy TÖRTÉNETÉRŐL