Hepatitis C esetén hatékony funkcionális élelmiszerek: Az oligomer proantocianidin és annak hatásmechanizmusának azonosítása
Levelezés: Hiroaki Kataoka, Ph.D., egyetemi tanár, Miyazaki Egyetem, Orvostudományi Kar, Patológiai Tanszék, Onkopatológiai és Regeneratív Biológiai Szakosztály, 5200 Kihara, Kiyotake, Miyazaki 889-1692, Japán. pj.ca.u-ikazayim.dem@anijem
Telefon: + 81-985-852809 Fax: + 81-985-856003
Absztrakt
Alap tipp: A hepatitis C vírus (HCV) által okozott fertőzés krónikus hepatitist, májcirrhosist és hepatocelluláris carcinomát okoz. Míg a pegilezett α-interferon és a ribavirin kombinációját használják a HCV eliminálására, új HCV-ellenes gyógyszerre van szükség a kombinált terápia gyenge hatékonysága és súlyos mellékhatásai miatt. Új anti-HCV szereket kerestünk természetes termékekből, majd áfonyalevelekből azonosítottuk az oligomer proantocianidint. További vizsgálatok arra utalnak, hogy számos heterogén nukleáris ribonukleoprotein lehet a jelölt fehérje, amely részt vesz a HCV szubgenomikus expressziójának proantocianidin által közvetített gátlásában. Az áfonyalevelekből izolált oligomer proantocianidin potenciálisan hasznos lehet anti-HCV vegyületként.
BEVEZETÉS
A hepatitis C vírus (HCV) a vírusos hepatitis egyik fő oka, és jelenleg világszerte körülbelül 170 millió embert fertőz meg [1,2]. A HCV által okozott fertőzés magas krónikus májgyulladást okoz (> 75%), és végül májcirrhosissá és hepatocelluláris karcinómává fejlődik [3]. A májcirrhosisban és hepatocelluláris carcinomában világszerte kialakuló egyének 27% -a, illetve hepatocelluláris carcinoma 25% -a HCV-fertőzöttekben fordul elő [4]. Az Egészségügyi Világszervezet jelentése szerint évente 350000 és 500000 ember hal meg HCV-vel kapcsolatos betegségekben. A HCV-fertőzés ellen azonban jelenleg nincs hatékony vakcina.
Jelenleg a pegilezett α-interferon és egy széles spektrumú vírusellenes gyógyszer, a ribavirin kombinációját alkalmazzák a krónikus HCV fertőzés standard terápiájaként [2,5,6]. Ennek lehetőségét azonban sajnos korlátozza a hatékonyság, az elviselhetőség és a jelentős mellékhatások. Ezért egy új terápiás mód létrehozására volt szükség súlyos káros hatások nélkül. A közelmúltban klinikailag megvizsgálták a HCV-specifikus fehérjéket gátló közvetlen hatású vírusellenes szereket (DAA) [7,8]. Például a boceprevir és a telaprevir olyan új DAA, amelyet az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala (FDA) hagyott jóvá először 2011-ben [9]. A DAA-k várhatóan új ígéretes kezelési lehetőségeket kínálnak a hepatitis C betegeknél; azonban jelenleg a magas költségek miatt nehézségekkel szembesülnek az egész világon történő terjesztés terén. Ezért továbbra is szükség van olyan új anti-HCV szerekre, amelyek biztonságosak, gazdaságosak és kiegészítik a jelenlegi terápiákat.
Ebben az áttekintésben áttekintettük a HCV-fertőzés szempontjából hatékony funkcionális ételeket és összetevőket, az oligomer proantocianidin kémiai szerkezeti jellemzőit és annak hatásmechanizmusát.
HCV LIFE CIKLUS ÉS ELEMZÉSI ESZKÖZ
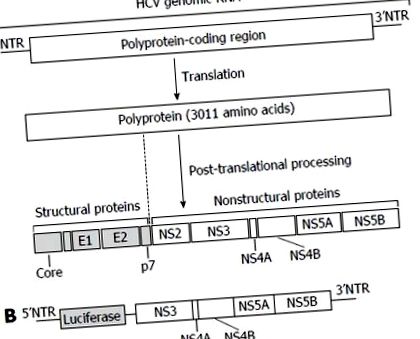
A hepatitis C vírus genomjának és sejtrendszerének felépítése az anti-hepatitis C vírus gyógyszer felfedezéséhez. V: HCV genomi RNS és vírusfehérjék. A HCV genomi RNS egyetlen 3011 aminosavból álló poliproteint kódol. Lefordítása után a poliproteint 4 szerkezeti fehérjévé (Core, E1, E2 és p7) és 6 nem strukturális (NS) fehérjévé (NS2, NS3, NS4A, NS4B, NS5A és NS5B) alakítják. A poliproteint kódoló régiót 5 ’és 3’NTR határolják. A vírusos RNS templátként is szolgál a vírusgenom replikációjához, és mindkét NTR modulálja a vírusfehérje szintézist és a genomreplikációt; B: A HCV replikon sejtrendszer. A Huh-7 sejteket HCV szubgenomikus RNS-hez kapcsolt luciferáz génnel transzfektáltuk, beleértve az NS3 downstream kódoló régióit is. A HCV szubgenomikus RNS expressziója luciferáz aktivitással számszerűsíthető. HCV: Hepatitis C vírus; NTR-ek: Nem lefordított régiók.
A krónikus HCV-fertőzés terápiás lehetőségei
Jelenleg a pegilezett α-interferon és egy széles spektrumú vírusellenes gyógyszer, a ribavirin kombinációját alkalmazzák a krónikus HCV fertőzés standard terápiájaként [2,5,6]. A HCV genotípus azonban fontos meghatározó hatékonyságának és tolerálhatóságának. Míg a virológiai válasz erre a kombinációs terápiára több mint 70% a 2. és 3. genotípus esetében, addig az 1. genotípus esetében kevesebb, mint 50% [18-20]. Ez a terápia továbbá jelentős mellékhatásokat okoz, mint például trombocitopéniát, influenzaszerű tüneteket, lázat, kiütéseket, étvágytalanságot és pajzsmirigy-diszfunkciókat. A terápia során neuropszichológiai rendellenességként kifejezett depresszió és ingerlékenység univerzálisan rontja az életminőséget. Ezért egy új terápiás mód létrehozására volt szükség súlyos káros hatások nélkül.
A közelmúltban klinikailag megvizsgálták a HCV-specifikus fehérjéket gátló DAA-kat [7,8]. Két DAA, a boceprevir és a telaprevir kerültek először a HCV gyógyszerpiacra, és az FDA 2011 májusában jóváhagyta őket. A Boceprevirt vagy a telaprevirt háromféle kezelésként pegilált α-interferonnal és ribavirinnel alkalmazták az 1 genotípusú hepatitis C betegeknél [9]. Ezek a DAA-k a HCV NS3/4A szerin proteáz elleni inhibitorok, és kovalensen kötődnek az enzim [21-23] enzimének aktív helyéhez. A boceprevirt vagy telaprevirt alkalmazó hármas terápia szignifikánsan növelte a tartós virológiai válasz (SVR) gyakoriságát naiv vagy korábban kezelt hepatitis C-ben szenvedő, 1-es HCV genotípusú betegeknél [24-29]. Ezt követően a következő generációs DAA-k, az ABT-450/r, a szimeprevir és a faldaprevir, amelyek szintén NS3/4A proteázinhibitorok, előnyei a kényelem és a jobb mellékhatások profilja [30-32]. Továbbá a daclatasvir és a sofosbuvir, amelyek NS5A replikációs komplex inhibitorok, illetve NS5B nukleotid analóg polimeráz inhibitorok, szintén növelik az SVR arányt [33-35]. Nevezetesen, ezeknek a DAA-knak a kombinációja volt csak az 1-es genotípusú HCV-ben szenvedő betegek rendkívül hatékony kezelése [36,37], és megvalósítható a HCV kezelése interferon és ribavirin nélkül.
Míg a hepatitis C-ben szenvedő betegeket a fent említett DAA-k kezelhetik jelentős mellékhatások nélkül, ez magas orvosi költségeket igényel, és korlátozza a terápiához való hozzáférést a költségérzékeny országokban [38]. A magas HCV gyakorisággal rendelkező 20 ország közül 12 az alacsony vagy közepes jövedelmű országok kategóriájába tartozik [39]. Ezért továbbra is szükség van új, biztonságos, gazdaságos és a jelenlegi terápiákkal kiegészített anti-HCV szerekre, és a funkcionális ételekre és azok összetevőire összpontosítunk.
FUNKCIÓS ÉLELMISZER-ÖSSZETEVŐK, HATÉKONYAK A HCV-re
A HCV-vel összefüggő májcirrhosis és hepatocellularis carcinoma kialakulása hosszabb időszakot (20-30 év) igényel. Ezért a betegség progresszióját és a HCV fertőzőképességét befolyásolhatja a tejtermékeket is tartalmazó étrend. A funkcionális ételek és azok összetevői köztudottan képesek a különböző biológiai folyamatok, például az apoptózis modulálására, és természeti erőforrásokként vonzzák az érdeklődést a rák megelőzésére és kezelésére [10,11,40]. A különféle gyümölcsökből és zöldségekből származó étrendi polifenolok hatásosak a rák megelőzésében. Bár a funkcionális élelmiszer-összetevők mint DAA jelentősége a HCV ellen nem teljesen ismert, ezek az eredmények arra utalnak, hogy hozzájárulnak a vírus eliminációjához.
A funkcionális élelmiszer-összetevők kémiai szerkezete anti-hepatitis C vírus aktivitással. V: Epigallocatechin-3-gallát; B: Kurkumin; C: Quercetin; D: Punicalagin; E: Naringenin; F: Diosgenin; G: (-) - epikatechin.
Klinikailag arról számoltak be, hogy a vitamincsoport kiegészítése növeli az SVR arányt azokban a krónikus hepatitis C-ben szenvedő betegeknél, akik standard pegilált α-interferonnal és ribavirinnel kezelték [52-54]. Ami a szokásos terápia jelentős mellékhatásait illeti, a természetes antioxidánsokban gazdag paradicsomalapú funkcionális étel enyhítette a ribavirin okozta vérszegénység súlyosságát és javította a gyógyszer toleranciáját [55].
A BLUEBERRY LEVELEKBŐL SZÁRMAZÓ OLIGOMER PROANTHOCYANIDIN VESZÉLYESEN TELJESÍTETT TEVÉKENYSÉGGEL A HCV SZUBGENÓMA REKLIKÁCIÓJA ELLEN
A hepatitis C esetén hatékony funkcionális élelmiszer-összetevők azonosításához átfogóan átvilágítottuk a Japánban Mijazaki prefektúrában termesztett, gyakran elfogyasztott mezőgazdasági termékek kivonatait (1700 minta 283 fajból), HCV replikon sejtrendszer segítségével [13]. A magas antioxidatív aktivitású mintákat először ehető vagy nem ehető részektől függetlenül választottuk ki, majd a rendszer segítségével megvizsgáltuk a HCV szubgenomikus RNS replikációja elleni gátló aktivitást. Megállapítottuk, hogy az áfonyalevelek kivonatai jelentősen elnyomják a replikációt. Továbbá, összehasonlítva a gátló aktivitásokat különféle áfonya fajok leveleivel, kiderült, hogy a nyúl-szem áfonya (Vaccinium virgatum Aiton) leveleinek volt a legnagyobb aktivitása [13]. A nyúlszemű áfonyát egy meleg éghajlatú régióban termesztik, például Japán déli területein, beleértve Miyazaki prefektúrát is. Leveleiről azt is beszámolták, hogy jó polifenolok és természetes antioxidánsok [56].
Az oligomer proantocianidint azonosítottuk az áfonyalevélből származó HCV szubgenomikus RNS replikáció gátlójaként [13]. A proantocianidin egy polifenol, és olyan polimerizált struktúrákkal rendelkezik, amelyekben kettőnél több flavan-3-ol-egység, például katechin (3A ábra (3A ábra) és epikatechin (2G ábra) 2G) kovalensen kapcsolódik. A 3B. 3B. Ábra a proantocianidin kémiai szerkezetének példáját mutatja be. A proantocianidin két interflavan kötéssel rendelkezik, amelyekben az A-típusú és a B-típusú két kötés-kötéssel (C4 → C8 és O7 → C2) és egy kötéssel (C4 → C8 vagy C4 → C6) rendelkezik, illetve mindkét típusú együtt léteznek a nyúl-szem áfonya növényből származó proantocianidinben [13]. Míg a katechin, az epikatechin, az EGCG és a dimerek, mint például a procyanidin B2, kísérleti rendszerünkben nem mutattak gátló aktivitást a HCV szubgenomikus expressziója ellen, a 8–9 polimerizációs fokú proantocianidin oligomer jelentősen gátolta ezt az expressziót [13]. Ez a megállapítás arra utalt, hogy az oligomer proantocianidin HCV-gátló aktivitása a replikon vizsgálatban oligomerizált struktúrát igényelhet.
Flavan-3-ol és proantocianidin kémiai szerkezete. A: (+) - katechin; B: Példa egy (-) - epikatechin alapú szerkezettel rendelkező procyanidin B típusú polimerre.
Beszámoltak arról, hogy a proantocianidin vírusellenes aktivitással rendelkezik más vírusokkal, a herpes simplex vírussal és az 1. típusú humán immunhiányos vírussal szemben is [61-65]. Legjobb tudásunk szerint először arról számoltunk be, hogy a proantocianidin oligomer gátolta a HCV szubgenomikus RNS expresszióját [13]. Az oligomer proantocianidin hatása a hepatocyták HCV-replikációjára in vivo azonban jelenleg ismeretlen.
OLIGOMER PROANTHOCYANIDIN MŰKÖDÉSI MECHANIZMUSA HCV REPLICON SEJTEKBEN
A HCV szubgenomiális RNS-replikációjának oligomer proantocianidin általi visszaszorítása egyre nagyobb figyelmet keltett. A polifenolos vegyületek általában magas antioxidáns aktivitással rendelkeznek [10,11,58]. Ezért a polifenolok nemspecifikus antioxidáns aktivitása hozzájárulhat a HCV szubgenomikus RNS-replikációjának oligomer proantocianidin általi szuppressziójához. Azonban megvizsgáltunk más polifenolos vegyületeket a HCV replikon vizsgálatunkban, és megállapítottuk, hogy az olyan alkotmányos egységek, mint a katechin és az epikatechin, nem mutatnak elnyomó aktivitást, ami a proantocianidin oligomerizált szerkezetét igényli [13]. Noha jelenleg nem ismert, hogy a proantocianidin-oligomer a szerkezet ellenére áttelepülhet-e a sejtekben, az összetevőről beszámoltak arról, hogy az emésztőrendszerből felszívódik [66,67], ami sejtekbe történő internalizálást jelent. Úgy tűnik, hogy az oligomer proantocianidin bizonyos intracelluláris molekulákkal való specifikus asszociáció révén elnyomja a HCV szubgenomikus RNS replikációját.
A proteomikus megközelítés kétdimenziós differenciál gélelektroforézissel és tömegspektrometriával kombinálva hatékony eszközt nyújt a funkcionális élelmiszerekre adott sejtes válasz meghatározására [40]. Az oligomer proantocianidin hatásmechanizmusának tisztázása érdekében a HCV replikon sejtekben affinitáskromatográfiával tisztított proantocianidin-kötő fehérjék proteomikai elemzését végeztük [13]. Ezután tömegspektrometriás analízissel azonosítottuk a proantocianidinnal szemben nagyobb affinitású replikon sejtek sejtfehérjéit, mint a katechin, és siRNS-alapú replikon vizsgálattal tovább vizsgáltuk, hogy az azonosított fehérjék kapcsolódnak-e a HCV RNS expressziójához (4. ábra 4). Négy heterogén nukleáris ribonukleoproteint (hnRNP), a hnRNP A/B, A2/B1, K és L-t javasoltak az oligomer proantocianidin sejtmegkötő fehérjéinek. Míg a hnRNP A/B, K és L célzó siRNS gyenge gátló aktivitást mutatott, a hnRNP A2/B1 leütése jelentősen elnyomta a HCV szubgenomiális replikációját [13].
A hepatitis C vírus szubgenomikus expressziójának proantocianidin által közvetített gátlásában részt vevő jelölt fehérjék azonosítási stratégiája [13]. Az összes fehérjét kivontuk a hepatitis C vírus (HCV) replikon sejtjeiből, majd a proantocianidin-kötő és a katechin-kötő fehérjéket affinitáskromatográfiával tisztítottuk, szepharóz gyöngyökkel, proantocianidinnal, illetve katechinnel párosítva. A tisztított fehérjéket kétdimenziós elektroforézissel választottuk el, majd a proantocianidinnel nagyobb affinitású fehérjék foltjainak kimutatását, mint a katechint (nyilak). A tömegspektrometriás elemzés és az siRNS-alapú replikon vizsgálattal végzett további szűrés azt mutatta, hogy a hnRNP A2/B1, A/B, K és L jelölt fehérje, amely részt vesz a HCV szubgenomikus expressziójának oligomer proantocianidin által közvetített gátlásában. hnRNP: Heterogén nukleáris ribonukleoprotein.
A HnRNP-k egy RNS-kötő fehérje családot tartalmaznak, amelyek különböző RNS-sel kapcsolatos biológiai folyamatokban vesznek részt [68]. Ezek multifunkcionális fehérjék, amelyek fő és kisebb hnRNP fehérjékből állnak, és a hnRNP A/B, A2/B1, K és L, amelyeket azonosítottunk, a fő hnRNP-hez tartoztak [69]. Korábbi vizsgálatok kimutatták, hogy ezek a hnRNP-k szabályozzák az RNS metabolizmusát, például az pre-mRNS splicingjét és a transzkripciót [70-76]. Például a hnRNP A2/B1 kimutatták, hogy befolyásolja számos tumorszuppresszor és onkogén alternatív splicingjét a glioblastoma sejtekben [72]. Ezenkívül számos tanulmány beszámolt ezekről a hnRNP-k közötti kölcsönhatásról és együttműködésről [77-79]. A hnRNP A2 és a hnRNP L komplexként is létezik, és az mRNS 3’NTR-hez kötődve szabályozza a glükóz transzporter-1 expresszióját [80,81].
A HCV életciklusában a hnRNP-k a HCV genom RNS-hez kapcsolódnak, és szabályozzák annak replikációját. A hnRNP A1, amely nagy homológiát mutat a hnRNP A2/B1-gyel, kimutatták, hogy megkönnyíti a HCV replikációját a HCV 5 'és 3'NTR-hez való kötődés révén (1. ábra, 1. ábra), és a replikációt a kettős kopogtatás jelentősen elnyomta. hnRNP A1 és hnRNP A2 [82]. A hnRNP K és a hnRNP L szintén NTR-kötő fehérje [83-85]. Ezenkívül az összes hnRNP-t, amelyet oligomer proantocianidin célfehérje jelöltjeként azonosítottunk, beépítettük a HCV 3’NTR-kötő fehérjékbe [86]. Ezek a megállapítások együttesen azt sugallják, hogy a hnRNP A2/B1, A/B, K és L komplex komplex szolgálhat a HCV genom replikációjában az NTR-hez való kötődés révén, az oligomer proantocianidin pedig a replikációs komplex gátlója. Ezt a lehetőséget egy további tanulmányban kell megvizsgálni.
KÖVETKEZTETÉS
Jelenleg a pegilezett rekombináns interferonok és a ribavirin kombinációját alkalmazzák standard kezelésként a hepatitis C betegeknél. A nemrégiben megjelent DAA-k várhatóan új ígéretes kezelési lehetőségeket kínálnak a hepatitis C-ben szenvedő betegeknél. Magas orvosi költségeik azonban megnehezítik a terjesztést világszerte. Kimutattuk, hogy az áfonyalevelek kivonatai in vitro elnyomják a HCV szubgenom replikációt, és hatóanyaguk oligomer proantocianidin volt [13]. Az alapul szolgáló cselekvési mechanizmus vizsgálata azt sugallta, hogy a proantocianidin számos hnRNP gátlója lehet, mint például a hnRNP A2/B1 [13]. Másrészt jelenleg ismeretlen, hogy a proantocianidin oligomer formája, amely a HCV replikációjának gátlásához szükséges, hatékonyan felszívódhat-e az emésztőrendszerből az in vivo hatékony plazmakoncentráció fenntartása érdekében. Az oligomer proantocianidin HCV replikáció elleni hatásmechanizmusának további alapkutatása azonban új módszereket kínálhat új anti-HCV gyógyszerek és kiegészítők kifejlesztésére a hepatitis C betegek számára világszerte.
KÖSZÖNETNYILVÁNÍTÁS
Ezt a munkát Fumiaki Mieno úrnak (elhunyt, 2013. március 19.) szenteltük, aki inspirálta munkánkat a szellemi tulajdon védelme és kiaknázása terén. Köszönjük Sachiko Tomiyamának, Tokoyo Imai-nak, Toshiro Morishitának és Makoto Kodamának (Miyazaki Prefectural Industrial Support Foundation) a tanulmányunk koordinálásáért.
Lábjegyzetek
Támogatja: A japán tudományos és technológiai ügynökség együttműködése a regionális szervezetekkel a technológiai kiválóság előmozdítása érdekében
P- Lektor: Ampuero J, Chuang WL, Conti B, Hernanda PY, Tijera MFH, Qin JM S- Szerkesztő: Tian YL L- Szerkesztő: A E- Szerkesztő: Liu SQ
- Ételek, amelyek támogatják a máj méregtelenítését; Danner Bridgit, funkcionális egészségügyi edző; Méregtelenítő szakértő
- Funkcionális készítmények - Szerves etetőcsövek és teljes ételek étkezés pótlása
- Funkcionális élelmiszerek termékfejlesztése, technológiai trendek, hatékonyságvizsgálat és éves biztonság
- Diétás napló Funkcionális ételek és japán FOSHU - Élelmiszerek a meghatározott egészségért Életmóddal kapcsolatos hírek, The
- A gyakori gyomorégés kiváltja a zsíros ételeket, az alkoholt, a citrusokat és egyebeket