A japán és indiai bélmikrobiota összehasonlítása étrendfüggő kölcsönhatást mutat a baktériumok és gombák között
Tárgyak
Absztrakt
Bevezetés
Ebben a tanulmányban japán és indiai székletminták baktérium- és gombakompozícióját elemeztük. Az étrendi élőhely kérdőív és domináns mikroorganizmusaik alapján az arabinoxilán metabolizmusára összpontosítottunk, amely az egyik fő emészthetetlen poliszacharid. Ezután elemeztük a bélbaktérium és a gomba közötti kölcsönhatás lehetséges mechanizmusát in vitro és in vivo. Az eredmények azt javasolták, hogy a gombák és a baktériumok étrendi metabolitfüggő kölcsönhatásban részesülnek, ami elősegíti a baktériumok növekedését és kolonizációját a bélben.
Eredmények
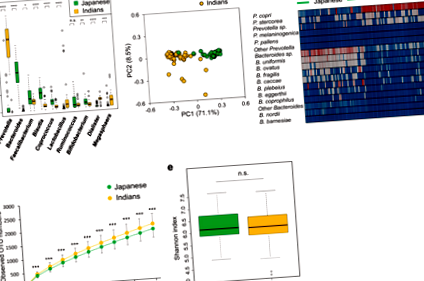
A baktériumok és gombák összetételének elemzése japán és indiai székletben
A Prevotella és a Candida növekedése több növényi poliszacharidon
Candida-függő étrendi metabolitok, amelyek támogatják a Prevotella növekedését
Ezt követően elemeztük a Candida és Prevotella, mindkettő uralta az indiai alanyok belét, és növekedési reakciót mutatott az AX-re. Tekintettel az AX hatékony használatára Candida felett Prevotella, elemeztük, hogy Candida támogatja Prevotella növekedés AX-ben gazdag környezetben (4a. ábra). A tenyészet felülúszóinak hozzáadása C. albicans vagy C. tropicalis AX jelenlétében növesztve gyors növekedést váltott ki P. copri önmagában AX jelenlétében történő növekedéséhez képest. Hasonlóképpen, Candida indiai székletből izolált törzsek elősegítik P. copri növekedés (4b. ábra). Ezek az eredmények arra utalnak, hogy a gombás felülúszók olyan anyagcsere-termékekben gazdagodtak, amelyek lehetővé tették a gomba gyors növekedését P. copri.
a A standardok (felső: xilulóz, xilóz, xilobióz, xilotrióz és arabinóz) HPLC-kromatogramjai és a C. albicans tenyészet felülúszó (alsó). b A TLC elemzése C. albicans kultúra felülúszó. 1. sáv: arabinóz (A); 2. sáv: xilóz (X1), xilobióz (X2), xilotrióz (X3), xilotetraóz (X4), xilopentaóz (X5) és xilohexaóz (X6); 3. sáv: élesztő nitrogén alapú közeg AX-szel; 4. sáv: a C. albicans AX jelenlétében termesztik. c A TLC-analízissel detektált folt közvetlen tömegspektrometriás elemzése (4. sáv). A negatív kontroll tömegspektruma (-) és a TLC lemezek mintafoltja C. albicans kultúra felülúszó. Egyedülálló ioncsúcsot figyeltünk meg a m/z 277 a C. albicans felülúszó minta. d A prekurzor ion MS/MS spektruma a m/z 277 a C. albicans felülúszó minta (felső), valamint arabinóz (középső) és xilóz (alsó). Az MS/MS fragmens mintázata C. albicans a felülúszó minta megegyezett a xilóz és az arabinóz mintáival. e A D-xilóz és az l-arabinóz koncentrációja AX (-) és Candida tenyészet felülúszó AX-gyel. C.T., C. tropicalis; C.A, C. albicans. Az adatokat három független kísérlet átlagaként ± SD-ként mutatjuk be. n.d. nem található.
A Prevotella gyarmatosításának elősegítése Candida által csíra nélküli egerekben
a Gomba- és baktériumadagolás sematikus diagramja az egér belében: csíra mentes BALB/c egereket C. albicans (n = 4), P. copri (n = 5) vagy C. albicans + P. copri (n = 5). C. albicans orálisan adtuk be a 0. napon, és P. copri szájon át a 3–9. napon adták be. b – d Másolja a C. albicans (b, d) és P. copri (c, d) egy gramm székletre a megjelölt időpontokban (napokban) mono- és együttesen alkalmazott csoportokban. Azon egerek számát, amelyekben a mikroorganizmusok kópiaszáma meghaladta a kimutatási határt, a grafikon mutatja. Az adatok két független kísérletet reprezentálnak, és átlag ± SD értékként vannak feltüntetve. Az átlagértékeket a kimutatási határértéket meghaladó példányszámok alapján számítják ki. e HAL felhasználásával Candida-specifikus szonda Dual 1249 (zöld), Prevotella-specifikus próba PRV392 (piros) és 4 ', 6-diamidino-2-fenilindol (DAPI; kék) Carnoy rögzített vastagbélszelvényein, amelyeket az egerekből 26 nappal a kezdeti kolonizáció után gyűjtöttünk be. Méretjelző oszlopok, 10 µm.
Vita
Vizsgálatunk elemezte a japán és indiai felnőttek bélbakteriális és gombás összetételét, és bizonyítékot szolgáltatott egy interkingdom kölcsönhatásra, amelyet potenciálisan a gazda diéta különbségei közvetíthetnek. A japán populációk, magas állati eredetű termékek bevitele mellett, rengeteg Bacteroides az indiánokhoz képest, amelyek növényi étrendet fogyasztanak, magasabb szintet mutatva Prevotella. Ezek a megfigyelések párhuzamosak a komplex szénhidrátokban dúsított étrenddel rendelkező emberi populációk korábbi eredményeivel, mint például a tanzániai Hadza vadászó-gyűjtögető 33 és az afrikai vidéki gyermekek 6, akik nagyobb mennyiségű Prevotella magasabb populációval rendelkező nyugati étrendet fogyasztó populációkhoz képest Bacteroides. Azokkal a tanulmányokkal összhangban, Prevotella magas szénhidrát-/élelmi rostbevitelű egyéneknél bőségesen kimutatták. 23
Az in vitro megfigyelésekhez hasonlóan ezt az interkingdomin interakciót is összefoglaltuk a GF egérrendszerben, ahol megfigyeltük, hogy fokozódott P. copri számok jelenlétében Candida. Tekintettel azonban a rendkívül dinamikus és összetett bélrendszert szabályozó tényezők sokaságára, más mechanizmusok is aktívak lehetnek az interakció elősegítésére. Például néhány bélbaktérium, mint pl Bacteroides, ismert, hogy erjesztik az élesztő sejtfal poliszacharidjait, például a mannan 40-et és a β-glükánokat. 44 Így az is lehetséges, hogy az étrendből származó források mellett Prevotella előnyére válhat Candida más alternatív mechanizmusok által. Jelen tanulmányunkban az interkingdom kölcsönhatásának validálására összpontosítottunk, és potenciális jelöltként javasoltuk az arabinózt. További kísérletekre lesz azonban szükség a fő kedvezményezett modul szerepének megállapításához, amely megkönnyíti a baktériumok szaporodását. Például a megfelelő mikrobákkal kolonizált GF egerek összehasonlításával végzett jövőbeni vizsgálatok AX és AX mentes étrendben gazdag testreszabott étrend alkalmazásával tisztább képet adhatnak az AX/arabinóz alapú kereszttáplálási mechanizmus hatásáról a Prevotella a belekben.
Maga az AX összetett kémiai szerkezettel rendelkezik, amely lineáris d-xilóz gerincből áll. Különböző szemcsefajokban a gerinc xilóz helyettesíthető arabinózzal és térhálósítható ferulinsavval. Az energia megszerzéséhez a mikrobáknak depolimerizálniuk kell a poliszacharidokat a kémiai kötések enzimatikus hasításával. A bélbaktériumok több ezer szubsztrát-specifikus szénhidrát-aktív enzimet (CAZymes) termelnek, amelyek katalizálják az egyedi kapcsolatok lebontását, és amelyeket széleskörűen katalogizáltak. Így az egyik jövőbeni irány a CAZymes azonosítása lenne Candida spp. és Prevotella az AX hasznosítására.
Anyagok és metódusok
Széklet gyűjtése és feldolgozása
Székletmintákat gyűjtöttünk 47 egészséges japán felnőtttől, akik Osaka területén éltek (25 férfi és 22 nő, átlagéletkoruk 30,6 ± 6,1 év), valamint 50 egészséges indiánból, akik Delhi térségében éltek (27 férfi és 23 nő, átlagéletkoruk 28,8 ± 6,2 év) ). Egy kanál székletet (0,5 g) 2 ml RNS-t tartalmazó csőbe gyűjtöttünka későbbiekben (Ambion) nukleinsav extrakcióhoz. A székletürítés után azonnal gyűjtötték a gyűjteményeket. A nukleinsav-extrakcióhoz tartozó minden székletmintát lemértünk és kilenc térfogat RNS-ben szuszpendáltunka későbbiekben széklet homogenátum előállításához (100 mg széklet/ml). A Helsinki Nyilatkozattal összhangban valamennyi vizsgálati alany megfelelő tájékoztatást kapott a vizsgálatról. Az összes résztvevőtől tájékozott írásbeli beleegyezést gyűjtöttek. Az Oszakai Egyetem etikai bizottságai és a Translational Health Science and Technology Institute (Faridabad) jóváhagyták ezt a tanulmányt. A protokollszámok: 12237, illetve SAS/THSTI/001/2013-2014. A mintákat Japán és India között szállítottuk a Nagoya-protokollnak megfelelően.
DNS kivonása bakteriális analízishez
A DNS kivonásához 1 ml foszfáttal pufferolt sóoldatot (PBS) adtunk 200 μl széklet homogenizátumhoz. A széklet homogenizátumot 13 000x-nél centrifugáltuk g 10 percig, és 1 ml felülúszót eldobtunk. Újabb 1 ml PBS-sel végzett mosás után a pelleteket -30 ° C-on tároltuk, amíg a DNS-extrakcióig felhasználtuk. Üveggyöngyöket (0,3 g; átmérő, 0,1 mm) (BioSpec Products), 300 μl Tris-SDS oldatot és 500 μl Tris-EDTA (TE) -telített fenolt adtunk 200 μl széklet homogenizátumhoz, és az elegyet erőteljesen vortexeltük. 30 másodpercig FastPrep-24 (MP Biomedicals) segítségével 5,0 teljesítményszint mellett 30 másodpercig. 20 000x-es centrifugálás után g 5 percen át, 4 ° C-on, 400 μl felülúszót gyűjtöttünk, és azonos térfogatú fenol-kloroform-izoamil-alkoholt (25: 24: 1) adtunk a felülúszóhoz. 20 000x-es centrifugálás után g 5 percig 4 ° C-on 250 μl felülúszót gyűjtöttünk és izopropanolos kicsapásnak vetettük alá. Végül a DNS-t 200 μl TE pufferban szuszpendáltuk és -30 ° C-on tároltuk.
A baktériumok összetételének meghatározása MiSeq amplikon szekvenálással
Mindegyik DNS-könyvtárat az „Illumina 16S Metagenomic Sequencing Library Preparation Guide” előkészítése szerint készítettük, a 27Fmod primerkészlettel: 5ʹAGRGTTTGATCMTGGCTCAG-3ʹ és 338R: 5ʹ-TGCTGCCTCCCGTAGGAGT-3ʹ, amely a 16S rRNS gének V1 – V2 régióját célozta meg; Az amplikonok 251 bp páros végsorrendezését MiSeq rendszeren (Illumina) végeztük MiSeq Reagent v2 500 ciklus készlet alkalmazásával. A kapott párosított végszekvenciákat a PEAR segítségével egyesítettük (http://sco.h-its.org/exelixis/web/software/pear/). Ezt követően mintánként 30 000 olvasmányt vettek véletlenszerűen mintába a minta minimális olvasatának megfelelően a seqtk (https://github.com/lh3/seqtk) segítségével a taxonómiai hozzárendeléshez. Ezeket a mintavételezett szekvenciákat azután az UCLUST 1.2.22q verziójával 97% -os hasonlósági határon definiált OTU-kba csoportosítottuk. Az egyes OTU-k reprezentatív szekvenciáit rendszertanilag osztályoztuk az RDP Classifier 2.2 50 verziójával, a Greengenes adatbázissal (gg_13_8). A Mann – Whitney U tesztet végeztünk statisztikai elemzésekhez R 3.2.2 alkalmazásával. Bár a ritkasággörbék a minta korlátozott olvasása miatt nem érték el a telítettséget (1d. Ábra), megfigyelhettük azt a tendenciát, hogy az indiánokban megfigyelt OTU-számok az összes pontnál magasabbak voltak a japánoknál.
DNS kivonása gombanalízishez
Ötszáz mikroliter ürülékhomogenátot (50 mg széklet) kétszer mossunk 1 ml PBS-sel, és a gomba DNS-t extraháljuk a PowerSoil DNS izoláló készlet (MO BIO Laboratories) felhasználásával a gyártó protokollja szerint. A gomba DNS-t felhasználásig -20 ° C-on tároltuk. A polimeráz láncreakciót (PCR) az ITS1-F (5′-CTTGGTCATTTAGAGGAAGTAA-3 ’) és az ITS2 (5′-GCTGCGTTCTTCATCGATGC-3’) primerekkel hajtottuk végre, amelyek specifikusak a gombás ITS1 régióra. Minden reakcióelegy (50 μl) 1 × PCR pufferből, minden egyes dezoxinukleozid-trifoszfátból 200 μM-ban, minden primerből 0,4 μM-ban, 2,5 egység rTaq-ból (Takara) és 1 μl gomba DNS-ből állt templátként. Az amplifikációs program egy ciklusból állt 95 ° C-on 2 percig, 40 ciklusból 95 ° C-on 20 másodpercig, 56 ° C-on 30 másodpercig és 72 ° C-tól 30 másodpercig, majd egy ciklusból 72 ° C-on 10 percig. min. A gombás ITS1 régiót tartalmazó PCR-termékeket, amelyek hossza széles körben eloszlott körülbelül 250–700 bps-től, megtisztítottuk és egymolekulájú valós idejű (SMRT) szekvenálásnak vetettük alá PacBio RSII eszköz (Pacific Biosciences) segítségével.
A gomba összetételének meghatározása PacBio technológiával
DNS-könyvtárat készítettünk a DNS Template Prep kit 2.0 (Pacific Biosciences) felhasználásával a gyártó utasításai szerint. A szekvenálást PacBio RS II rendszerrel hajtottuk végre, a C2 DNS-szekvenáló készlet (Pacific Biosciences) alkalmazásával P4 polimerázzal. A több mint nyolc teljes áteresztésű alszalagról összeállított körkörös konszenzus szekvenciát (CCS) a PacBio SMRT Analysis segítségével állítottuk elő, majd a primer szekvenciákat a FASTX-Toolkit (http://bbmap.sourceforge.net/) segítségével eltávolítottuk. A gombaelemzésekhez 1 mintában átlagosan 2202 olvasást generáltunk. A szekvenciákat OTU-kba csoportosították, 95% -os hasonlósággal definiálva az UCLUST 1.2.22q verzióval (http://sco.h-its.org/exelixis/web/software/pear/). Az egyes OTU-k reprezentatív szekvenciáit taxonómiailag osztályoztuk az RDP Classifier 2.2 verziójával, az ntF-ITS1 adatbázissal. 16 A Mann – Whitney U tesztet és a Fisher valószínűségi tesztjét alkalmazták a relatív bőség és a kimutatási arány összehasonlítására a statisztikai elemzésekhez.
Mikroorganizmusok
Reagensek
A búza AX-et (közepes viszkozitású, 31 centistoke) a Megazyme-tól, a CMC-t a Nacalai Tesque-től és az oldható keményítőt a Sigma-Aldrich-től szereztük be. A monoszacharidok d-xilózt és a d-glükózt a Nacalai Tesque-től szereztük be. A xilulózt és az 1-arabinózt a Sigma-Aldrich cégtől szereztük be. A vékonyréteg-kromatográfia standardjaként xiloligoszacharidokat (xilobióz, xilotrióz, xilotetraose, xilopentaose és xilohexaose; X1 – X6) a Megazyme-tól vásároltunk, a Silica Gel 60 F254 TLC lemezeket (5 cm × 10 cm) a Merck-től szereztük be. A kolorimetriás detektáló reagenst, az orcinol-monohidrátot a Sigma-Aldrich cégtől szereztük be. α-ciano-4-hidroxi-fahéjsavat (CHCA) és 2,5-dihidroxi-benzoesavat (DHB) a Shimadzu GLC-től vásároltunk. Az angiotenzin II-t, a 3-aminokinolint (3-AQ) és az N-acetil-renin szubsztrátumot a Sigma-Aldrich cégtől szereztük be. Az ammónium-dihidrogén-foszfátot a Merck Millipore cégtől szerezték be. A trifluor-ecetsavat (TFA) a Wako Pure Chemical Industries-től vásároltuk.
A baktériumok és gombák in vitro növekedése
Az arabinóz és a xilóz koncentrációjának mérése
A 72 órás tenyészet felülúszója C. albicans vagy C. tropicalis (5 ml) EZ-2 Plus Genevac centrifugális párologtatóval (SP Scientific) szárazra pároljuk, és a megszárított tartalmat 250 ul desztillált vízben (20-szor tömény) oldjuk. A felszabadult arabinóz és a xilóz koncentrációit az l-arabinóz/d-galaktóz vizsgálati készlet (K-ARGA, Megazyme) és a d-xilóz vizsgálati készlet (K-XYLOSE, Megazyme) segítségével számszerűsítettük.
Nagy teljesítményű folyadékkromatográfia
C. albicans és C. tropicalis AX jelenlétében 72 órán át tenyésztettük. A tenyészet felülúszóit (5 ml) ezután EZ-2 Plus Genevac centrifugális bepárlóval bepároljuk. A szárított mintákat vízben diszpergáljuk, majd a HPLC-analízis előtt szűrjük az oldhatatlan szilárd anyagok eltávolítására. A HPLC-t egy Shimadzu Prominence HPLC rendszerrel hajtottuk végre, amely Softa 400 ELSD detektorral és COSMOSIL Sugar-D oszloppal volt felszerelve (~ 4,6 mm × 250 mm; mozgó fázis: CH3CN/H2O (3/1), áramlási sebesség: 1,0 ml/perc, hőmérséklet: 30 ° C).
Vékonyréteg-kromatográfia
Kapacitása C. albicans, C. tropicalis, és P. copri Az AX vagy AX-eredetű metabolitok hidrolizálásához a hidrolízis termékeinek felbontásával és detektálásával TLC-t használtunk. C. albicans és C. tropicalis AX jelenlétében 72 órán át tenyésztettük. P. copri tenyészet felülúszójában növesztettük C. tropicalis AX jelenlétében. A tenyészet felülúszóit (5 ml) EZ-2 Plus Genevac centrifugális bepárlóval bepároljuk. Ezután a szárazanyagot 100 µl desztillált vízben szuszpendáljuk, és 2 µl-t foltozunk egy DC-Kieselgel Silica Gel 60 F254 TLC lemezre a termékek felbontása érdekében. Monomer xilózt (X1) és xiloligoszacharidokat (X2 – X6) (egyenként 0,5 mg/ml) és arabinózt (1,5 mg/ml) használtunk standardként. A TLC lemezeket egy n-butanol: ecetsav: desztillált víz (10: 5: 1 v/v/v) eluensként. 54,55 A termékeket ezután úgy vizualizáltuk, hogy a lemezeket metanolos orcinol (0,2% w/v) és kénsav (20% v/v) 1: 1 (v/v) elegyével permeteztük, majd a lemezeket 100 ° C-on hevítettük. ° C-on 5 percig. 28,56
Tömegspektrometria
A GF (IQI/Jic [Gf] ICR, valamint a BALB/c) egereket a japán CLEA-tól vásároltuk. Valamennyi egeret GF körülmények között tartottuk az Oszakai Orvostudományi Egyetem Kísérleti Állattartó Intézetében. Valamennyi állatkísérletet az Oszakai Egyetem Állatkutatási Bizottságának irányelveivel összhangban hajtották végre. A protokoll száma: DOUI28-026-007.
Gyarmatosítása P. copri és C. albicans GF egerekben
Mennyiségi PCR
Fluoreszcencia in situ hibridizáció
- A koplalást utánzó étrend modulálja a mikrobiotát, és elősegíti a bélregeneráció csökkentését
- Diéta, mikrobiota és gyulladásos bélbetegségek tanulságai a japán ételekből
- Könnyű csirkés sült rizs recept (japán) Pácolt szilva étel és ital
- A korrelációs hálózat elemzése megmutatja a hosszú távú, magas zsírtartalmú étrend és a testmozgás eltérő hatásait
- Könnyű, egészséges japán receptek