A növényi flavonoid izorhamnetin kemopreventív aktivitását vastagbélrákban az onkogén Src és a β-catenin közvetíti
Shakir M. Saud
1 Táplálkozástudományi kutatócsoport, Nemzeti Rákintézet, Rákmegelőzési Osztály, Rockville, MD
2 Rákmegelőzési Laboratórium, Rákkutató Központ, Nemzeti Rákkutató Intézet, Frederick, MD
Matthew R. Young
2 Rákmegelőzési Laboratórium, Rákkutató Központ, Nemzeti Rákkutató Intézet, Frederick, MD
Yava L. Jones-Hall
3 Purdue Egyetem Állatorvostudományi Főiskola, összehasonlító patobiológiai tanszék, West Lafayette, IN
Lilia Ileva
4 Kisállat-képalkotó program, SAIC-Frederick, MD Frederick
Mózes O. Evbuomwan
5 Patológiai Laboratórium, Rákkutató Központ, Országos Rák Intézet, Bethesda, MD
Jennifer Wise
6 Állattudományi Laboratórium, SAIC-Frederick, Frederick MD
Nancy H. Colburn
2 Rákmegelőzési Laboratórium, Rákkutató Központ, Nemzeti Rákkutató Intézet, Frederick, MD
Fiatal S. Kim
1 Táplálkozástudományi kutatócsoport, Nemzeti Rákintézet, Rákmegelőzési Osztály, Rockville, MD
Gerd Bobe
7 Linus Pauling Intézet, Oregoni Állami Egyetem, Corvallis, OR
8 Állat- és Rangeland Tudományok Tanszék, Oregoni Állami Egyetem, Corvallis, OR
Társított adatok
Absztrakt
Bevezetés
A vastagbélrák (CRC) a negyedik leggyakrabban diagnosztizált ráktípus az Egyesült Államokban, és ez a második fő oka a rákkal kapcsolatos halálozásoknak (1). A krónikus gyulladás, például a fekélyes vastagbélgyulladás és a Crohn-betegség a CRC fokozott kockázatával jár (2–5).
A tirozin-kinázok (SFK) Src-családja olyan nonreceptor fehérje-tirozin-kinázok (TK), amelyek több daganatos betegségben aktiválódnak, ideértve a CRC-t is (6). Az elsődleges CRC-ben megnövekedett Src-aktivitás a rossz prognózis mutatója (7). A C-terminális Src-kináz, más néven c-Src-kináz (CSK) negatívan szabályozza az SFK-t egy C-terminális tirozin (Y530 a c-Src-ben) foszforilezésével (8). Az SFK C-terminális foszforilezése stabilizálja a fehérjét egy gátló megerősítésben, amely megakadályozza az aktivációs hurok tirozin (Y419 a c-Src-ben) automatikus foszforilezését. A receptorszerű tirozin-foszfatáz CD45 és hasonló foszfasztázok a C-terminális tirozin-foszfát eltávolításával kölcsönösen szabályozzák az Src-t (9).
Az aktivált Src számos downstream útvonalat képes szabályozni, beleértve a foszfatidil-inozitol-3-kinázt (PI3-K), a Ras-Mek-ERK, a STAT3 és a p130-at, hogy növelje a túlélést, a proliferációt, az angiogenezist, a mozgékonyságot és az inváziót (6). Az aktivált Src foszforilezheti a β-katenint is, ami a plazmamembrán E-kadherin szekvenálásából való felszabadulását okozza, és fokozza annak mag lokalizációját (10). Úgy tűnik, hogy a vastagbélrák érzékeny az Src-szabályozás elvesztésére. A CSK negatív szabályozó expressziójának elvesztése és az Src túlzott expressziója egyaránt szerepet játszik a colorectalis carcinogenezisben (8).
Becslések szerint a CRC kezelésének költsége évi 6,5 milliárd USD (11). Az étrend megváltoztatása és az étrend-kiegészítők mind megvalósítható, mind biztonságos használata életképes és fontos stratégiát jelent a CRC megelőzésében (12). A polipprevenciós próba (PPT) legújabb klinikai vizsgálata, amely az étrend moduláció szerepét vizsgálta a colorectalis adenoma kiújulásának megelőzésében, azt sugallta, hogy az izorhamnetinben gazdag étrend fogyasztása a fejlett adenoma megismétlődésének csökkent kockázatával jár együtt (13).
Nemrégiben kimutatták, hogy az izorhamnetin képes elnyomni a bőrrákot azáltal, hogy kötődik és gátolja a MAP (mitogén-aktivált fehérje)/ERK (extracelluláris szignál által szabályozott kináz) kináz (MEK) 1 és a PI3-K (foszfoinozidid-3-kináz) hatását (14). A flavonolok CRC-megelőzésben játszott potenciális szerepének további vizsgálatához felmértük az emberek által általában fogyasztott 4 flavonol, az izorhamnetin, a kvercetin, a rutin és a miricetin hatásait a CRC egérmodelljében. Megállapítottuk, hogy az étrend izorhamnetinnel történő kiegészítése ezekben az egerekben szignifikánsan csökkentette a colorectalis tumorgenezist. Úgy tűnt, hogy az izorhamnetin-diéta megoldja a DSS által kiváltott gyulladást, mágneses rezonancia képalkotással (MRI), hisztopatológiával és immunhisztokémiával (IHC) mérve. Az izorhamnetin szintén gátolta az Src aktivitást és a β-catenin mag lokalizációját, valamint a CSK fokozott expresszióját in vivo és colorectalis carcinoma sejtekben. Végül megmutattuk, hogy az Src és a nukleáris β-catenin gátlása a CSK vastagbélráksejtek szabályozásától függ, és összefüggésben van a CSK expressziójával izorhamnetinnel táplált egerekben.
Anyagok és metódusok
Állatkísérletek
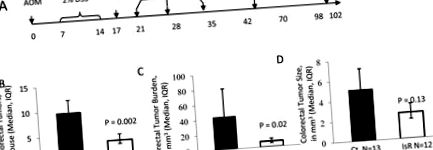
Az izorhamnetin csökkentette az AOM/DSS által kiváltott colorectalis tumorgenezist. A, Idősor, amely azt mutatja, hogy az egereket AOM-mal kezelték a 0. napon és 2% DSS-t a 7. és 14. napon. A 20. napon 25 és 33 egeret készítettünk MRI-vel, majd egy nappal később eutanizáltuk és szöveteket gyűjtöttük. Később (59. és 102. nap) az egereket eutanizáltuk, és a szöveteket MRI nélkül gyűjtöttük össze. B-D, a 102. napon összegyűjtött colorectumok elemzése. B, Daganatok száma egérenként (geometriai átlag ± standard hiba). C, Daganatterhelés mm 3/egérben (geometriai átlag ± standard hiba). D, Daganatméret mm 3/daganatban (geometriai átlag ± standard hiba). A Ct a kontroll étrendet jelzi N = 13, az IsR az izorhamnetin diétát jelzi N = 12.
Hisztopatológia
A vastagbélszöveteket az AOM vagy AOM DSS kezelés után különböző időpontokban gyűjtöttük össze, és egy éjszakán át 4% -os formaldehidben rögzítettük, és 70% -os etanolban tároltuk. A vastagbélszövetek rögzített szakaszait beágyaztuk paraffinba, 6 μm-es szakaszokra vágtuk, és a Histoserv Inc. (Germantown, MD, USA) mikroszkópos tárgylemezekre helyeztük. A tárgylemezeket hematoxilin-eozinnal (H&E) festettük szövettani analízishez fénymikroszkóppal, vagy xxilolban deparaffinizáltuk, és IHC-hez besorolt etanolban rehidratáltuk. A hisztopatológiai elemzéshez minden egyes állat esetében kiértékeltük a disztális vastagbél kb. 5 mm hosszú szakaszát. A szöveteket elvakítottuk, és a patológus félkvantitatívan 0-tól 15-ig pontozta a leírtak szerint (2. kiegészítő táblázat). A vastagbéleket a vastagbél csomópontjától kezdve értékeltük, és adorálisan 5 mm-re haladtunk a középső vastagbélig. Röviden, a nyálkahártyában a leukocita infiltrátum súlyosságát szubjektíven enyhe, mérsékelt vagy súlyos (1, 2, 3); az eloszlást értékelték és fokális/lokálisan kiterjedt, multifokális vagy diffúzként jelölték (1, 2, 3, ill.); és a mélységet csak nyálkahártyaként értékeltük, és a nyálkahártyáig terjedt, és a muscularis nyálkahártyájáig vagy a szerosáig terjed (1, 2, 3, ill. Az atipikus mirigy hiperplázia (AGH)/laphám (sq) metaplázia eloszlását fokális, multifokális vagy diffúzként értékeltük (1, 2, 3, ill. A fekély eloszlását fokális, multifokális vagy diffúz módon értékeltük (1, 2, 3, ill. Ha nekrózis volt jelen, szubjektíven enyhe, mérsékelt vagy súlyos besorolást kaptak, és ennek megfelelően értékelték (1, 2, 3, ill. 0 pontot rendeltek minden olyan kritériumhoz, amely nem szerepel a szakaszban, ez volt az eset a fekély és nekrózis egerek többségénél. Az egérenkénti összes betegség pontszámot az egyes egerek hat paraméterének összegzésével számítottuk ki.
Immunhisztokémia
Az immunhisztokémia céljából a metszeteket alacsony pH-jú módosított citrátpufferbe helyeztük (Dako, Carpinteria, CA, USA), és nyomáskamrán keresztül antigén-visszakeresésnek vetettük alá. A metszeteket 20 percig 3% H2O2-ban előinkubáltuk, és 1 órán át normál kecskeszérumban blokkoltuk. A metszeteket egy éjszakán át inkubáltuk primer antitest oldatban, az alábbiak szerint hígítva; Ki-67, foszfo-β-katenin 654 (Abcam laboratóriumok, Cambridge, MA, USA) 1:50, CD45 (BD biológiai tudományok, San Jose, Kalifornia, USA) 1:50, pSrc Y417 és β-katenin (Sejtszignalizáció, Danvers, MA, USA) 1: 100, illetve 1: 1000. A tárgylemezeket 1 órán át inkubáltuk biotinnal konjugált másodlagos antitestben, 1: 200 arányban hígítva. A metszeteket Vectorstain ABC készlettel kezeltük (Vector laboratories, Burlingame, CA, USA); a kapott aktivitást diaminobenzidinnel (Sigma, St. Louis, MI, USA) detektáltuk és ellenfestettük a Hematoxylinben. A CSK (Abcam Laboratories, Cambridge, MA) esetében a szöveteket 1:50 arányban inkubáltuk 1 órán át, és a Ventana iView DAB detektáló készlettel (Ventana Medical Systems, Oro Valley, AZ, USA) detektáltuk egy Ventana BenchMark-on.
Sejtkultúra
Humán vastagbélrák HT29 sejtvonalát az American Type Culture Collection-től (ATCC, Rockville, MD, USA) szereztük be és tenyésztettük a korábban leírtak szerint (16).
Western blot
A HT29 sejteket 100 mm-es lemezekre oltottuk, és DMSO hordozóval (417 (1: 1000), pSRC 529 (1: 1000), β-katenin (1: 2000), pAKT (1: 1000), pERK (1: 2000) kezeltük). ), Az E-Cadherin (1: 1000) és a pGSK3αβ (1: 1000) (Cell Signaling, Danvers, MA, USA) és a pβ-catenin 654 (Abcam laboratóriumok, Cambridge, MA, USA) éjszakán át 4 ° C-on, majd HRP-vel jelölt másodlagos antitestekben 1 órán át inkubálva. A sejteket SuperSignal West Femto kemilumineszcens szubsztráttal (Thermo tudományos, Rockford, IL, USA) fejlesztettük ki. Minden membránt β-Actinnal (1: 5000, Sigma, St. Louis, USA) MI, USA) az egyenletes fehérjetartalom biztosítása érdekében.
Valós idejű-PCR
A HT29 tenyésztett sejtek összes RNS-ét Trizol RNS extrakciós módszerrel izoláltuk. Röviden kloroformot adunk a mintához, majd rázás és centrifugálás után a vizes réteget izoláljuk. Ezután az izopropanolt adtuk a mintához az RNS kicsapása érdekében. Centrifugálás után az RNS-pelletet 70% -os etanollal mossuk. Az RNS-t tovább tisztítottuk RNeasy kit alkalmazásával (QIAGEN, Germantown, MD, USA). A cDNS-t Bio-Rad iScript reverz transzkriptáz alkalmazásával szintetizáltuk, és a PCR reakciókat Bio-Rad SYBR Green Master Mix alkalmazásával hajtottuk végre Bio-Rad iCyclerben (Bio-Rad Laboratories, Hercules, CA, USA). Az emberi CSK splicing 1. és 2. variánsát az IDT-től (San Jose, CA, USA) szereztük be, és a szekvencia a következő: sense, 5′-TCCGGCCCCGTCTCTCTTGG és antiszensz, 5′-ACCCTCACGGGCAGGACAGG. A PCR tartalmazott nem templátos kontrollt és GAPDH-t kontroll primer készletként. A CSK átirat aktivitási szintjét 2 -Δ (ΔCT) alkalmazásával számoltuk, ahol ΔCT = CTCSK-CTGAPDH és Δ (ΔCTstimulated -ΔCTcontrol).
CSK siRNS konstrukció
A HT29 sejteket stabilan transzfektáltuk 3 egyedi 27 mM-os siRNS-duplexszel - 2 nmol-t egyenként - CSK siRNS-sel szemben (Trilencer-27, Origene technologies, Rockville, MD, USA) vagy egy összekevert kontroll siRNS-sel, a gyártó transzfekciós reagensével és ajánlásaival. A transzfekció után a sejteket 36 órán át inkubáltuk. A teljes fehérjét elkülönítettük és Western-blot elemzésnek vetettük alá.
Soft Agar Assay
Asztal 1
A flavonolok ekimimoláris koncentrációjú (ppm) 85 napig történő táplálásának hatása az AOM/DSS által indukált hím FVB egerekre a morbiditásra, a tumorszámra és a tumorterhelésre (N = 32 csoportonként)
- A vastagbélrák okai, kockázatai, kezelése, megelőzése és egyebek
- Krónikus hasmenés a kezelés utáni kolorektális rák túlélőinek rákhálózatában
- A vastagbélrák Tünetei, kezelése, kockázati tényezői és okai
- A vastagbélrák kockázati tényezői és megelőzése
- Az étrend, a mikrobiota és a dysbiosis a vastagbélrák „receptje”