A koplalás, mint terápia a neurológiai betegségekben
Absztrakt
1. Bemutatkozás
A böjt népszerűsége megnőtt az új évezred során. Újdonsült lelkesedésének nagy részét az a közvélemény egyre növekvő felfogása vezérli, hogy a böjt az emberi egészség számos vonatkozásában előnyös lehet. A koplalás állítólagos egészségügyi előnyei ellenére kissé idegen marad a hagyományos orvosi gyakorlattól, bár ez a helyzet nem éppen új; a böjt történelmileg kiesett az divatból az orvostudományhoz való viszonyában. Ahogy Mark Twain mondhatta: „A történelem nem ismétli önmagát, de rímel.”
Ahhoz, hogy megértsük, miért és hogyan alkalmazható az éhgyomor terápiaként egy sor neurológiai betegségre, hasznos megvizsgálni a koplalást mind evolúciós, mind mechanisztikus összefüggésekben. Ennek során fokozatosan nyilvánvalóvá kell válnia, hogy az éhgyomorra és a gyógyszeralapú megközelítéseknek nem kell egymást kizárniuk; kombinálhatók, és egy ilyen megközelítés valóban ideális lehet. A növekvő egészségügyi költségek és a fogyatékossággal élő neurológiai rendellenességek egyre gyakoribb korszakában az önmeghatalmazó, költségmentes, hatékony terápia hatása a hagyományos orvosi megközelítések mellett jelentős és pozitív lenne.
Ennek alapján megvizsgáljuk az éhezés meghatározását, eredetét, mechanizmusait és különféle rendjeit, majd összefoglaljuk az éhezést alátámasztó bizonyítékokat a különféle idegrendszeri rendellenességek megelőzésében és kezelésében, majd végül beszédet folytatunk a leggyakoribb mellékhatásokról. az éhezéssel járó hatások és tévhitek.
2. Mi a böjt?
A „böjt” meghatározható az ételektől és italoktól való önkéntes elhagyásként meghatározott, ismétlődő időszakokra, az éhomi időszakok embernél általában 12 órától három hétig terjednek [1,2,3,4]. A koplalást leggyakrabban szembeállítják az ad libitum („igény szerint”) táplálással, amelyet a modern társadalmakban napi három vagy több étkezés jellemez, és - mozgásszegény életmóddal kombinálva - növelheti az ember krónikus neurológiai betegség kialakulásának kockázatát [ 5]. A böjtöt nem szabad összetéveszteni az éhezéssel, a krónikus táplálkozási elégtelenség állapotával, amely nem önkéntes és nem is kontrollált, és amely szervi elégtelenséggel és halállal tetőzhet.
2.1. Böjt: Eredet
Az evolúció során azok a szervezetek, amelyek képesek hosszú ideig tolerálni a tápanyagtól mentes környezetet, fontos túlélési előnyt élveztek azokkal szemben, akik erre nem képesek. Az evolúciós szelekciós nyomás az alacsony energiájú környezetekkel járó stresszek túlélése érdekében számos böjt által kiváltott anyagcsere-mechanizmust eredményezett, amelyek milliói - ha nem milliárd éve - konzerválódtak az emberekben [6].
2.1.1. A böjt ember előtti evolúciós eredete
Sok egysejtű és egyszerű többsejtű organizmus megváltoztatja anyagcseréjét a tápanyaghiány idején, amelynek célja az erőforrások megőrzése, a károk minimalizálása és a hosszú élettartam fokozása. Például, amikor a mutáns Escherichia coli baktériumokat egy tápanyagban gazdag húslevesből kalóriamentes táptalajba viszik át, számos anyagcsere-változáson mennek keresztül, amelyek négyszer hosszabb életben maradhatnak, mint a vad típusú baktériumok [7], és amikor az élesztő Saccharomyces cerevisiae egy táptalajról vízre cserélődik, stacionárius fázisba lép, amely növeli a stressztűrését és megduplázza élettartamát [8,9]. Hasonló reakciókat figyeltek meg a tápanyagoktól nélkülözött egyszerű többsejtű organizmusok esetében is, például a Caenorhabditis elegans fonálféregben, amely metabolikus „dauer állapotba” lép át, ami az élettartam jelentős növekedését eredményezi [10].
Ezen egyszerűbb életformákon túl számos komplex többsejtű organizmus, például tüdőhal, angolna, béka, kígyó és ízeltlábú is rendkívüli ellenállást váltott ki a tápanyaghiánnyal szemben, részben a nyugalmi anyagcsere sebességének és aktivitási szintjének csökkenése miatt [11]. Azonban ahelyett, hogy alvó szakaszba lépne, egyes komplex organizmusok éhezéskor valóban növelik kognitív és fizikai aktivitásuk szintjét, javítva az ételkeresés és -szerzés képességét. Az éhgyomorra rágcsálók például az agy (és az ivarmirigyek) kivételével a legtöbb szerv méretének csökkenését mutatták [12], ami a kognitív és fizikai teljesítőképesség fenntartását vagy javulását eredményezte [13,14]. Egy másik példában a fogságban élő oroszlánok a hagyományos napi etetési ütemtervről a „heti szurdok és gyors” ütemtervre váltottak, amely csak heti három étkezésből állt, és csökkentették a rosszul alkalmazkodó, sztereotip viselkedést, például a tempózást, és növelték az adaptív, vadászati kapcsolódó viselkedésmódok, például szippantás és üldözés [15].
2.1.2. Böjt az emberiség történetében
Az evolúció előtt őket megelőző sok organizmushoz hasonlóan a mezőgazdaság előtti emberek is rendszeres táplálékhiányt szenvedtek el [16]. Az emberek kétmillió éve vadásznak-gyűjtögetnek; csak viszonylag rövid, 12 000 évvel ezelőtt következett be a mezőgazdaságra való áttérés [17]. Így a poszt-agrárembereknek nem biztos, hogy elegendő idejük volt ahhoz, hogy teljes mértékben alkalmazkodjanak a gazdálkodás által biztosított folyamatos élelmiszer-ellátáshoz, ami részben magyarázhatja az önkéntes böjt gyakorlatok későbbi bevezetését a földi civilizációk többségénél [18]. Az ókori rómaiak például úgy vélték, hogy egynél több nagy étkezés elfogyasztása egészségtelen [19]. A legtöbb világvallás, beleértve a kereszténységet és az iszlámot, a rendszeres böjtöt is beépítette vallási gyakorlatába [20].
A modernebb időkben a böjt potenciális egészségügyi előnyeit szakaszosan felismerték - és elfelejtették. Edward Dewey amerikai orvos az 1800-as években kissé radikálisan szemlélte a böjtölést, és úgy vélte, hogy gyakorlatilag minden betegség a túlzott evésből fakad [21]. Az 1900-as években Otto Buchinger német orvos, aki elsőként szigorúan dokumentálta a böjt jótékony hatásait számos emberi betegségben, azt írta, hogy „A böjt minden kétséget kizáróan a leghatékonyabb biológiai módszer” [22]. Valter Longo, a 2000-es évek olasz származású biogerontológusa és böjtkutatója nemrégiben azt javasolta, hogy a böjt szelektíven aktiválja a többféle „hosszú élettartamú programot”, ami nemcsak meghosszabbított élettartamot, hanem hosszabb egészségügyi sémát is eredményezhet [23]. Érdekesség, hogy ezeknek és más böjti szószólóknak ellenére a modern társadalmakban a bevett étkezési szokások továbbra is napi három vagy több étkezés maradnak, ez az elhízás, a 2-es típusú cukorbetegség és a fogyatékossággal élő neurológiai rendellenességek világszerte növekvő gyakoriságával jár [ 24,25].
2.2. Böjt: Mechanizmusok
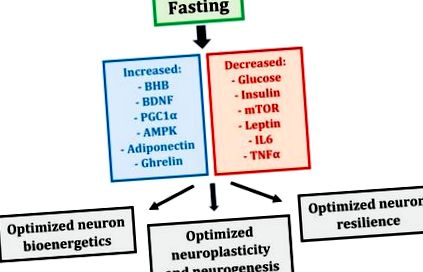
A böjt számos metabolikus és transzkripciós mechanizmus összehangolt változását váltja ki, amelyek befolyásolhatják az idegsejteket (1. ábra). Ezek a változások együttesen egy egész testet eredményeznek, megváltozott anyagcsere-állapotot eredményeznek, amely optimalizálja az idegsejtek bioenergetikáját, plaszticitását és a stresszel szembeni ellenálló képességét, és megmarad, vagy akár fokozott kognitív teljesítményt eredményez [5].
A koplalás által kiváltott metabolikus és transzkripciós mechanizmusok és ezek hatása az idegsejtekre (BHB - béta-hidroxi-butirát; BDNF - agyi eredetű neurotróf faktor; PGC1α - peroxiszóma proliferátor által aktivált receptor γ koaktivátor 1α; AMPK - AMP-aktivált protein-kináz; mTOR - emlős célpont a rapamicin; IL6 - interleukin 6; TNFα - tumor nekrózis faktor α).
2.2.1. Böjt: Teljes test, megváltozott anyagcsere-állapot
12–36 órás éhezést követően az emberi test a fiziológiás ketózisállapotba kerül, amelyet alacsony vércukorszint, kimerült májglikogén-raktárak, valamint zsírból származó ketontestek vagy ketonok májtermelése jellemez, amelyek fő energiaforrásként szolgálnak. az agy számára [26]. A máj a ketogenezis elsődleges helye, de az agy asztrocitái ketont is termelnek [27,28]. A böjt megkezdését követő néhány napon belül a ketonok az agy előnyben részesített üzemanyagforrásává válnak, amelyek energiaigényük akár 70% -át is biztosítják [29]. A ketonok az oxigénegységre jutó hatékonyabb energiaforrást jelentik az izmokban [30,31], és esetleg az agyban [32], fokozva az idegsejtek bioenergetikáját és a kognitív teljesítményt; például bebizonyosodott, hogy a rágcsálók öt napig keton-észternek vannak kitéve jobb területi tanulást és memóriát mutatva [33].
A ketonok azonban nem csupán az idegsejtek energiaforrásai; az elsődleges vér-keton, a béta-hidroxi-butirát (BHB) szintén fontos jelátviteli funkciókat szolgál [5,26]. A hippokampuszos és kortikális neuronokban a BHB létfontosságú jelátviteli szerepet játszik azáltal, hogy a hiszton-dezacetilázok, a BDNF-expressziót elnyomó enzimek gátlásával az agyból származó neurotróf faktor (BDNF) transzkripcióját indukálja [34]. A BDNF az idegsejtek működésének sarkalatos szabályozója; serkenti a mitokondriumok biogenezisét, fenntartja a szinaptikus struktúrát, ösztönzi az új hippokampusos neuronok termelését és túlélését, és fokozza az idegsejtek ellenállását a sérülésekkel és betegségekkel szemben [35].
A BHB és a BDNF mellett az éhezés indukálja a mitokondrium mester szabályozójának, a transzkripciós faktor peroxiszóma proliferátorral aktivált receptor α koaktivátorának la (PGC1α) expresszióját [5,36]. A PGC1α a mitokondriumok biogenezisének központi induktora, növeli a mitokondriumok biomasszáját, ami viszont fokozza az idegsejtek bioenergetikáját és lehetővé teszi a szinaptikus plaszticitást. A PGC1α a mitokondriumok összetételét és működését is modulálja; például a transzgénikus egerekből izolált izom mitokondriumokban, amelyek ektopikusan expresszálják a PGC1a-t, a vad típusú kontrollokhoz képest megnövekedett légzési képesség mutatkozik [37]. Így a PGC1α nemcsak a mitokondriumok biogenezisét stimulálja, hanem a megváltozott belső tulajdonságokkal rendelkező mitokondriumok képződését is; mindkettő pozitív hatással van az idegsejtek bioenergetikájára.
A böjt hatásos hatással van a glükóz metabolizmusára és az inzulinszignalizációra [1,6]. Emberekben a három-öt napos éhezés 30–40% -kal csökkenti a vércukorszintet, és gátolja a glikolízist [38,39,40]. A háromnapos alternatív napokon történő böjt 50–60% -kal csökkenti az inzulinszintet az éhgyomri napon [41]. Általánosságban elmondható, hogy három-öt napos koplalás emberben az inzulinszerű növekedési faktor (IGF-1), az emlősök fő növekedési faktorának 60% -os csökkenését, az IGF ötször-tízszeres növekedését is eredményezi. -1 kötő fehérje (IGFBP1), az egyik fő kötőfehérje, és a növekedési hormon (GH) kétszer-háromszoros növekedése, amely az izomtömeg megőrzése érdekében emelkedik [39,42,43]. Az éhezés tehát megakadályozza a krónikus, túlzott és potenciálisan szabályozatlan glükóz-anyagcsere kialakulását, miközben megőrzi az inzulinérzékenységet és a növekedési faktor jelátvitelt, amelyek mindegyike előnyös lehet a neuron bioenergetikájának.
A böjt szintén hatással van a sejtek szintézisére és lebontására [44,45]. A sejtszintézis és a lebomlás egyensúlyát az anyagcsere két fő szabályozójának, a rapamicin emlős célpontja (mTOR) és az AMP-aktivált protein kináz (AMPK) megfelelő aktivitása szabályozza [44]. Magas tápanyagtartalmú körülmények között (különösen aminosavak) az mTOR serkenti a fehérjeszintézist és a sejtek növekedését; ezzel szemben, ha a sejtek energiatartaléka alacsony, az AMPK az energiafogyasztás minimalizálása és az autofágia stimulálása érdekében csökkenti az mTOR értékét, egy olyan intracelluláris lebomlási utat, amely kitisztítja a rosszul összehajtott fehérjéket és a károsodott organellákat, újrahasznosítja a tápanyagokat és elősegíti az energiatermelést [45]. A böjt elnyomja az mTOR-t és megnöveli az AMPK-t, ezáltal korlátozza a tápanyagok fogyasztását és növekedését az autofágia és a túlélés javára; bár az mTOR-t és az AMPK-t többnyire izomsejtekben tanulmányozták, a legfrissebb bizonyítékok szerint ez a két antagonista mester metabolikus szabályozó az éhomi reakciókat is közvetítheti az idegsejtekben [5].
Az éhezés befolyásolja a zsíranyagcserét azáltal, hogy megváltoztatja a leptin, az adiponektin és a ghrelin hormonális aktivitását [1,5,46]. A leptin gyulladáscsökkentő állapothoz, míg az adiponektin fokozott inzulinérzékenységhez és elnyomott gyulladáshoz kapcsolódik [47]. A Ghrelin fokozott inzulinérzékenységgel is jár [48]; ráadásul a ghrelin stimulálhatja a hippocampus szinaptikus plaszticitását és a neurogenezist [49]. Az éhezés csökkenti a leptin értékét, de növeli az adiponektin és a ghrelin mennyiségét, amelyek valószínűleg hasznosak az idegsejtek bioenergetikája és az idegpályák fenntartása szempontjából.
Végül az éhezés elnyomja a gyulladást, csökkentve a gyulladásgátló citokinek, például az interleukin 6 (IL6) és a tumor nekrózis faktor α (TNFα) expresszióját [50,51]. Mivel a gyulladásos folyamatok számos különféle neurológiai rendellenességet támasztanak alá [52], az éhomi képesség az idegi és szisztémás gyulladás elnyomására javíthatja az idegsejtek túlélését ezekben a rendellenességekben.
2.2.2. Böjt: Több, mint csak kalória korlátozás
A kalória-korlátozás a kalóriabevitel krónikus 20–40% -os csökkenésére utal, az étkezési gyakoriság fenntartásával [1]. Több mint egy évszázados kutatás kimutatta, hogy a kalóriakorlátozás csökkenti a krónikus betegségeket és meghosszabbítja az élettartamot számos fajnál [53]. Mivel a kalória-korlátozás és az éhezés sok hasonló mechanizmust mutat be, és az éhezés az idő múlásával gyakran csökkenti a kalóriabevitelt, gyakran felmerül a kérdés, hogy a böjt potenciális előnyei pusztán a csökkent kalóriabevitelnek tudhatók be, szemben a böjtölés.
Számos állat- és embervizsgálat azt mutatta, hogy az éhgyomor a kalória-korlátozáson túl előnyös lehet a sejtek (ideértve az idegsejteket is) anyagcseréjét. Bebizonyosodott, hogy néhány alternatív napon böjtölt egér kétszer annyit ehet az etetési napon, így a heti nettó kalóriabevitelük hasonló marad az ad libitum-mal etetett egerekhez; az általános kalóriakorlátozás hiánya ellenére az előbbiek továbbra is kedvező metabolikus hatásokat mutatnak az utóbbiakhoz képest, beleértve a jobb glükózszintet és az inzulinaktivitást, valamint a neuronok fokozott rezisztenciáját egy neurotoxin, kaininsav iránt [54]. A túlsúlyos és elhízott, nem cukorbeteg emberek bevonásával végzett vizsgálatok nagyobb mértékű javulást mutattak az inzulinérzékenységben az éheztetteknél, összehasonlítva az éhezés nélküli, kalóriatartalmú társaikkal [55,56]. A közelmúltban egy öt hetes randomizált crossover vizsgálatban szenvedtek cukorbetegség előtti férfiak, összehasonlítva az éhgyomri rendszert, amely elegendő teljes kalóriabevitelt tartalmazott a fogyás megelőzésére, összehasonlítva a rendszeres étkezési ütemezésű kontrollcsoporttal; bár a kalóriabevitel mindkét csoportnak megfelelt, az éhomi csoport nagyobb mértékben javult az inzulinérzékenységben és az anyagcsere-egészség más mércéiben [57].
Az anyagcsere-egészségre gyakorolt feltételezett, koplalás-specifikus hatás legkézenfekvőbb magyarázata a böjt és a kalória-korlátozás - időzítés - alapvető megkülönböztetésében rejlik. Pontosabban, az éhezést szakaszosan alkalmazzák, míg a kalória-korlátozás folyamatos. 12–36 órás éhgyomri után észrevehető anyagcsere-átmenet vagy „váltás” következik be a szénhidrátok és a glükóz zsírsavakra és ketonokra történő felhasználásáról, mint a fő sejtes üzemanyagforrásról [5]. Az éhomi állapotban a kapcsoló „be van kapcsolva”, elméletileg az idegsejtekben az autofágia és a túlélési útvonalakat szabályozza, míg a táplált állapotban a kapcsoló „ki van kapcsolva”, hangsúlyozva az átalakulási és növekedési utakat. Így, a kalória-korlátozással ellentétben, az éhezés kiaknázza az egyes szekvenciális bioenergetikai kihívásokat azáltal, hogy „viszonylag stresszmentes sejt-helyreállítási fázist állít be”; más szavakkal, a kapcsolás - az intermittálás - adhatja meg az előnyét a neuron anyagcserének. Valójában a krónikás káros lehet, függetlenül attól, hogy táplált vagy éheztetett metabolikus állapot van-e - például az akut mTOR-aktiváció elősegíti az izom hipertrófiáját, míg a krónikus aktiváció atrófiát eredményez [58,59,60], és az időszakos AMPK-aktiváció fokozza a neuroplaszticitást, de a tartós AMPK-aktiváció rontja [61].
2.3. Böjt: rendek
Három paraméter jellemzi az éhezési rendet - az ételek és italok korlátozásának intenzitása, az éhezési időszakok gyakorisága és az éhezési időszakok időtartama (1. táblázat). Az „ideális” éhgyomri rend az egyéni életmódtól és a tolerálhatóságtól függ.
Asztal 1
Az emberi koplalási rendek (intenzitás, gyakoriság és időtartam szerint).
- Teljes cikk A BMI és az éhomi inzulin társulása a szív- és érrendszeri betegségek kockázati tényezőivel
- A fájdalom-szindróma gyógyszeres terápiájának jellemzői végstádiumú vesebetegségben szenvedő betegeknél
- A peptikus fekélybetegség endoszkópos értékelése a ramadán böjt alatt
- A HuoXueHuaYu nem alkoholos zsírmájbetegség terápiájának értékelése szisztematikus áttekintés és
- A Parkinson-kórban szenvedő betegek étkezési szokásai és neurológiai jellemzői Következmények a gyakorlathoz