A lenmagolaj gyulladáscsökkentő és egerekben a bél mikrobiotájának modulálásával enyhíti az alkoholos májbetegségeket
Absztrakt
Háttér
Az alkoholos májbetegség (ALD) a következetesen túlzott alkoholfogyasztás által okozott májkárosodás széles spektrumát képviseli. Kevés kielégítő előrelépés történt az ALD kezelésében. Ezért sürgősen újszerű és praktikusabb kezelési lehetőségekre van szükség. A lenmagolaj (FO) gazdag α-linolénsavban (ALA), egy növényi eredetű n-3 többszörösen telítetlen zsírsavban (PUFA). Az étrendi FO hatása a krónikus alkoholfogyasztásra azonban továbbra sem ismert.
Mód
Ebben a tanulmányban értékeltük az étrendi FO lehetséges hatásait az ALD csillapítására és a kapcsolódó mechanizmusokra egerekben. Először az egereket véletlenszerűen négy csoportba soroltuk: páros táplálás (PF) kukoricaolaj (CO) csoporttal (PF/CO); alkoholos táplálás (AF) CO csoporttal (AF/CO); PF FO csoporttal (PF/FO); AF FO csoporttal (AF/FO). Mindegyik csoport módosított Lieber-DeCarli folyékony étrendet kapott, amely kontrollként izokaloros maltóz-dextrint vagy alkoholt tartalmaz kukoricaolajjal és lenmagolajjal. 6 hetes etetés után az egereket eutanizálták és a kapcsolódó indikációkat vizsgálták.
Eredmények
A testtömeg (BW) szignifikánsan megemelkedett az AF/FO csoportban az AF/CO csoporthoz képest. Az étrendi FO csökkentette a kóros emelkedett aszpartát-aminotranszferáz (AST) és alanin-aminotranszferáz (ALT) szintet a krónikus etanolfogyasztás során. Ezeknek a paramétereknek a javulása, valamint a májkárosodás HE-festéssel az ALD étrendi FO-kiegészítésében megmutatta, hogy az étrendi FO hatékonyan elősegítheti az ALD elleni védelmet. A mögöttes mechanizmusok további megértése érdekében megvizsgáltuk a gyulladásos citokinszinteket és a bél mikrobiotáját. Meghatároztunk egy sor gyulladásos citokint, köztük a TNF-a, IL-1β, IL-6 és IL-10-et. Ennek eredményeként a TNF-a, az IL-1β és az IL-6 az AF/FO csoportban csökkent a kontroll csoporthoz képest; Az IL-10 nem mutatott szignifikáns változást az AF/CO és az AF/FO csoportok között (o > 0,05). A bél mikrobiota gén szekvenálása és elemzése azt mutatta, hogy a Porphyromonadaceae és Parasutterella, valamint a Firmicutes és Parabacteroides, AF csoportban a PF kontrollhoz képest. Továbbá az étrendi FO etanolfogyasztási csoportban jelentős csökkenést váltott ki Proteobaktériumok és Porphyromonadaceae összehasonlítva az AF/CO csoporttal.
Következtetés
Az étrendi FO gyulladáscsökkentő és moduláló bél mikrobiotán keresztül enyhíti az alkoholos májbetegséget, így olcsó beavatkozásként szolgálhat az ALD megelőzésében és kezelésében.
Háttér
Az alkoholos májbetegség (ALD) a következetesen túlzott alkoholfogyasztás által okozott májkárosodás széles spektrumát képviseli, világszerte rangsorolva a morbiditást és a halálozást az alkohollal visszaélők körében [1]. Az ALD magában foglalja a májkárosodás szövettani spektrumát, az egyszerű steatosistól a gyulladás által jellemzett hepatitiszig, a fibrózis és a cirrhosis előrehaladásával. Úgy gondolják, hogy a hepatitis, amelynek krónikus alkoholfogyasztóknál körülbelül 10–35% -a fordul elő, és több mint 1/3 jelentős morbiditásért és halálozásért felelős, döntő szerepet játszik az ALD reverzibilis kóros folyamatában [2–4]. Eddig kevés kielégítő előrelépés történt az ALD kezelésében, kivéve az alkoholtól való tartózkodást [4, 5]. Ezért sürgősen újszerű és praktikusabb kezelési lehetőségekre van szükség.
A bél mikrobiota döntő szerepet játszik az ALD progressziójában és patogenezisében. A felhalmozódó bizonyítékok azt mutatták, hogy a bél mikrobiota szorosan kapcsolódik a májhoz az ALD-ben, mint a bél-máj tengelyén [6, 7]. A bél mikrobiota homeosztázisának károsodása az ALD-ben gram-negatív patogén baktériumok szaporodását idézi elő, amelyek lipopoliszacharidot (LPS) generálnak és a májszövetbe transzlokálódnak a hepatitis kiváltó okaként a TLR-4-hez (Toll-szerű receptor-4) kötődve makrofágokon és neutrofileken. Sőt, Campos Canesso és mtsai. kimutatta, hogy az alkohol csíra nélküli egereknek történő beadása összefügg a májgyulladás és sérülés hiányával, ami azt jelzi, hogy önmagában az alkohol nem elegendő a májbetegség kialakulásához, és hogy a mikrobiota változásainak jelenléte is szükséges [8]. Így a bél mikrobiota dysbiosisának modulációja gyengítheti a májkárosodást ALD-ben [3, 9].
A lenmagolaj (FO) gazdag növényi eredetű omega-3 (n-3) többszörösen telítetlen zsírsavakban (PUFA), főleg α-linolénsavban (ALA, 18: 3 n-3). Klinikai vizsgálatok arról számoltak be, hogy az ALD-betegek általános jellemzője az alacsony n-3PUFA-szint a szérumban és a májszövetben [10, 11]. Az étrendi FO az egerekben a zsírszövet-máj tengelyen enyhítette a lipid homeosztázist a zsírszövet-máj tengelyen, megakadályozva az akut alkoholos májsteatózist [11]. Az étrendi FO hatása azonban a krónikus ALD gyulladására és a bél micorbiotájára továbbra sem ismert.
Jelen tanulmányban értékeltük az étrendi FO hatását az egerek ALD csillapítására és a kapcsolódó mechanizmusokra. A tanulmány eredményei hozzájárulhatnak az FO ALD-ben betöltött szerepének és az étrend, a bél mikrobiota, a gyulladás és az ALD közötti kölcsönhatás bonyolultságának megértéséhez.
Mód
Állatok és étrend
Hatvan hím C57BL/6 J egeret (8 hetes) a Vital River Laboratory Animal Technology Co. Ltd.-től (Peking, Kína) szereztünk be. Az állatokat egyedi ketrecekben helyeztük el szabályozott hőmérsékletű (22 ± 1 ° C), fényciklusos (12 órás fény/sötét ciklus) helyiségben.
Az egerek etetésére szolgáló összes folyékony étrendet a TROPHIC Animal Feed High-tech Co., Ltd., Nantong, Kína cégtől vásároltuk.
Kísérleti terv
A plazma AST és ALT szintjének meghatározása
A májfunkció biokémiai mutatóiként a plazma aszpartát-aminotranszferáz (AST) és az alanin-aminotranszferáz (ALT) aktivitását minden csoportban az AU400 automatikus biokémiai analizátorral (Olympus, Japán) határoztuk meg.
A plazma endotoxin meghatározása
A plazma LPS-szinteket minden egérben/csoportban limulus amebocita lizátum készlettel (Xiamen Bioendo Technology Co.Ltd, Xiamen, Kína) mértük a gyártó utasításainak megfelelően.
HE festés
Az egerek feláldozása után a májszöveteket azonnal formalinnal rögzítettük és hematoxilin-eozin (HE) festéssel dolgoztuk fel a májkárosodás, beleértve a hepatocita zsírváltozást, a gyulladásos sejteket, a degenerációt és a nekrózist értékelésére.
ELISA vizsgálatok
A májszöveteket (0,5 g) 1,5 ml jéghideg 50 mM Tris pufferben (pH 7,2, Tris 1% Triton-X 100 és 0,1% proteáz inhibitorral) homogenizáltuk, és jégen 90 percig rázattuk. Ezután a homogenizátumokat 3000 x g sebességgel 15 percig centrifugáltuk. A felülúszókat összegyűjtöttük a tumor nekrózis faktor (TNF) -α, IL (interleukin) -1β, IL-6 és IL-10 koncentrációk meghatározására. Az egyes citokinszinteket a plazmában vagy a májszövetek felülúszóiban enzimhez kapcsolt immunszorbens vizsgálattal (ELISA) végeztük a gyártó utasításainak megfelelően (e-Bioscience, CA, USA).
Bél mikrobiotanalízis
A széklet mikrobiális 16S rRNS gén szekvenálását és elemzését a korábban leírtak szerint vizsgáltuk [12]. 6 hetes etetés után csoportonként öt egeret választottak ki véletlenszerűen, és friss sterilizált ketrecekbe helyezték át. Minden egér friss ürülékét összegyűjtöttük, azonnal fagyasztottuk folyékony nitrogénben, majd -80 ° C-on tároltuk a DNS-ek kivonásáig.
A V3 és V4 16S rDNS hipervariábilis régiókat tartalmazó szekvenciákat a TranStart FastPfu DNS Polymerase (TransGen Biotech, Kína) amplifikálta a következő primerek alkalmazásával (5 ’- 3’): 341 F-CCTACGGGNGGCWGCAG, 805R-GACTACHVGGGTATCTAATCC. A PCR termékeket elemeztük és elektroforézissel szétválasztottuk 2% agarózgélen (amely SYB zöldet tartalmaz), majd Qiagen gélkivonó készlettel (Qiagen, Németország) tisztítottuk. A szekvenáló könyvtárakat a TruSeq DNS PCR gyártó utasításainak felhasználásával állítottuk elő, és indexkódokat adtunk hozzá. A könyvtárat az Illumina HisSeq2500 platform segítségével szekvenáltuk és elemeztük a Shanghai Tai Chang géntechnológiai co., LTD., Kína
Statisztikai analízis
Az összes adatot a Prism 5.0 (GraphPad Software Inc., CA, USA) segítségével elemeztük. Az eredményeket átlag ± SEM-ként ábrázoltuk. A kísérleti csoportok közötti statisztikai különbség meghatározásához kétirányú varianciaanalízist (ANOVA), majd a törökországi többszörös összehasonlító tesztet alkalmaztunk. Az eredményeket jelentősnek tekintették a P
Eredmények
Az egerek rutinparaméterei különféle étrendi csoportokban
Négy csoport között nem volt szignifikáns különbség a kezdeti testtömegben (BW). 6 hetes etetés után azonban az AF/CO csoportban a végső BW szignifikánsan csökkent, összehasonlítva a páros PF/CO csoportban (P 1. táblázat: Egerek rutinparaméterei különböző táplálkozási csoportokban ALD-ben
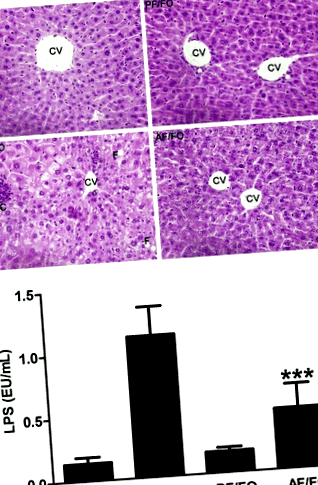
Az étkezési FO gyengítette a máj hisztopatológiai károsodását és csökkentette a plazma LPS szintjét
A különféle csoportokban végzett májfestés szerint a máj zsíros változása, nekrózisa és gyulladása súlyos volt a krónikus alkoholos táplálkozási csoportban (AF/CO), míg a hosszú távú étkezési FO egyértelműen enyhítette az alkohol okozta máj hisztopatológiai károsodást (1a. Ábra).
A plazma LPS az AF/FO csoportban szignifikánsan csökkent az AF/CO csoporthoz képest (P 2. ábra
Az étrendi FO csökkentette a máj gyulladásos citokinszintjét az ALD-ben
Kimutattuk a citokintermelést a májszövetben, és emelkedett TNF-α, IL-1β, IL-6 és IL-10 szintet találtunk az AF csoportban a PF csoporthoz képest. Hasonlóképpen a TNF-α (o 3. ábra
Diétás FO modulált bél mikrobiota ALD-ben
A bél mikrobiotáról egyre inkább azt gondolják, hogy kritikus szerepet játszik az ALD fejlődésében egerekben és emberekben [3, 14–18]. Annak megvizsgálására, hogy az AF/CO, AF/FO és ezek a PF csoportok között megfigyelt májgyulladás-különbségek összefüggenek-e a bél mikrobiota különbségével, elvégeztük a széklet metagenomikus elemzését. A szekvenálási adatok ésszerűségét ritkasággörbével értékeltük (4. kiegészítő fájl: S2. Ábra). Megfigyelték, hogy a ritkasággörbe általában lapos volt, amikor a sorozatszám 20 000-re nőtt, ami azt jelzi, hogy a szekvenálási adatok mennyisége ésszerű volt.
A baktériumközösség általános szerkezetét súlyozatlan UniFrac (Pcoa) (4. ábra) és súlyozott távolsági mátrixok (NMDS) segítségével elemeztük (5. kiegészítő fájl: S3. Ábra). Pcoa kimutatta, hogy a krónikus alkoholfogyasztás nyilvánvaló különbséget váltott ki a székletmintákban a fajok tekintetében a páros táplálású kontroll etetéshez képest (4a. És b. Ábra). A fajok tekintetében nincs nyilvánvaló változás az AF/CO csoport és az AF/FO csoport között (4c. Ábra). Érdekes módon a normál folyékony etetés során a kiegészítő FO látszólag megváltoztatta a székletfajt a CO-etetéshez képest (4d. Ábra). Az NMDS analízisből hasonló eredményeket kaptunk (5. kiegészítő fájl: S3. Ábra).
PcoA elemzés, amely a székletminták faji különbségét mutatja. A béta változatosság a súlyozott UniFrac-on volt. a: PF/CO vs. AF/CO; b: PF/CO vs. PF/FO; c: AF/CO vs. AF/FO; d: PF/FO vs. AF/FO
Menekültügyi szinten a Firmicutes jelentősen megnőtt az alkoholt etető csoportokban, mint a PF csoportokban (P = 0,0159, 5a. Ábra). Eközben nincs változás az AF/FO és az AF/CO csoportok között (P = 0,8385, 5a. Ábra). Bacteroidetes a különböző adminisztrációs csoportokban az arány több mint felét tette ki, és az AF/CO csoportban csökkent a többi három csoporthoz képest, de nem volt szignifikáns különbség. Az aránya Proteobaktériumok nem mutatott változást a krónikus alkoholfogyasztásban a nem etanolos kontrollokhoz képest. Az aránya Proteobaktériumok az AF/FO csoportban szignifikánsan alacsonyabb volt, mint az AF/CO csoportban (0,074 ± 0,009 vs. 0,117 ± 0,003, P 5. ábra
Mikrobiális fajok relatív bősége az egerek ürülékében a törzs és a nemzetség szintjén. a: A menekültügyi elemzés; b: A nemzetség elemzése
Nemzetségi szinten azt találtuk Porphyromonadaceae volt a legelterjedtebb nemzetség a kontroll csoportokban (PF/CO és PF/FO), és nyilvánvalóan csökkent az étrendi alkohol beadási csoportokban (P 6. ábra
Az egerek székletében található mikrobiális közösség összetételének hőtérkép-elemzése. a: alkoholos táplálás (AF) vs. páros táplálás (PF); b: lenmagolaj (FO) és kukoricaolaj (CO)
Vita
Jelen tanulmányban a hosszú távú étrendi FO krónikus ALD-re gyakorolt hatását vizsgáltuk. Az ALD egereken végzett 6 hetes in vivo kezelésével tanulmányunk kimutatta, hogy a kiegészítő FO hatékonyabban mutatta a májkárosodást, ami arra utal, hogy ez az olcsó beavatkozás megelőző és terápiás potenciállal rendelkezik. További tanulmányunk feltárta, hogy ez a hatékony kezelés a bél mikrobiotájának megváltozásával és a májgyulladás csökkenésével járhat.
Számos tanulmány azt mutatta, hogy az alkohol expozíció jelentősen csökkentette a végső testtömeget krónikus ALD-ben [3, 9, 11, 19]. Ebben a tanulmányban azt is megállapítottuk, hogy a BW alacsonyabb volt az AF/CO csoportban, bár a kalóriabevitel minden csoportban azonos volt. Az étrendi FO hatékonyan javította a végső BW-t az ALD-ben az AF/CO-hoz képest, jelezve, hogy az FO pozitívan befolyásolhatja a tápanyagok felszívódását és a kalóriafelhasználás hatékonyságát a gyomor-bél traktusban ALD-ben. A máj súlya és a relatív máj súlya az AF csoportban, az étrendi olajtól függetlenül, szignifikánsan nőtt, ami összhangban volt a korábbi jelentésekkel [9], ami arra utal, hogy a krónikus etanol bevitelben a CO helyettesítése a CO-val nem volt hatással a máj súlyára.
Ebben a tanulmányban rendellenes emelkedett plazma ALT- és AST-szinteket találtunk az AF/CO csoportban, ami alkohol okozta májkárosodást jelez [9]. Az AF/FO csoportban a plazma ALT és AST jelentős csökkenése azt mutatta, hogy a kiegészítő FO enyhítette a krónikus etanolos táplálás okozta májkárosodást. Hasonlóképpen, a hosszú láncú n-3 többszörösen telítetlen zsírsavakban, elsősorban az eikozapentaénsavban (EPA) és a dokozahexaénsavban (DHA) gazdag étrendi halolaj is megmutatta a májkárosodás csillapításának képességét az ALD és az ALT ALT szintjének csökkentésével [9]., 17]. Az olcsó diétás FO-eredetű ALA, amely az EPA és a DHA szintézisének előfutára, az EPA-val és a DHA-val beszélgethet a vérben és a szövetekben [20].
Az LPS, amely az ALD májgyulladásának kiváltója, a portális vénán keresztül transzbolál a májba, és az antigént bemutató sejtek (APC) TLR-4-hez kötődve gyulladásos immunválaszt vált ki és végül krónikus hepatitist okoz [21, 22]. Ebben a tanulmányban a plazma LPS az AF/FO csoportban nyilvánvalóan csökkent, ami azt mutatja, hogy az étrendi FO csökkentheti a bél áteresztőképességét és csökkentheti az LPS transzlokációját a belekből a májba és az ALD szisztematikus keringését, ami hozzájárult a máj gyulladásos reakciójának csökkenéséhez. Ez a csillapítás a bél veleszületett immunrendszerével hozható összefüggésbe, és a mögöttes mechanizmust tovább kell kutatni [23].
A Kupffer-sejtek és a neutrofilek aktiválása oxidatív stresszt indukál, és gyulladásos citokineket, például TNF-α, IL-1β és IL-6 termel, amelyek a hepatociták apoptózisát és nekrózisát okozzák, és következésképpen májkárosodást eredményeznek [9, 24, 25]. Eredményeink azt mutatták, hogy a TNF-α, IL-1β és IL-6 plazma- és májszövetszintek az AF/FO csoportban szignifikánsan csökkentek, bizonyítva, hogy az étrendi FO gyulladáscsökkentő citokinek révén enyhítette a májgyulladást. Az IL-10 egy gyulladáscsökkentő citokin, amelyet Kupffer-sejtek és monociták szabadítanak fel [26, 27]. De ebben a tanulmányban azt találtuk, hogy az IL-10 nem mutatott különbséget az összes csoport között, ami nem volt párhuzamos a korábbi vizsgálattal [9]. Feltételeztük, hogy az IL-10 bonyolult szerepet játszhat a pro- és gyulladáscsökkentő mediátorok szabályozása közötti egyensúlyhiányban krónikus etanol-expozíció során. Ezen túlmenően további vizsgálatunkban meg kell vizsgálni a szabályozó immunsejteket, különösen a szabályozó T-limfocitákat (Tregs) [28], amelyek kritikus szerepet játszanak a proinflammáció szabályozásában, hogy fenntartsák az immunrendszer egyensúlyát az ALD-ben [29, 30].
Úgy gondolják, hogy a bél mikrobiota diszbiózisa döntő szerepet játszik az ALD patogenezisében [6, 31, 32]. Ebben a tanulmányban menekültügyi szinten, Bacteriodetes és Firmicutes voltak a legdominánsabbak mind a négy csoportban, amelyek párhuzamosak voltak a korábbi tanulmányokkal [12, 33]. Az aránya Firmicutes jelentősen növekedett az alkoholos táplálkozási csoportokban a PF csoportokhoz képest, amelyek összhangban voltak a korábbi tanulmányokkal [3, 32]. Eredményeink csökkenést mutattak Bacteriodetesés magasabb Proteobaktériumokalkoholfogyasztási csoportban (AF/CO), amelyek felelősek a bél dysbiosisáért, amint azt a közelmúltban emberi és állatkísérletekben leírták [3, 18]. Fontos, hogy az étrendi FO jelentősen csökkentette a Proteobaktériumok krónikus alkoholfogyasztás során, feltárva, hogy az étrendi FO feltehetően a bél modulálásával csillapíthatja a bél dysbiosisát Proteobaktériumok. Az ezen hatások mögött álló pontos mechanizmus (oka) t még meg kell határozni.
Nemzetségi szinten csökkent a bél Porphyromonadaceae és fordítva emelkedett Parabacteroides krónikus alkohol beadása során találtak. Porphyromonadaceae negatívan korrelált a máj TNF-α expressziójával az ALD-ben [34], ami párhuzamos volt eredményeinkkel és a bél csökkenésével Porphyromonadaceae előnyös lehet a májgyulladás súlyosbodásában. Emelt Parabacteroidesaz AF/FO csoportban szintén részt vett az ALD májgyulladásának megelőzésében, ahogyan azt korábban leírták [34]. Eredményeink azt mutatták, hogy az alkohol beadása jelentős csökkenést eredményezett Parasutterella összehasonlítva a kontroll csoportokkal. A fiziológiai szerepe Parasutterella sokkal kevésbé érthető. Összességében a mikrobiota pontos szerepe bonyolult és még mindig nagyrészt ismeretlen.
Következtetések
Ez a tanulmány kiemelte, hogy az étrendi FO enyhíti az alkoholos májbetegségeket gyulladáscsökkentő és egerekben a bél mikrobiotájának modulációján keresztül, arra utalva, hogy potenciálisan olcsó beavatkozásként szolgálhat az ALD megelőzésében és kezelésében.
- Sebészeti Osztály - Alkoholos májbetegség
- Az étrendi lenmagolaj megakadályozza a nyugati típusú étrend okozta alkoholmentes zsírmájbetegséget
- Szemtünetek A sárga szemek sárgaságra és májbetegségre utalhatnak
- Rendkívül elhízott arcok A zsíros májbetegségek legnagyobb kockázata MedPage Today
- Az étrendi tápanyag-összetétel befolyásolja a májbetegség előrehaladását Természet Vélemények Gasztroenterológia;