A lipid- és inzulininfúzió által kiváltott vázizom inzulinrezisztencia valószínűleg a metabolikus visszacsatolásnak köszönhető, és nem az IRS-1, Akt vagy AS160 foszforiláció változásainak.
Absztrakt
Ezért a jelen vizsgálat célja annak meghatározása volt, hogy az akut lipid- és inzulininfúzió okozta vázizom inzulinrezisztencia kialakulása összefügg-e hibás inzulinjelzéssel.
Állatok
Az összes műtéti és kísérleti eljárást az Állatetikai Bizottság (Garvan Intézet/St. Vincent Kórház) hagyta jóvá, és összhangban voltak az Ausztrál Nemzeti Egészségügyi és Orvosi Kutatási Tanács állatkísérletekkel kapcsolatos irányelveivel.
A felnőtt hím Wistar patkányokat (Animal Resources Center, Perth, Ausztrália) közösen 22 ± 0,5 ° C-on tartottuk, kontrollált 12: 12-órás világos-sötét ciklussal (világítás 0700 és 1900 között). Ad libitum normál rágcsáló-étrendet (Rat Maintenance Diet, Gordons Specialty Feeds, Sydney, Ausztrália) tápláltak, amelyek 10% zsírt, 69% szénhidrátot és 21% (wt/wt) fehérjét, valamint rostot, vitaminokat és ásványi anyagokat tartalmaztak. 1 hetes akklimatizáció után a patkányokat ketaminnal (Ketalar, 80 mg/kg) és xilazinnal (Ilium Xylazil, 20 mg/kg) intraperitoneálisan injektáltuk. A kanüleket aszeptikus körülmények között ültették be a jobb és a bal nyaki vénába. A katétereket a nyak hátsó részén kívülre tették. A patkányokat a műtét után egyedileg helyezték el, és naponta kezelték a stressz minimalizálása érdekében. Az átlagos testtömeg a kísérleti napon 300-350 g volt.
Lipid infúzió
Analitikai módszerek
A vér és a plazma glükózszintjét immobilizált glükóz-oxidáz módszerrel határoztuk meg (YSI 2300 modell, Yellow Springs Instruments, Yellow Springs, OH). A plazma inzulint radioimmunassay kit segítségével (Linco, St. Louis, MO) mértük. A plazma nem észterezett zsírsav (NEFA) szintjét spektrofotometriásan határoztuk meg egy kereskedelemben kapható készlet segítségével (NEFA-C, WAKO Pure Chemical Industries, Osaka, Japán).
A 3 H- és 14 C-jelölt nyomjelzők plazma- és szövetszintjét a korábbiakban leírtak szerint mértük az egész test és az izom glükózfelvételének kiszámításához; Szintén kiszámították a szöveti glikogén koncentrációt és a [14 C] glükóz beépülésének arányát a glikogénbe (23). A vörös quadriceps (RQ) triglicerideket Folch és munkatársai módszerével extraháltuk. (10) és enzimatikus kolorimetriás módszerrel (GPO-PAP reagens, Roche Diagnostics) számszerűsítettük. A DAG-t, a ceramidot és a hosszú láncú acil-CoA-kat (LCACoAs) extraháltuk és számszerűsítettük a közzétett módszerekkel (2, 41). A piruvát-dehidrogenáz (PDH) komplex (PDHC) aktivitását 5 térfogat 50 mM kálium-foszfátban, 10 mM EGTA-ban, 2 mM ditiotreitolban, 2% BSA-ban, 10 μg/ml aprotininben, 10 μM leupeptinben és 1 térfogatszázalékban elkészített teljes szöveti homogenizátumokban mértük. mM PMSF. A PDHC-aktivitást spektrofotometriásan határoztuk meg 30 ° C-on, a korábban leírtak szerint (27). A PDHC-aktivitást a citrát-szintáz aktivitáshoz viszonyítva fejeztük ki, amelyet 30 ° C-on határoztak meg, az előzőekben leírtak szerint (35).
A vázizom homogenizátumokat fehérje extrakciónak és immunblotolásnak vetettük alá, a korábban leírtak szerint (22). A sűrűségmérést az IPLab Gel szoftver (Signal Analytics, Bécs, VA) alkalmazásával végeztük. Az anti-inzulin receptor-β antitesteket a BD Biosciences-től (San Jose, Kalifornia) szereztük be; anti-phospho-Tyr 1162/63 inzulinreceptor a BioSource International-től (Camarillo, Kalifornia); anti-phospho-Tyr 612 IRS-1 a Sigma-Aldrich-től (St. Louis, MO); anti-Akt, anti-foszfo-Ser 473 Akt, anti-glikogén szintáz kináz (GSK) -3β, anti-GSK3α, anti-foszfo-Ser 21/9 GSK3α/β, anti-IRS-1, anti-IκBα, anti -phospho-Thr 183/Tyr 185 JNK és anti-JNK a Cell Signaling Technology-tól (Danvers, MA); anti-AS160 az Upstate Biotechnology-tól (Lake Placid, NY); és anti-14-3-3β a Santa Cruz Biotechnology-tól (Santa Cruz, Kalifornia). Az Anti-phospho-Thr 642 AS160 a Symansis (Auckland, Új-Zéland) ajándéka volt.
Statisztikai analízis
A statisztikai elemzéseket a Prism5 (Graphpad Software, San Diego, CA) alkalmazásával végeztük. A releváns csoportok közötti különbségeket nem párosított Student-ekkel értékeltük t-teszt vagy ANOVA Tukey-Kramer post hoc tesztekkel. P 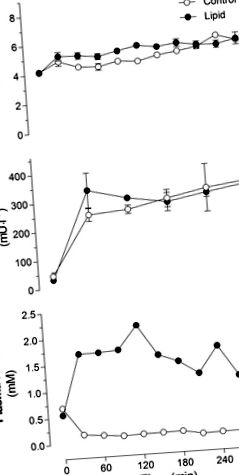
1. ábra.Vércukorszint (A), plazma inzulin (B) és a plazmában nem észterezett zsírsavak (NEFA; C) lipiddel vagy glicerinnel (kontroll) 5 órán át infúzióban adott patkányokban. Az értékek átlag ± SE (n = Csoportonként 10–12 patkány).
Glükóz metabolizmus és inzulin érzékenység
Az egész test glükóz metabolizmusa.
Az euglikémia fenntartásához szükséges GIR stabil volt a kontrollcsoport 5 órás infúziója során (5. ábra). 2A). A lipidekkel infúzióban kezelt csoportban a GIR az első 2 órában stabil volt, de 3, 4 és 5 óra után jelentősen csökkent, összehasonlítva az 1 órás lipid infúzióval (2. ábraA). Az infúzió hossza nem volt szignifikáns hatással az egész test glükóz eltűnésére a kontroll vagy a lipidekkel infúziós csoportban (2. ábraB). Nem volt szignifikáns hatás az Rd-re a kontroll és a lipidekkel infúziós állatok között. A máj glükóz kibocsátása a kontroll csoportban továbbra is elnyomott volt (-0,34 ± 2,24 és 0,97 ± 0,89 mg · min -1 -1 kg -1 3, illetve 5 órakor a kontrollcsoportban). Az 5 órás lipiddel infúzióban kezelt csoportban azonban erős tendencia mutatkozott a máj glükóztermelésének növekedésében az 5 órás kontrollinfúzióval kezelt csoporthoz képest (4,75 ± 0,24 és 10,79 ± 4,12 mg · perc -1 -1 kg -1 3, illetve 5 órakor a lipiddel infúziós csoportban, P = 0,07).
2. ábra.A lipid infúzió hatása az egész test inzulinérzékenységi indexeire. A: glükóz infúziós sebesség (GIR), amely az euglikémia fenntartásához szükséges lipiddel vagy glicerinnel és inzulinnal infundált patkányoknál 5 órán át. *P
Vázizom inzulinérzékenység és glükóz anyagcsere.
Az inzulin képessége a glükózfelvétel stimulálására a kontroll állatok izomában hasonló volt 3 és 5 órás infúzió után (2. ábraC). A glükózfelvétel RQ-ban 5 óra elteltével szignifikánsan csökkent, összehasonlítva a 3 órás lipid infúzióval (31%, P = 0,008; 2. ábraC). A kevert rostú tibialis cranialis és a fehér quadriceps esetében szintén szignifikánsan csökkent a glükózfelvétel 5 óra elteltével, összehasonlítva a 3 órás lipidinfúzióval [33% (P = 0,005) és 37% (P = 0,04), ill. adatok nem láthatók]. A glükózfelvétel csökkenésével összhangban az RQ izmok glikogénszintézisének in vivo sebessége szignifikánsan csökkent az 5 órás lipiddel infúziós csoportban a 3 órás lipiddel infúziós csoporthoz képest (38%, P = 0,02; 2. ábraD). A glikogénszintézis sebességének ez a csökkenése nem volt összefüggésben a glikogéntartalommal, amely hasonló volt a kontrollcsoport glikogéntartalmához (2. ábraE).
Vázizom inzulin jelátvitel.
Annak eldöntésére, hogy az inzulinjelzés változásai kísérték-e az inzulinrezisztencia kialakulását az RQ-ban, megvizsgáltuk az inzulin-jelátviteli út számos kulcsfontosságú komponensének aktivációs állapotát, amely szerepet játszik a glükóz metabolizmusában. Az inzulinreceptor foszforilezése (Tyr 1162/1163; 3. ábraA) növekedett, és továbbra is magas maradt a kontroll és a lipidekkel infúziós állatokban. Ezenkívül az IRS-1 (Tyr 612) foszforilációja szignifikánsan megnövekedett és tartós volt a kontroll és a lipidekkel infúziós állatokban (3. ábraB). Az Akt foszforilezése (Ser 473; 3. ábraC) és a glükóz metabolizmusában részt vevő downstream célpontjai, AS160 (Thr 642; 3. ábraD), GSK3β (Ser 21; 3. ábraE) és GSK3a (Ser 9; 3. ábraF), hosszan tartó kontroll és lipid infúzióval megnövekedett és fenntartva volt. Ezen jelátviteli komponensek teljes fehérje-expressziójában nem történt változás. A denzitometriás mérések nem mutattak szignifikáns csökkenést a foszforilációs állapotban a legtöbb közbenső termék esetében a kontroll és a lipiddel infúziós állatok között 3 vagy 5 órán belül, annak ellenére, hogy a lipid infúzió ezen időszakában jelentősen csökkent a glükózfelvétel (2. ábra).C).
3. ábra.A lipidinfúzió hatása a vázizom inzulinszignál közbenső termékeire, a foszforilált (p) és az összes (t) köztitermék arányában kifejezve. A: inzulinreceptor (IR) aktiváció (Tyr 1162/63). B: inzulinreceptor 1. szubsztrát (IRS-1) aktiválása (Tyr 612). C: Akt (Ser 473). D: AS160 (Thr 642). E: glikogénszintáz kináz (GSK) -3β (Ser 21). F: GSK3a (Ser 9). Az intermediereket piros quadricepszben mértük bazális állapotban, valamint 3 és 5 óra glicerin vagy lipid infúzió után hiperinsulinémia jelenlétében. Az értékek átlag ± SE (n = Csoportonként 5–7 patkány). *P
Vázizom gyulladásos jelátvitel.
A gyulladásos jelátvitelt olyan mechanizmusként javasolták, amely károsíthatja az inzulinjelet (47). Nem változott az IKKα teljes fehérjetartalma, amelyet az IKK-NF-κB jelátviteli aktiváció helyettesítő markerjeként használtunk a lipiddel infúzióban vagy a kontroll csoportban (4. ábraA). A JNK foszforilációja szintén nem változott tartós kontroll vagy lipid infúzióval (4. ábraB). A gyulladásos jelátvitel változásainak hiánya összhangban áll az inzulinjelzés változásainak hiányával ebben a hiperinsulinémia és hiperlipidémia modellben.
4. ábra.A lipid infúzió hatása a vázizom gyulladásos jelátvitelére. Az IκBα-t és a JNK-t (Thr 183/Tyr 185) kontroll és lipidekkel infúzióban lévő állatok vörös quadricepszében mértük inzulin jelenlétében.
Vázizom lipidtartalma.
5 órás lipid infúzió után szignifikánsan növekedett a triglicerid tartalom, összehasonlítva 3 órás lipid infúzióval és 5 óra kontroll infúzióval (P
5. ábra.A lipid infúzió hatása a vázizom lipid intermedierjeire: triglicerid (A), diacilglicerid (B), ceramid (C) és hosszú láncú acil-CoA (LCACoA, D) tartalma és a felhalmozott expozíció (betétek). A lipid-köztitermékeket kontroll és lipidekkel infúzióban lévő állatok vörös quadricepszében mértük inzulin jelenlétében. Az értékek átlag ± SE (n = Csoportonként 5–7 patkány). #P
Az inzulin gyorsan elnyomta az LCACoA-tartalmat a kontroll és a lipidekkel infúziós csoportokban, és a kontroll infúzió időtartama alatt elnyomott maradt (5. ábraD). Az LCACoA tartalom azonban 3 órás lipid infúzió után növekedési tendenciát mutatott a kontroll infúzióhoz képest. Az infúzió során felhalmozódott LCACoA expozíció (a görbe alatti területként mérve) lipid infúzióval 70% -kal nőtt a kontroll infúzióhoz képest (5. ábraD, betét). Az LCACoA-król azt javasolják, hogy gátolják a hexokináz (HK) aktivitását, és ezáltal befolyásolják a glükózfelvételt (46). A HK-aktivitás közvetett markereként 5% lipidinfúzió után 34% -kal csökkent a [3H] 2DG-6-foszfát és a [3H] 2DG aránya a kontroll csoporthoz képest (5,70 ± 1,55 vs. 3,77 ± 0,84). Ez egy potenciális mechanizmus, amely révén a glükózfelvétel és a glikogénszintézis sebessége csökkent a lipiddel infúzióban lévő állatokban (2. ábra, C és D), inzulinjelzési hibától függetlenül (3. ábra).
PDK-tartalom és PDHC-aktivitás.
A PDHC szabályozza a glükóz szénatomok belépését a mitokondriális trikarbonsav (TCA) ciklusba a teljes CO2-oxidáció érdekében. A PDH aktivitását a PDK szabályozza, amely foszforilálja a PDH-t, hogy gátolja annak aktivitását. 3 óra kontroll vagy lipid infúzió után a PDK4 fehérjetartalma szignifikánsan csökkent az alapszinthez képest (2,07 ± 0,23 tetszőleges egység) [42% (P = 0,01) és 30% (P = 0,04), ill. 6. ábraA]. 5 óra kontrollinfúzió után a PDK4 tovább csökkent (28%, P = 0,04). A PDK4 azonban 5 órás lipid infúzió után változatlan volt, és ebben az időpontban szignifikánsan magasabb volt, mint az 5 órás kontroll infúzió (59%, P = 0,01; 6. ábraA). Ez azt jelzi, hogy a lipid infúzió csökkentheti az inzulin képességét a PDK4 fehérje csökkentésére.
6. ábra.A lipid infúzió hatása a vázizom piruvát-dehidrogenáz kináz (PDK4) tartalmára (A) és a piruvát-dehidrogenáz komplex (PDHC) aktivitása (B). Az aktivitásokat bazális állapotban, valamint 3 és 5 óra glicerin vagy lipid infúzió után mértük hiperinsulinémia jelenlétében vörös quadricepszben. Az értékek átlag ± SE (n = Csoportonként 5–7 patkány). *P
Annak megállapítására, hogy a PDK4 fehérjetartalom változásai megváltoztatták-e a downstream célpont aktivitását, PDHC aktivitást vizsgáltunk. A PDHC aktivitás megnőtt a bazális szinthez képest 3 és 5 óra kontrollinfúzió után [1,2-szeres (P = 0,02) és 1,7-szeres (P = 0,005); 6. ábraB]. 5 órás lipid infúzió után a PDHC aktivitás csökkent (43%, P = 0,02) összehasonlítva 5 órás kontroll infúzióval, amely összhangban volt a PDK4 fehérje magasabb szintjével.
Ebben a tanulmányban azt vizsgáltuk, hogy a lipid túlkínálata magas inzulin jelenlétében vázizom inzulinrezisztenciát eredményezett-e az inzulinjelző hiba miatt. A vázizom inzulinrezisztenciája ellenére nem tapasztaltuk az inzulinszignál kaszkád köztitermékeinek fehérjefoszforilációjának csökkenését, ideértve az IRS-1 inzulinreceptort, az Akt-ot és az AS160 és GSK3a/β inzulinreceptorokat. Az inzulinrezisztencia ebben a hiperlipidémia és hiperinsulinémia modellben potenciálisan a PDHC aktivitás változásainak tudható be, a megváltozott PDK4 tartalom és az emelkedett LCACoA elhúzódó expozíciója következtében. Eredményeink összességében azt sugallják, hogy a metabolikus visszacsatolás az inzulinjelzés jelentős változásai helyett közvetítheti az inzulinrezisztencia kialakulását ebben a modellben.
Az a pontos mechanizmus, amely a megnövekedett LCACoA-tartalmat és a csökkent PDHC-aktivitást a csökkent glükózfelvételhez köti, továbbra sem oldható meg teljesen. A jelen tanulmányban alkalmazott modell megfigyelései alapján feltételezhető, hogy a csökkent PDHC-aktivitás csökkentett fluxust eredményezne a glükóz metabolizmus oxidatív útján keresztül. Ez a kulcsfontosságú glikolitikus enzimek alloszterikus szabályozását eredményezheti köztitermékekkel, beleértve a glükóz-6-foszfáttal történő HK-t, valamint az LCACoA-t. A HK aktivitásnak ez a lehetséges csökkentése csökkent glükózfelvételhez vezet, amint azt korábban már javasolták, amikor a sebességkorlátozó lépés a glükóz transzportról a glükóz foszforilezésre vált át (13–15, 26).
Összességében a jelen tanulmány eredményei, amelyek a metabolikus visszacsatolás szerepére utalnak, kiegészítik az előző glükózinfúziós vizsgálatunkban közölt eredményeket (22). A glükóz infúzióval létrehozott inzulinrezisztencia nem társult a kulcsfontosságú inzulinjelző köztitermékek foszforilációs állapotának hibáival. Ezenkívül az inzulinrezisztencia a glükóz infúziós modellben a glikogén szintézis útján keresztül csökkent fluxussal, valamint a glükóz 6-foszfát tartalom csökkenésével járt. Ezért javasoltuk a metabolikus visszacsatolás szerepét, amelynek eredményeként a sebességkorlátozó lépés elmozdult a glükóztranszporttól a glükózfoszforilációig, megelőzve a glükóztranszportban részt vevő inzulin-szignál közbenső termékek változását. Összességében jelenlegi és korábbi vizsgálataink (glükóz infúzió) azt sugallják, hogy az anyagcsere-visszacsatolás lehet egy kezdeti védőmechanizmus, amely korlátozza a glükóz felvételét a vázizmokba a tápanyagok túlkínálatának megakadályozása érdekében.
Összefoglalva, a jelen tanulmány arról számol be, hogy a vázizmok inzulinrezisztenciájának lipid- és inzulininfúzióval történő megjelenése nem járt az inzulin-jelátviteli út több csomópontjának aktiválódásának hibáival. Azonban a hiperlipidémiás és hiperinsulinémiás patkányokban az izom glükóz metabolizmusának csökkenése összefüggésben állt a metabolitok (LCACoA) és egy fontos szabályozó fehérje (PDK4) változásával.
Ezt a tanulmányt az ausztrál Nemzeti Egészségügyi és Orvosi Kutatási Tanács (NHMRC), valamint a DK-067509 Nemzeti Diabétesz- és emésztőrendszeri és vesebetegségek Intézetének támogatásai finanszírozták. A. J. Hoy-t az Új-Dél-Wales-i Egyetem ausztrál posztgraduális díja támogatja. N. Turnert és M. J. Wattot az ausztrál NHMRC karrierfejlesztési díjai támogatják. C. R. Bruce-t az NHMRC, Peter Doherty posztdoktori ösztöndíj 325645 támogatja. G. J. Cooney-t és E. W. Kraegen-t az ausztrál NHMRC kutatási ösztöndíjas rendszer támogatja.
Köszönjük Emma Polkinghorne és Susan Beale technikai segítségét, Dr. Bronwyn Hegarty, Kyle Hoehn és Neil Ruderman a hasznos beszélgetésért, valamint a Garvan Intézet biológiai vizsgálati létesítménye az állatok gondozásában nyújtott segítségért.
- Az inzulinrezisztencia és a súlycsökkenés antagolin hatással van Health24
- Inzulinrezisztencia, diszlipidémia és szív- és érrendszeri betegségek cukorbetegségének ellátása
- Az obstruktív alvási apnoe időszakos hypoxiaja közvetíti az inzulinrezisztenciát a zsírszöveten keresztül
- Hosszú távú metformin-kezelés elhízással és inzulinrezisztenciával küzdő serdülőknél
- Hogyan szabotálja a stressz az izomépítést és a fogyás céljait