A lipid lerakódási mintája és alkalmazkodási stratégiája az étkezési zsírra reagálva a kínai sügérben (Siniperca chuatsi)
Absztrakt
Háttér
Korábbi, teleost-tanulmányok igazolták az adaptív stratégiát a máj lipid homeosztázisának bizonyos határokon belüli fenntartására. A túlzott zsírbevitel kóros lipidlerakódást idézhet elő a májban, de a zsírszövetben nem. Azonban a károsodott lipid homeosztázis és a májban fokozott lipidlerakódás közötti molekuláris mechanizmus még nem tisztázott jól a halaknál.
Mód
Négy különböző zsírtartalmú (2, 7, 12 és 17%) izonitrogén étrendet állítottak össze, amelyek L2, L7, L12 és L17 nevet kaptak, és kínai sügérrel (44,50 ± 0,25 g) táplálták a látszólagos jóllakottságot öt hétig. Mértük a növekedési indexet, a triglicerid koncentrációkat és a lipid metabolizmusban szerepet játszó gének expresszióját.
Eredmények
A maximális növekedési teljesítményt és a táplálékfelvételt az L12 csoportban figyeltük meg. A máj és a szérum lipidtartalma összehasonlítható volt az L2, L7 és L12 csoportokban, míg az L17 csoportban szignifikánsan növekedett. A szövettani elemzés azt is kimutatta, hogy a májsejtekben tömeges lipidcseppek jelentek meg, majd az L17 csoportban májsteatózist indukáltak. Az L2 csoporthoz képest a zsírsavak (FA) transzportjához kapcsolódó lipolitikus gének (lpl & hl) és FA-k β-oxidációja (cpt1 & cs) növekedtek az L7 és L12 csoportban. A glükoneogenezis relatív mRNS-szintje (pc, pepck & g6pase) szintén növekedett, ezzel szemben a lipogén gének (srebp1, accα & fas) csökkentek. Az L12 csoporthoz képest az L17 csoport magasabb mRNS-szinttel rendelkezett a FA-k transzportjában és a lipogenezisben. De az FA-k β-oxidációjával kapcsolatos lipolitikus gének stabilak voltak, és a glükoneogenezis mRNS-szintje helyette csökkent.
Következtetések
Bizonyos határokon belül az étkezési zsír növekedése az L7 és L12 csoportban proporcionális volt a fehérjefogyasztás csökkentése és a kínai sügér növekedési teljesítményének javítása érdekében. Ennek oka a máj triglicerid (TG) pool és a szérum glükóz homeosztázisa volt, az FA-k β-oxidációjának és a glükoneogenezisének elősegítésével. Mind a lipogenezis növekedése, mind az FA-k β-oxidációjának hiánya az L17 csoportban kiválthatja az FA-k észterezését, sőt, a glükoneogenezis gátlása súlyosbíthatja a triglicerid májban történő felhalmozódását és máj steatózist is kiválthat.
Háttér
Az étkezési zsír magas energiát és esszenciális zsírsavat (EFA) biztosíthatna a gyors tenyésztési sebesség és a fiziológiai lipidigény kielégítésére a legtöbb tenyésztett halban [1,2,3,4,5]. Bizonyos határokon belül az étkezési zsírszint növekedése javíthatja a takarmány felhasználását [6], és valahogy védelmet nyújthat a fehérje energiaként történő metabolizmusa ellen [7, 8], különösen a húsevő halfajoknál. A magas zsírtartalmú étrend azonban fokozott zsírlerakódást eredményezett a hal testében, metabolikus rendellenességeket váltott ki, beleértve a zsírmáj szindrómát [9], a rendellenes oxidatív státuszt [10], valamint megváltozott tápértéket, érzékszervi és fizikai tulajdonságokat [6]. Számos kutatási eredmény rávilágított arra, hogy az étrendi zsírszint változását gondosan értékelni kell, mivel ez befolyásolhatja a lipid anyagcsere stratégiákat és a lipid lerakódási mintázatot.
Bár a különféle halfajok különböző toleranciát mutatnak az exogén zsírbevitel tekintetében, a természetes szelekció felajánlja a halaknak azt a képességét, hogy lipideket tároljanak a különböző szervekben, ha az étkezési zsír bőséges, másrészt felgyorsítja a lipidek mobilizálódását az energia biztosítása érdekében. Általában az étkezési zsírbevitel növekedésével a hal testének lipidtartalma is fokozatosan növekedett [6, 16, 18,19,20,21]. Érdekes módon a zsírok lerakódásának elsődleges helye a fajok fajspecifikus volt. Számos halfaj elsősorban a mesenteriumban és a zsigerekben tárolt lipidet (főleg TG-t), például amur (Ctenopharyngodon idella) [10, 11, 14, 17] és a Nílus-tilápia (Oreochromis niloticus) [12], míg az atlanti lazac (Salmo salar) a lipidet inkább az izmokban szeretné tárolni, de nem a májban [13]. A szelektív stratégia hozzájárulhat a májban található zsírlerakódások kockázatának csökkentéséhez. Ezenkívül a máj lipid homeosztázisa függhet a máj mitokondriális és peroxiszomális oxidációs képességeitől. Mivel a máj mitokondriális oxidációjának aktiválása felgyorsíthatja a szabad zsírsavak (FFA) lebontását a karnitin-palmitoil-transzferáz I (CPT1) útján, majd felszabadíthatja az adenozin-trifoszfátot (ATP), hogy energiát biztosítson a trikarbonsav (TCA) cikluson keresztül [22].
Mód
Etikai jóváhagyás
Minden kísérleti eljárás követte az állatprotokollra vonatkozó útmutatásokat, és a Huazhong Mezőgazdasági Egyetem (Wuhan, Kína) hagyta jóvá.
Állatok és etetés
A kínai sügéreket a Wuhu mezőgazdasági fejlesztő cégtől szerezték be, és a Huazhong Mezőgazdasági Egyetem (Wuhan, Kína) halházában tenyésztették. A kísérlet előtt az összes hal elfogadja a mesterséges étrendet az akklimatizáció után [34]. Négy étrendet készítettünk különböző gradiens lipiddel (2, 7, 12 és 17%), és L2, L7, L12 és L17 csoportként kódoltuk (1. táblázat). Az összes étrendi összetevőt a Gaolong Feed Technology Co., Ltd.-től (Wuhan, Kína) vásároltuk. Ezután kiválasztottuk az összes 144 halat, és véletlenszerűen 12 tartályba (350 liter) rendeztük, állandó szűrt víz áramlásával. Az állománysűrűség tartályonként 12 hal (44,50 ± 0,25 g hal - 1) volt, és mindegyik étrendet háromszorosítottuk. A tenyésztés ideje alatt az összes halat naponta kétszer, 8.30 és 17.30 órakor etették meg látszólagos jóllakottság érdekében. A víz hőmérsékletét 24 ± 2 ° C-on tartottuk, és a vizet hetente kétszer cseréltük keringető vízrendszerrel.
Mintagyűjtés és kémiai elemzések
Öt hetes etetési kísérlet után az összes halat 24 órán át éheztettük, és MS-222-vel (Argent Chemical Laboratories, Redmond, WA, USA) eutanizáltuk, majd megmértük és megszámoltuk. Minden kezeléshez hat halat véletlenszerűen fogtak be és fagyasztóban -20 ° C-on tároltak, amíg fel nem használták az egész test kémiai elemzésére. Vért vettünk minden csoport hat halának farokvénájából, és éjszakán át 4 ° C-on tároltuk, majd centrifugáltuk (2500 g, 20 perc) szérummintákhoz. A szérum mintákat az elemzésig -80 ° C-on fagyasztották. A lipidtartalom kimutatására szolgáló szövetmintákat, például a májat, a mesenteriumot és a zsigeri zsírokat, mindegyik kezelés során hat halból boncoltuk, majd -20 ° C-on tároltuk. A máj szomatikus indexét (HSI), a mesentery fat indexet (MFI) és a zsigeri szomatikus indexét (VSI) az anatómia után azonnal kiszámítottuk [HSI = a máj súlya/testtömeg (%), VSI = a zsigeri zsírszövet súlya/testtömeg (%) és MFI = a mesenterialis zsír súlya/testtömeg (%)]. Kezelésenként további hat halat választottunk véletlenszerűen molekuláris kísérletekhez, és a májszövetet (0,5 g) a gének expressziós vizsgálatához gyorsan lefagyasztottuk folyékony nitrogénben, majd - 80 ° C-on tároltuk az RNS izolálásához és az azt követő elemzéshez.
A kémiai elemzéseket, beleértve az étrendi és a teljes test összetételének elemzését, standard módszerekkel határoztuk meg [35]. A nedvességet 105 ° C-on 6 órán át végzett szárítással elemeztük. A nyersfehérje (N × 6,25) meghatározását Kjeltec rendszer alkalmazásával végeztük savas emésztés után (K8400 Kjeltec Analyzer, Fossana Lyticab, Svédország). A nyers lipidet az éteres extrakcióval mértük Soxtec System HT-vel (SE-A6, Alvah, Kína). A hamut muffenkemencével (SX2–4–10, Zhengda Electric Technology Co., Ltd., Kína) égve határoztuk meg 550 ° C-on 12 órán át.
A biokémiai elemzések a GLU (glükóz), TC (összkoleszterin), TG (teljes triglicerid), HDL (nagy sűrűségű lipoprotein), LDL (alacsony sűrűségű lipoprotein) és LDT (alacsony sűrűségű lipoprotein) és AST (aszpartát-aminotranszferáz) kimutatására összpontosultak. . Mindezeket az indexeket automatikus biokémiai analizátorral [Abbott Aeroset Analyzer (Abbott Laboratories, USA)] határoztuk meg a Zhongnan Kórházban (Wuhan, Kína).
Szövettani elemzés és reagensek
Minden csoport három halából származó májszöveteket összegyűjtöttük és azonnal rögzítettük 4% semleges pufferolt formaldehid alkalmazásával 4 napig. Dehidratálva és paraffinba ágyazva egy szöveti részt 5 μm-re vágunk a hematoxilin és az eozin (H&E) festésére (katalógusszám: G1005–100; Servicebio Biotech Technology Co., Ltd., Wuhan, Kína). A fagyasztott szakasz és az olajvörös O festés céljából a májmintákat folyékony nitrogénnel azonnal lefagyasztották és -80 ° C-on tárolták. A sorozatfagyasztott szakaszokat 8 μm-re vágtuk olaj-vörös O festés céljából. A megszárított tárgylemezeket egy vagy két alkalommal 70% -os alkoholba mártva mossuk, majd nedvszívó felületre helyezzük és olajvörös O oldattal fedjük le (Katalógusszám: G1016; Servicebio Biotech Technology Co., Ltd., Wuhan (Kína) 5 percig. A májszakaszokat 40x-es nagyítással néztük meg. Minden csoportból három tárgylemezt vontunk be a kvantifikációba, és 5 mezőt véletlenszerűen választottunk ki minden egyes dián. Az egyes mezők esetében a H&E megfigyelés során a sejtmagok számát és az olajvörös O megfigyelésben a lipidcseppek relatív területét az Image J szoftver (National Institutes of Health) számszerűsítette az előző jelentéseket követően [36, 37]. A máj, a zsigeri zsírszövet és az izomzat TG-tartalmát a Triglycerides Assay Kit (katalógusszám: F001; Jiancheng Bioengineering Institute, Nanjing, Kína) gyártója végezte.
RNS izolálás és reverz transzkripció
Az RNS izolálása előtt a májszöveteket kivették a - 80 ° C-os hűtőszekrényből, és a jégen lefagyasztották őket. A májszövetek lízispufferként Trizol-reagenst (kódszám: 9108; TaKaRa, Japán) használtunk, 1 ml-t és 0,1 g májmintát adtunk hozzá. A gyártási utasítás követi, hogy az RNS-t a lizátum felülúszó fenol/kloroform extrakciójával, majd etanolos kicsapásával tisztítjuk. A kivont RNS-t 50–100 μL RNáz-mentes vízben oldjuk (kódszám: 9750; TaKaRa, Japán). Az RNS integritását agarózgél-elektroforézissel vizsgáltuk. Az RNS-minták koncentrációját BioTek Synergy ™ 2 többdetektáló mikrotiterlemez-olvasóval (BioTek Instruments, USA) számszerűsítettük. Ezután 1 μg teljes RNS-t használtunk a reverz transzkripcióhoz HiScript® II reverz transzkriptázzal (kódszám: R201–01/02; Vazyme, Kína) 20 μL reakciótérfogatban. A szintetizált cDNS-t további felhasználásig -20 ° C-on tároltuk.
Valós idejű qPCR elemzés
Statisztikai analízis
A statisztikai elemzéseket az SPSS 19.0 szoftverrel végeztük. Az összes adat szórásának normalitását és homogenitását Shapiro-Wilk és Levene teszttel értékeltük. Az átlagkülönbségeket Duncan több tartományú tesztjeivel tesztelték egyirányú varianciaanalízissel (ANOVA), a statisztikai szignifikanciát 5% -osnak tekintették.
Eredmények
Növekedési teljesítmény és takarmány-felhasználás
Öt hetes etetési kísérlet után a takarmány-felhasználást és a növekedési teljesítményt a 3. táblázatban mutatjuk be. L2-től L12-ig az élelmiszer-bevitel (FI) nem mutatott szignifikáns különbséget, de a végső tömeg (FW), súlygyarapodás (WG), specifikus a növekedési arány (SGR) és a fehérje-visszatartás (PR) fokozatosan emelkedett. Az összes fenti index jelentősen csökkent az L17 csoportban az L12 csoporthoz képest.
Az étrendi zsírszint hatása a lipid lerakódási helyekre
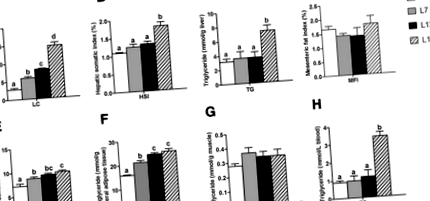
A hal testének lipidtartalma (LC) fokozatosan emelkedett, a megnövekedett étkezési zsír 2% -ról 17% -ra emelkedett (1a. Ábra). Az MFI és az izom TG-tartalma nem mutatott különbséget a négy csoport között (1d. És g. Ábra). Az L2 csoporthoz képest a viscerális zsírszövetben a VSI és a TG tartalom jelentősen megnőtt mind az L7, mind az L12 csoportban (1e, f ábra). A HSI és a máj és a szérum TG-tartalma nem mutatott különbséget az L2, L7 és L12 csoport között (1b., C. És h. Ábra). Az L12 csoporthoz képest a máj és a szérum HSI és TG tartalma szignifikánsan megemelkedett az L17 csoportban, de a viscerális zsírszövet VSI és TG tartalma stabil volt.
Az étrendi zsírszint hatása a szérumindexekre
A szérum TC, HDL, LDL és GLU koncentrációit a 4. táblázatban mutatjuk be. A szérum glükózkoncentráció fokozatosan emelkedett az L2 csoportról az L12 csoportra, de az L17 csoportban meredeken csökkent. A szérum TC, LDL és HDL jelentősen megnőtt az L17 csoportban a többi csoporthoz képest.
Az étrendi zsírszint hatása a májszövet szakaszára
A túlzott zsírbevitel általában korrelált a méhen kívüli TG lerakódással. Annak megvizsgálására, hogy a magas zsírtartalmú étrend okozhat-e máj steatózist a kínai sügéren, olaj-vörös O festést és H & E festést végeztünk a májszakaszokon (2. ábra). Az olaj-vörös O festés megerősítette, hogy a vörös pontok (lipidcseppek) száma nem mutatott nyilvánvaló különbséget az L2, L7 és L12 csoport között, de az L17 csoportban meredeken nőtt (2a. Ábra). Valójában a H&E festés azt mutatta, hogy a májsejtek az L2 csoportról az L12 csoportra fokozatosan megjelentek kis vakuolokban, de az L17 csoportban a vakuola hirtelen megnagyobbodott, majd a sejtmagokat a széléig szorította (2b. Ábra). Ezeket az eredményeket tovább erősítette az olaj-vörös O festés lipidcseppjeinek számszerűsített területe és a H&E festés sejtmagjainak száma. A lipidcseppek relatív területe az L17 csoportban szignifikánsan nagyobb volt, mint más csoportok, másrészt a sejtmagok száma csak az L17 csoportban süllyedt le (2c. Ábra, d). Ez azt jelenti, hogy a májsejtek kóros reakcióban szenvedtek, amelyet TG infiltráció indukált. Ezenkívül a vér AST enzimatikus aktivitása, a májkárosodás előidézője, az L17 csoportban szignifikánsan megemelkedett más csoportokhoz képest (2e. Ábra).
A glükóz és a lipid anyagcsere gének expressziója a májban
Vita
A lipid anyagcsere-stratégia javasolt modellje a kínai sügérben a megfelelő zsírbevitelre reagálva. Az L7 és L12 7 és 12% lipidtartalmú étrendet jelent, ami a lipidszint optimális tartománya volt a hal növekedésének és felhasználásának a jelen tanulmányban. A májban a megnövekedett FFA-felvétel kiválthatja az FA-k β-oxidációját, majd gátolhatja a lipogenezist a TG-medence stabilizálásának fenntartása érdekében. Az FA-k β-oxidációjából származó acetil-CoA részt vehet a TCA energiaellátási ciklusában. Az étrendi TG hidrolíziséből származó szubsztrát-glicerin részt vesz a glükoneogenezisben, majd megakadályozza a TG felhalmozódását a májban. Ebben a modellben a máj TG pool és a szérum glükóz homeosztázisa az FA-k β-oxidációjának és a glükoneogenezisnek az együttműködésén keresztül történt.
Ezenkívül észrevették, hogy a kínai sügér egész testének lipidtartalma fokozatosan emelkedett az L2-ről az L12-csoportra, de a máj és az izomzat TG-tartalma stabil volt, másrészt mind a zsigeri zsírszövet, mind a zsigeri zsírszövet TG-tartalma. a VSI jelentősen megnőtt. Az étkezési zsír (elsősorban a TG) megemésztődik és felszívódik a belekben, majd hasnyálmirigy-lipázokkal hidrolizálódik a bél lumenében, végül FFA-kká alakul. Az FFA-kat a lipoproteinek lipáza szállította a vérben, és észterezés céljából felszívódott a májba vagy a zsírszövetbe [50, 51]. Ebben a tanulmányban felvetették, hogy a zsigeri zsírszövet elsődleges hely lehet az egész test lipid-lerakódásának az L7 és L12 csoportban. Hasonló eredményeket jelentettek a korábbi vizsgálatok is [4, 10, 12, 14, 16, 17]. Felvetődött továbbá, hogy a máj lipid homeosztázisa részben annak köszönhető, hogy a zsigeri zsírszövet részt vett a TG tárolásában is.
Javasolt modell a máj TG lerakódására a kínai sügérekben, válaszolva a magas zsírtartalmú bevitelre. Az L17 olyan étrendeket jelent, amelyek 17% lipidtartalmat tartalmaznak, ami a májban nem hasznos a máj lipidjeinek felhasználása és metabolizmusa szempontjából. A májban az étkezési zsírfelesleg felgyorsíthatja az FFA észterezését FA-β-oxidáció hiányában. Valójában az FFA-k extra felvétele biztosíthatja az Acyl-CoA tömeges szubsztrátumát a lipogenezishez a srebp1. Az élesen megnövekedett lipogenezis hatékonyan gátolhatja a glükoneogenezist és súlyosbíthatja a TG lerakódását a májban, bár az újonnan szintetizált TG egy részét a vér VLDL-jén keresztül juttatták a perifériás szövetekbe
Következtetés
Összegzésképpen elmondható, hogy az étkezési zsírbevitel növekedésével az L7 és az L12 csoportban a triglicerid hidrolízisből származó FFA-k és glicerin extra felvétele felgyorsítja az FA-k β-oxidációját, illetve a glükoneogenezist. Az FA-k β-oxidációjának negatív szabályozása hatékonyan csökkentheti a lipogenezist, majd leállíthatja az FFA-k észterezését. Ezek az eljárások kritikus fontosságúak voltak a máj TG-készletének és a szérum glükóz homeosztázisának fenntartásához, sőt, javítják a növekedési teljesítményt és csökkentik az étkezési fehérje fogyasztását. A magas zsírtartalmú étrend az L17 csoportban azonban könnyen károsíthatja a máj lipid homeosztázisát és lipid metabolikus rendellenességet idézhet elő, amelyet a lipolízis hiánya és a lipogenezis súlyosbodása okoz. Ezenkívül a glükoneogenezis gátlása súlyosbíthatja a TG lerakódását a májban, majd kiválthatja a máj steatosisát. A májkárosodás és a szérum glükóz csökkenése egyaránt ronthatja a kínai sügér normális fiziológiai állapotát és lassíthatja a növekedési sebességet. Összességében tanulmányunk feltárta a károsodott lipid homeosztázis és a májban fokozott lipidlerakódás közötti fő indukciót, és következményekkel járhat a zsírmáj szindróma vizsgálatában teleost halakban.
- A mediterrán stílusú étrend javítja a rák okozta fáradtságot és az életminőséget a férfiaknál
- Liu Wen, Fei Fei Sun és még több kínai modell a szülővárosi szépségápolási hagyományok divatjáról
- A Toxocara körteférgek elleni immunválasz segít megmagyarázni a betegséget - ScienceDaily
- Az immunterápia új stratégiát kínál a Sarkoma Memorial Sloan Kettering Rákközpont kezelésére
- Hogyan kell enni a hagyományos kínai orvoslás szerint; Keleti akupunktúra és wellness ültetvény,