A lipoprotein lipáz HinA dIII polimorfizmus modulálja a plazma triglicerid szintjét a zsigeri elhízásban
A Lipid Kutatóközpontból, a CHUL Kutatóközpontból (M.-CV, BL, SM, P.-JL, J.-PD), a Fizikai Aktivitástudományi Laboratóriumból (DP, CB) és a Diabetes Kutatóegységből, a CHUL Kutatóközpontból (AN), Laval Egyetem, Ste-Foy, Québec.
A Lipid Kutatóközpontból, a CHUL Kutatóközpontból (M.-CV, BL, SM, P.-JL, J.-PD), a Fizikai Aktivitástudományi Laboratóriumból (DP, CB) és a Diabétesz Kutatóegységből, a CHUL Kutatóközpontból (AN), Laval Egyetem, Ste-Foy, Québec.
A Lipid Kutatóközpontból, a CHUL Kutatóközpontból (M.-CV, BL, SM, P.-JL, J.-PD), a Fizikai Aktivitástudományi Laboratóriumból (DP, CB) és a Diabetes Kutatóegységből, a CHUL Kutatóközpontból (AN), Laval Egyetem, Ste-Foy, Québec.
A Lipid Kutatóközpontból, a CHUL Kutatóközpontból (M.-CV, BL, SM, P.-JL, J.-PD), a Fizikai Aktivitástudományi Laboratóriumból (DP, CB) és a Diabétesz Kutatóegységből, a CHUL Kutatóközpontból (AN), Laval Egyetem, Ste-Foy, Québec.
A Lipid Kutatóközpontból, a CHUL Kutatóközpontból (M.-CV, BL, SM, P.-JL, J.-PD), a Fizikai Aktivitástudományi Laboratóriumból (DP, CB) és a Diabétesz Kutatóegységből, a CHUL Kutatóközpontból (AN), Laval Egyetem, Ste-Foy, Québec.
A Lipid Kutatóközpontból, a CHUL Kutatóközpontból (M.-CV, BL, SM, P.-JL, J.-PD), a Fizikai Aktivitástudományi Laboratóriumból (DP, CB) és a Diabétesz Kutatóegységből, a CHUL Kutatóközpontból (AN), Laval Egyetem, Ste-Foy, Québec.
A Lipid Kutatóközpontból, a CHUL Kutatóközpontból (M.-CV, BL, SM, P.-JL, J.-PD), a Fizikai Aktivitástudományi Laboratóriumból (DP, CB) és a Diabétesz Kutatóegységből, a CHUL Kutatóközpontból (AN), Laval Egyetem, Ste-Foy, Québec.
A Lipid Kutatóközpontból, a CHUL Kutatóközpontból (M.-CV, BL, SM, P.-JL, J.-PD), a Fizikai Aktivitástudományi Laboratóriumból (DP, CB) és a Diabétesz Kutatóegységből, a CHUL Kutatóközpontból (AN), Laval Egyetem, Ste-Foy, Québec.
Absztrakt
A lipoprotein lipáz (LPL) fontos enzim a trigliceridekben gazdag lipoproteinek hidrolízisében, és aktivitása pozitívan korrelál a plazma HDL koleszterin szintjével. LPL gén HinA dIII polimorfizmust hipertrigliceridémiával, 17 18 19 csökkent HDL-koleszterinszinttel, 20 megnövekedett apo B-szinttel, 19 koszorúér-betegség (CHD), 19 21 és az inzulinrezisztencia-szindróma néhány jellemzőjével összefüggésben találták. 22 Mivel ezek az anyagcsere-szövődmények a zsigeri elhízás jellemző jellemzői is, megvizsgáltuk annak lehetőségét, hogy az LPL-HinA dIII polimorfizmus szerepet játszhat a zsigeri elhízás és a plazma inzulin- és lipoprotein-koncentrációk közötti összefüggésben.
Mód
Tárgyak
Fehér férfiak egy csoportját toborozták olyan vizsgálatokban való részvételre, amelyek célja az elhízás, a CT által mért regionális zsírszöveti (AT) eloszlás és a plazma lipoprotein szint közötti összefüggések vizsgálata volt. 11 Ennek a kohorsznak 52 alanya vállalta, hogy részt vesz ebben a DNS-elemzéssel járó vizsgálatban. Mind nemdohányzók voltak, és mentesek az anyagcserezavaroktól, amelyek farmakológiai kezelést igényeltek. Valamennyi alany ülő volt, testtömegük a vizsgálat idején stabil volt. A tanulmányt a Laval Egyetem Humánkutatás Etikai Bizottsága hagyta jóvá.
DNS-elemzés
A teljes testzsír mérése
A test sűrűségét hidrosztatikus mérési technikával mértük. 23 A testzsír százalékát a sűrűség alapján becsültük meg a Siri egyenlet segítségével. 24 A zsírtömeget úgy kaptuk meg, hogy a testzsír százalékát megszoroztuk a testtömeggel. A tüdő maradék térfogatát a Meneely és a Kaltreider hélium-hígítási módszerével mértük. 25 A derék és a csípő kerületeit az Airlie konferencia által ajánlott szabványosított eljárásokkal mértük. 26.
A keresztmetszeti hasi szubkután és visceralis AT területeket CT-vel határoztuk meg Siemens Somatom DRH szkennerrel, a korábban leírtak szerint. Röviden: az alanyokat hanyatt fekvő helyzetben vizsgáltuk, mindkét karral a fej fölé nyújtva. A CT-vizsgálatokat a negyedik és az ötödik ágyéki csigolya közötti hasi szinten végeztük a csontváz röntgenfelvételének felhasználásával referenciaként, hogy a leolvasás helyzetét milliméter pontossággal meghatározzuk. A teljes és a zsigeri AT területeket úgy számoltuk ki, hogy ezeket a területeket egy grafikus tollal körülhatároltuk, majd az AT felületeket −190 és −30 Hounsfield egységek csillapítási tartományának felhasználásával számoltuk ki. 28 29 A hasi visceralis AT területét egy vonal húzásával mértük meg a hasüreget körülvevő izomfal között.
Orális glükóz tolerancia teszt
Reggel egy éjszakai böjt után 75 g orális glükóz-tolerancia tesztet (OGTT) hajtottak végre. A vérmintákat vénás katéteren keresztül gyűjtöttük egy antecubitalis vénából 15 perccel a glükóz bevitele előtt és 0, 15, 30, 45, 60, 90, 120, 150 és 180 perccel a plazma glükóz és inzulin koncentrációjának meghatározása céljából. A plazma glükózt enzimatikusan, 30, míg a plazma inzulint radioimmun vizsgálattal mértük polietilénglikol elválasztással. Az OGTT alatt a görbe alatti plazma glükóz- és inzulinterületeket trapéz módszerrel határoztuk meg.
Plazma lipoprotein mérések
Vérmintákat vettünk reggel, 12 órás böjt után, antecubitalis vénából EDTA-t tartalmazó Vacutainerekbe (Becton Dickinson). A koleszterin- és trigliceridszinteket a plazma és a lipoprotein frakciókban enzimatikusan mértük RA-1000 analizátorral (Technicon Instruments Corp). VLDL-ek (d És a HDL-frakciót apo B-tartalmú lipoproteinek kicsapása után kaptuk meg az infranatánsban (d> 1,006 g/ml) heparinnal és MnCl2-val. A HDL2 és HDL3 alfrakciók koleszterintartalmát a HDL2 dextrán-szulfáttal történő kicsapása után határoztuk meg. 34 Apo B és LDL – apo B koncentrációt mértek a plazmában és az infranatánsban, (d> 1,006 g/ml), a Laurell 35 rakéta immunoelektroforetikus módszerének alkalmazásával, a korábban leírtak szerint. 36
AT biopsziák és AT LPL tevékenység
Huszonöt alany almintája adta megalapozott beleegyezését az AT biopsziákhoz. Körülbelül 500 mg AT-t műtéti úton eltávolítottak helyi érzéstelenítésben a hasi (laterális a köldökhöz) és a femorális (comb elülső közepe) zsírraktárakból. Az AT mintákat -80 ° C-on fagyasztva tartottuk a heparinnal felszabaduló 37-es aktivitás későbbi mérése céljából, a korábban leírtak szerint. 38 Egy másik AT mintát emésztettünk kollagenázzal, 39 és izolált adipocitákat mértünk a zsírsejtek átlagos méretének meghatározásához. A triolein sűrűségét használtuk az AT-sejtek térfogatának zsírsejt-tömeggé történő átalakítására. Az AT LPL aktivitást mikromol szabad zsírsavban fejeztük ki óránként 106 sejtenként.
Plazma postheparin LPL aktivitás
12 órás böjt után vért gyűjtöttünk az alanyoktól 10 perccel azután, hogy heparin injekciót kaptak (10 NE/testtömeg-kg IV). Az enzimaktivitás vizsgálatát Nilsson-Ehle és Ekman (41) módszerének módosításával hajtottuk végre, amint azt korábban leírtuk. Röviden, a plazma LPL aktivitását úgy határoztuk meg, hogy glicerin-tri [14C] -oleaátot használtunk szubsztrátként egy Triton X-100-at tartalmazó 0,1 mol/l Tris-HCl pufferben (pH 8,0) előállított mesterséges emulzióban és a delipidált humán szérum mintákban. 30 ° C-on 20 percig inkubáltuk 1,0 mol/l NaCl jelenlétében vagy hiányában. Az inkubálás során felszabaduló szabad zsírsavakat szelektíven extraháltuk, és egy alikvot részt megszámoltunk 14 C-os radioaktivitásra. Az LPL aktivitást az összes lipázaktivitásból (NaCl nélkül) 1,0 mol/L NaCl-ra érzékeny lipázaktivitásként számítottuk. Az LPL-aktivitást milliliter plazmában/percben felszabaduló olajsav nanomóljában fejezzük ki.
Statisztikai analízis
Eredmények
52 személyt elemeztek az LPL szempontjából-HindIII polimorfizmus. A relatív allél frekvenciák 0,24 és 0,76 voltak az - allél (a restrikciós hely nem hordozója), illetve a + allél esetében. Az alanyokat két csoportba soroltuk: (1) azok, akik heterozigóták voltak a csoportra HindIII polimorfizmus (+/− csoport, n = 23) és (2) azok, akik homozigóták voltak a + allélra (+/+ csoport, n = 28). Egy olyan alanyot, aki homozigóta volt az - allélra, kizárták az elemzésből. Az alanyok LPL genotípus szerinti jellemzőit az 1. táblázat mutatja be. A két genotípuscsoport életkor, BMI, zsírtömeg, derék-csípő arány, zsigeri AT-területek, éhomi inzulin, valamint glükóz- és inzulinterületek voltak összehasonlíthatók az OGTT során. A 2. táblázat eredményei nem mutatnak különbséget a plazma lipoprotein szintekben a két csoport között.
Hasonló elemzéseket végeztek a koleszterin/HDL koleszterin arány tekintetében is (nem látható). Nem tapasztaltak szignifikáns különbségeket a négy alcsoport között alacsony vagy magas BMI alapján. A zsigeri elhízás hajlamos volt a magasabb koleszterin/HDL koleszterin arányhoz társulni a +/+ genotípus jelenlétében, míg +/− alanyokban a magas vagy alacsony viszcerális AT területek nem tudtak különbséget tenni a magas és az alacsony koleszterin között. -H – HDL koleszterin arány. Végül a magas inzulinszinttel rendelkező két csoportban magasabb koleszterin/HDL koleszterin arányt figyeltek meg, ami arra utal, hogy ez a kapcsolat független lehet a HindIII genotípus.
Bár az LPL polimorfizmus azonosult a HinA dIII a gén nem kódoló DNS-szekvenciájában (8. intron) található, teszteltük, hogy befolyásolja-e az AT és a postheparin LPL aktivitását (3. táblázat). Nem találtunk szignifikáns különbséget a két genotípus között, ami arra utal, hogy a HinA dIII restrikciós hely nem változtatja meg a plazma és az AT LPL aktivitását. Amikor az alcsoportokat alacsony és magas BMI, visceralis AT területek és éhomi inzulin alapján alakították ki, nem figyeltek meg szignifikáns különbséget az AT és a postheparin LPL aktivitások alcsoportjai között (az adatokat nem közöltük).
Vita
A + /+ HinA dIII genotípus megváltoztatta a BMI, az inzulinémia és a zsigeri elhízás közötti kapcsolatot az éhomi triglicerid szinttel, mivel szignifikáns összefüggéseket csak a +/+ csoportban találtak. Alapvetően hasonló eredményeket figyeltünk meg, amikor a plazma HDL2-koleszterint használtuk függő változóként. Ezek a triglicerid- és HDL2-koleszterinszintre gyakorolt hatások összhangban vannak az LPL fiziológiai szerepének hipotézisével, amely nemcsak a trigliceridekben gazdag lipoproteineket hidrolizálja, hanem a plazma HDL-szintjét is módosítja. Számos metabolikus és kísérleti tanulmány kimutatta, hogy a magas LPL aktivitás általában a magas plazma HDL szinttel, különösen a HDL2 szubfrakcióval társul. 49 Ezen okok miatt nem meglepő, hogy a trigliceridek és a HDL2-koleszterin kölcsönös módon megváltozott, de eredményeink hangsúlyozzák, hogy ennek a hatásnak a mértéke sokkal nagyobb a homozigóta +/+ genotípusban.
Az LPL-HinA dIII polimorfizmus az LPL gén 8. intronjában található, ezért nem szabad összefüggésbe hozni az enzimaktivitás különbségeivel, és elméletileg nem lehet a megfigyelt hatások oka. Ennek megfelelően a femoralis és a hasi AT LPL aktivitás nem különbözött a két genotípus között; a postheparin plazma LPL aktivitása szintén hasonló volt a két csoportban. Így valószínű, hogy az LPL-HinA dIII polimorfizmus kötődési egyensúlyhiányban van az LPL gén vagy egy másik gén funkcionális mutációjával, amely hajlamosíthatja az egyéneket a diszlipidémiára. Ezenkívül a megfigyelt hatás oka lehet az LPL gén szabályozásának különbsége is a két genotípus között. Az inzulin az LPL enzim fontos szabályozója, és ez a hormon szabályozhatja az LPL-t az mRNS 50 és/vagy a poszttranszkripciós 51-es szinten. Például a + allél társulhat egy funkcionális LPL enzimmel, amely kevésbé érzékeny az inzulinra, és csökkent viszkozitási elhízás esetén az LPL inzulinra adott válaszát eredményezheti. Más szabályozók is részt vehetnek az itt leírt hatások közvetítésében.
Összefoglalva, ezek az eredmények azt mutatják, hogy a hasi zsigeri elhízással járó diszlipidémia, különösen a plazma trigliceridek és a HDL2 koleszterin, jelentős mértékben modulálható az LPL gén variációival annak ellenére, hogy nincs hatása a mérhető LPL aktivitásra. Így ez az LPL polimorfizmus egy másik genetikai markernek tekinthető, amely befolyásolja a plazma lipoprotein szintjét és feltehetően a CHD kockázatát a zsigeri zsír szintjéhez viszonyítva. Nyilvánvaló, hogy a CHD kockázat megfelelő felmérése érdekében meg kell vizsgálni a több jelölt gén közötti kölcsönhatásokat. Nagy kohorszokon alapuló vizsgálatokra lesz azonban szükség az apo E, apo B és LPL gének közötti egyszerű interakciók vizsgálatához.
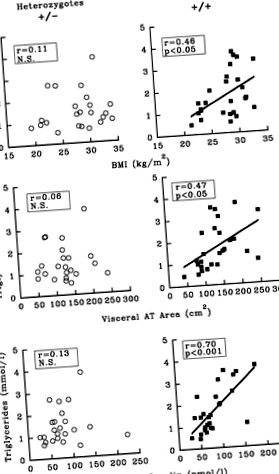
1.ábra. A testtömeg-index (BMI), a zsigeri zsírszövet (AT) számítógépes tomográfiával mért területe, az éhomi plazma inzulinszint és az éhomi plazma triglicerid koncentráció közötti összefüggéseket ábrázoló scatterplotok a lipoprotein lipáz (LPL) alapján meghatározott férfiak csoportjában -HindIII genotípus. A + allélre homozigóta egyedek (az allél a restrikciós enzim által vágott HindIII) a +/+ csoportba kerültek (n = 26), míg az - allélre heterozigóta alanyok (nem HindIII restrikciós hely) bekerültek a +/− csoportba (n = 23).
2. ábra. A testtömeg-index (BMI), a zsigeri zsírszövet (AT) számítógépes tomográfiával mért területe, az éhomi plazma inzulinszint és a plazma HDL2-koleszterin-koncentrációja közötti összefüggéseket mutatják be a férfiak két csoportjában, felosztva a lipoprotein lipáz (LPL) -HindIII genotípus (n = 20 és 25 a +/− és +/+ genotípusok esetében).
3. ábra. Oszlopdiagramok, amelyek az egyes lipoprotein lipázok (LPL) plazma triglicerid szintjének összehasonlítását mutatják -HindIII genotípus alacsony és magas testtömeg-index (BMI), alacsony vs magas éhomi inzulinszint és alacsony vs magas viscerális zsírszövet (AT) területű férfiak között. A teljes csoportban az inzulineloszlás medián értékét használták az alacsony vagy magas inzulinszinttel rendelkező alanyok meghatározásához. Az egyes sávokon belüli szám azonosítja az egyes alcsoportokat, míg az SE feletti szám jelentős különbséget jelez a megfelelő csoporttal (P≤.05). Az alcsoportok alanyainak száma (balról jobbra) n = 7, 16, 8 és 18 volt a BMI esetében; n = 7, 16, 9 és 17 a zsigeri AT területére; és n = 11, 12, 11 és 15 az éhomi inzulinszint esetén.
Asztal 1. A lipoprotein lipáz (LPL) alapján meghatározott két férficsoport antropometriai és metabolikus jellemzői -HindIII polimorfizmus
Az eredmények átlag ± SD.
2. táblázat. Plazma lipid és lipoprotein szint a két lipoprotein lipázban (LPL) -HindIII genotípuscsoportok
Az eredmények átlag ± SD; alanyok száma zárójelben.
3. táblázat. A lipoprotein lipáz (LPL) aktivitás a férfiak LPL alapján meghatározott alcsoportjaiban-HindIII genotípus
Az adatok átlag ± SD; alanyok száma zárójelben.
Ezt a tanulmányt a Kanadai Orvosi Kutatási Tanács (MRC), a Kanadai Szív és Stroke Alapítvány és a Kanadai Diabetes Szövetség támogatta. M.-C. Vohl és B. Lamarche MRC ösztöndíjakat kapott a vizsgálat során. A szerzők köszönetüket szeretnék kifejezni az adatgyűjtésben részt vevő kutatószemélyzetnek. A Lipid Kutatóközpont, a Cukorbetegség Kutató Egység és a Testmozgástudományi Laboratórium munkatársainak hozzájárulását elismerik.
- A C - vitamin gátolja a zsigeri adipocita hipertrófiáját és csökkenti a vér glükózszintjét
- A szubkután és a zsigeri hasi zsír ultrahang értékelése a terhesség előrejelzőjeként
- Mit eszel az energiaszint növelése érdekében
- Az argon plazma koaguláció hatékonysága a karvedilollal szemben a hipertóniás portál kezelésében
- Az USA elhízási szintje államok szerint - elhízás