A magas fehérje által kiváltott glomeruláris hiperfiltráció független a tubuloglomeruláris visszacsatolási mechanizmustól és a nitrogén-oxid szintázoktól
Orvosi Sejtbiológiai Tanszék, Uppsala Egyetem, Uppsala, Svédország; és
Az újranyomtatási kérelmek és egyéb levelezések címe: J. Sällström, Orvosi Sejtbiológiai Osztály, Uppsala Univ., Biomedical Center, Box 571, SE-751 23 Uppsala, Svédország (e-mail: [email protected] vagy [email protected] ).
Orvosi Sejtbiológiai Tanszék, Uppsala Egyetem, Uppsala, Svédország; és
Orvosi Sejtbiológiai Tanszék, Uppsala Egyetem, Uppsala, Svédország; és
Élettani és Farmakológiai Tanszék, Karolinska Intézet, Stockholm, Svédország
Orvosi Sejtbiológiai Tanszék, Uppsala Egyetem, Uppsala, Svédország; és
Orvosi Sejtbiológiai Tanszék, Uppsala Egyetem, Uppsala, Svédország; és
Orvosi Sejtbiológiai Tanszék, Uppsala Egyetem, Uppsala, Svédország; és
Absztrakt
A magas fehérjebevitel a megnövekedett glomeruláris szűrési sebességgel (GFR) jár, amelyet a tubuloglomeruláris visszacsatolási mechanizmus (TGF) csökkentett jelzésével lehet közvetíteni. Kimutatták, hogy a nitrogén-oxid (NO) hozzájárul a magas fehérje-indukálta glomeruláris hiperszűréshez, de a felelős NO-szintáz (NOS) izoform nem egyértelmű. Ebben a tanulmányban kidolgozták a magas fehérjetartalmú hiperszűrés modelljét tudatos egerekben. Ezzel a modellel megvizsgáltuk a TGF szerepét adenozin A1-receptor knockout egerek alkalmazásával, amelyekből hiányzott a TGF mechanizmus. Továbbá tanulmányozták a különböző NOS izoformák szerepét neuronális, indukálható és endotheliális NOS knockout egerekkel, továbbá vad típusú egerekkel, amelyeket akutan adtak be a nem specifikus NOS inhibitorral. N ω -nitro-1 -arginin-metil-észter (100 mg/kg). A GFR-t egymás után mértük egerekben, akik alacsony fehérjetartalmú étrendet (8% kazein) fogyasztottak 10 napig, majd magas fehérjetartalmú étrendet (50% kazein) követve 10 napig. Valamennyi egérnél hasonló mértékben alakult ki magas fehérje által indukált hiperfiltráció. Ezek az eredmények azt mutatják, hogy a magas fehérje által kiváltott glomeruláris hiperfiltráció független a TGF mechanizmustól és a NOS izoformáktól.
krónikus, magas fehérjetartalmú bevitel társul a glomeruláris szűrési sebesség (GFR) növekedésével emberben, valamint állatmodellekben (2, 18, 19). A hiperfiltrációnak általában klinikai jelentősége van, mivel vesekárosodást okozhat, amely albuminuriával, glomerulosclerosisral és hipertóniával társul (4).
A tubuloglomeruláris visszacsatolási (TGF) mechanizmus egy negatív visszacsatolási hurok, amely az egyes nephronok juxtaglomeruláris berendezésében működik, és amely a tubuláris nátriumterhelést a tubuláris szállítási kapacitáshoz igazítja (16). Ha a GFR emelkedik, a makula densa sejtek megnövekedett tubuláris nátrium-klorid koncentrációt észlelnek, a TGF mechanizmus későbbi aktiválásával. Az eredmény az afferens arteriole és a normalizált GFR szűkülete lesz. A makula densa sejtekből a szomszédos afferens arteriolákba történő jelzés adenozint tartalmaz, és az adenozin A1-receptorokból (A1AR) hiányos knockout egerekből hiányzik a TGF válasz (5, 21).
A magas fehérje által kiváltott hiperszűrést a TGF-mechanizmus közvetítésével javasolták (18, 24). A magas fehérjebevitel fokozza az aminosavak szűrését, ami viszont növeli az aminosavak újrafelszívódását a proximális tubulusban. Mivel a legtöbb aminosav visszaszívódása nátriumfüggő [áttekintette Gonska et al. (7)], fokozott nátrium-felszívódás is megtörténik. Ez csökkenti a makula densa nátrium-klorid koncentrációját, következésképpen csökkenti a TGF jelátvitel mértékét, amely várhatóan növeli a GFR-t.
Az NO egy erőteljes értágító, amelyet háromféle nitrogén-monoxid-szintáz (NOS) izoform képez; endoteliális (eNOS), indukálható (iNOS) és neuronális (nNOS) NOS. A vesekéregben a GFR szabályozásában a legfontosabbnak tartott izoformák az eNOS és az nNOS. Az eNOS bőséges az afferens arteriolákban, az nNOS pedig főleg a makula densa sejtekben található meg [a Mount and Power áttekintése (12)]. Az NO-t a hiperszűrés lehetséges közvetítőjének tekintették, mivel a ciklikus guanozin-monofoszfát vizelettel történő kiválasztása megnő a magas fehérjetartalmú bevitel során (8), és a nem specifikus NOS-gátlás csökkentette a hiperfiltrációt (25). Ezenkívül a legfrissebb adatok rámutattak az nNOS különleges szerepére a hiperfiltrációban (27).
Jelen tanulmányban kifejlesztettünk egy modult a magas fehérjetartalmú hiperszűrésre tudatos egerekben. Ez a technika lehetővé teszi az egymást követő méréseket ugyanazon állatnál, és kiküszöböli az érzéstelenítés kiszámíthatatlan hatásainak kockázatát. Ennek a modellnek a segítségével két lehetséges mechanizmust vizsgáltunk, amelyek magas fehérje-indukálta hiperfiltrációt okozhatnak: csökkent TGF-aktivitás a megnövekedett proximális újrafelszívódás miatt és megnövekedett NO-termelés, amely közvetlenül tágítja az afferens arteriolt.
Minden kísérletet az uppsalai regionális állatetikai bizottság hagyott jóvá, és az Országos Egészségügyi Intézet laboratóriumi állatok felhasználására és gondozására vonatkozó nemzetközi irányelveinek megfelelően hajtották végre. Négy kísérleti sorozatot hajtottak végre egereken.
1. sorozat: modell kidolgozása a magas fehérjetartalmú glomeruláris hiperfiltrációhoz egerekben.
2. sorozat: a TGF szerepe a glomeruláris hiperfiltráció kialakulásában.
A TGF hatását női A1AR knockout (A1AR -/-) és megfelelő vad típusú (A1AR +/+) egerek felhasználásával vizsgálták a Johansson és munkatársai által kifejlesztett törzsből (9), amelyeket a Jackson Laboratory (Bar Harbor, ME) keresztezett ) C57BL/6J háttérre. A GFR-t először 10 nap után mértük alacsony fehérjetartalmú étrenden. Az étrendet ezután magas fehérjetartalomra cserélték, és a GFR-t 10 nap múlva ismét megmérték.
3. és 4. sorozat: a NOS szerepe a glomeruláris hiperfiltráció kialakulásában.
Ban ben 3. sorozat, a különféle NOS izoformák hatását specifikus NOS knockout egerek (eNOS -/-, nNOS -/- és iNOS -/-) alkalmazásával vizsgálták egy C57BL/6J háttérre és a megfelelő C57BL/6J vad típusokra, amelyeket az osztályon tenyésztettek homozigóta tenyésztésből párok. Az állatokat rendszeresen genotipizáljuk PCR alkalmazásával, hogy ellenőrizzük a törzsek integritását. A hím és nőstény (3–6 hónapos) egereket egyenlő arányban (~ 50% hím/nőstény) használtuk minden csoportban. A GFR-t először 10 nap után mértük alacsony fehérjetartalmú étrenden. Az étrendet ezután magas fehérjetartalomra cserélték, és a GFR-t 10 nap múlva ismét megmérték. Ban ben 4. sorozat, ugyanezt az eljárást megismételtük hím vad típusú egerekkel, amelyek intraperitoneális injekciót kaptak a nem specifikus NOS inhibitorról N ω -nitro-1 -arginin-metil-észter (l -NAME; 100 mg/kg) vagy vivőanyag (sóoldat) 30 perccel mindkét GFR-mérés előtt.
Fogyókúrák.
Az állatok vagy alacsony fehérjetartalmú, vagy magas fehérjetartalmú étrendet kaptak (8, illetve 50% kazein; Lantmännen, Kimstad, Svédország). A diéták izokalorosak voltak (14 kJ/g), és hasonló elektrolit-összetételűek voltak. A kísérletek megkezdése előtt az állatokat 18,5% fehérjét (R36; Lantmännen) tartalmazó állattartó létesítmény szokásos étrendjén tartották.
A glomeruláris szűrési sebesség mérése.
Az inulin-clearance-t, mint a GFR mérését, öntudatos állatoknál határoztuk meg Qi és mtsai. (14) Az állatokat egy egyedi tervezésű plexi kamrában fékeztük, és 200 μl sóoldatban oldott farkú vénába [3H] metoxi-inulint (~ 85 kBq; American Radrolabeled Chemicals, St. Louis, MO, USA) adtunk be., 27 ml-es tűvel ellátott 1 ml-es fecskendővel. Az állatokat ezután visszatették ketreceikbe. Vérmintákat (egyenként ~ 5 μl) vettünk egy farokcsúcson lévő kis vágásból heparinizált üvegkapillárisokba 1., 3., 7., 10., 15., ~ 35., 55. és 75. percben. Az inulin plazmakoncentrációját folyadék szcintillációs számlálóval határoztuk meg (Wallac 1409, Wallac Oy, Turku, Finnország). Az inulin clearance-t úgy számítottuk ki, hogy az adott intravénás dózist elosztottuk a plazma inulin időgörbe alatti teljes területtel (AUC0-∞). Az AUC0-∞ értékét nem rekeszes farmakokinetikai adatok elemzésével becsültük meg az adatpontok összekapcsolásával képződő trapéz területek összeadásából (20). A terminális fázis területét, azaz 15 perctől a végtelenig (beleértve az utolsó mérés utáni maradék területet is) kiszámítottuk a lejtés egyenlete alapján. Az első mérés előtti területet lineáris back-extrapolációval számoltuk.
A NOS izoformák mRNS expressziója.
A magas fehérjetartalmú étrenden lévő vad típusú és a különböző NOS-kieső állatok veséinek vesekéregét elválasztották és azonnal folyékony nitrogénben lefagyasztották. A teljes RNS-t RNeasy mini kit alkalmazásával extraháltuk, és a mintákat reverz átírással írtuk le a QuantiTect reverz transzkripciós készlet segítségével (Qiagen, Hilden, Németország). A NOS expresszióját SYBR Green qPCR készlettel valós idejű termociklerrel (LightCycler, Roche Diagnostics, Mannheim, Németország) számszerűsítettük, és a 18S expresszióját ΔCt módszerrel kapcsoltuk össze. A primer szekvenciákat a kiegészítő adatok tartalmazzák.
Statisztika.
Valamennyi értéket átlag ± SE értékben fejezzük ki. A magas fehérjetartalmú étrenddel végzett kezelést követően a jelentett ΔGFR értéket a csoport összes állatában az egyed növekedésének átlagértékeként számoltuk ki. A genotípusok közötti többszöri összehasonlítást egyirányú ANOVA alkalmazásával, a hiperszűrő választ kétirányú ismételt ANOVA alkalmazásával vizsgáltuk. Ha az ANOVA szignifikáns volt, akkor Fisher által védett legkevésbé szignifikáns különbséget utólagos tesztet hajtottunk végre. Az egyes összehasonlításokat Student's segítségével végeztük t-teszt. Minden összehasonlításhoz, P 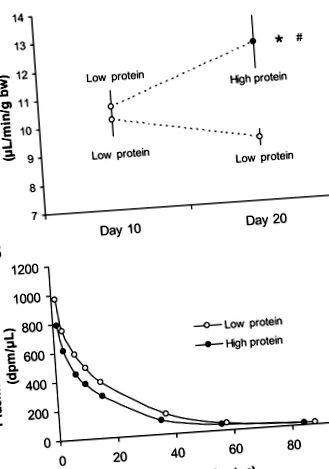
1. ábra.A: glomeruláris szűrési sebesség vad típusú egerekben, akik 10 napig alacsony fehérjetartalmú étrendet kaptak, majd magas vagyn = 7) vagy alacsony (n = 6) fehérje diéta 10 napig. B: reprezentatív inulin eltűnési görbe egy állatból, alacsony fehérjetartalmú étrendből, ill. *P
2. ábra.Testsúly (A), vese súlya (B), a vese-test tömeg arány (C) és a glomeruláris térfogat (D) vad típusú egereknek in 1. sorozat vagy alacsony- (n = 6) vagy magas fehérjetartalmú (n = 6) diéta. *P
2. sorozat.
Az A1AR -/- egerek hasonló GFR-rel rendelkeztek, és hasonló hiperszűrésük alakult ki, mint a megfelelő vad típusú kontrollok (3. ábra). Az A1AR -/- egerek növekedése 5,0 ± 1,8, a vad típusú egerekben 6,4 ± 2,3 μl · perc -1-1 g test tömeg -1. Az A1AR -/- egerek testtömege valamivel nagyobb volt, mint a vad típusú kontrolloké (alacsony fehérjetartalom: 33 ± 2 vs. 27 ± 1 g; magas fehérjetartalom: 33 ± 2 vs. 28 ± 1 g).
3. ábra.Glomeruláris szűrési sebesség vad típusú (n = 6) és az adenozin A1-receptor knockout egerek (A1AR -/-, n = 6) 10 napig alacsony fehérjetartalmú étrendet, majd 10 napig magas fehérjetartalmú étrendet követve. *P
3. sorozat.
Az nNOS, eNOS vagy iNOS hiányzó állatoknál hasonló mértékű hiperszűrés alakult ki, mint vad típusú kontrolljaiknál (4. ábra és 1. táblázat). Az eNOS -/- alacsonyabb GFR-t mutatott, mint a vad típusoké mindkét étrendben. Az nNOS -/- alacsonyabb GFR volt az alacsony fehérjetartalmú étrendben, de ez nem volt szignifikáns a magas fehérjetartalmú étrendnél (P = 0,17). Az iNOS -/- esetében a GFR-ben nem találtunk különbséget a vad típusokhoz képest. Az iNOS -/- és az eNOS -/- testtömege kissé alacsonyabb volt, mint a vad típusú kontrolloké; ez a különbség azonban csak a magas fehérjetartalmú étrendben volt szignifikáns. (Asztal 1). A különböző NOS izoformák vese kortikális mRNS expressziójában nem találtunk különbséget a genotípusok között (5. ábra).
4. ábra.Glomeruláris szűrési sebesség vad típusú (n = 8), endothel- (eNOS -/-, n = 8), neuronális- (nNOS -/-, n = 6), és indukálható- (iNOS -/-, n = 9) nitrogén-oxid-szintáz knockout egerek 10 napig alacsony fehérjetartalmú étrendet követnek, majd 10 napig magas fehérjetartalmú étrendet tartanak. *P
1. táblázat: Testsúly és a glomeruláris szűrési sebesség növekedése vad típusú, eNOS -/-, nNOS -/- és iNOS -/- egerekben 10 napig alacsony fehérjetartalmú étrendet követett, majd magas fehérjetartalmú étrend 10 nap (3. sorozat)
Az értékeket átlag ± SE-ként fejezzük ki. GFR, glomeruláris szűrési sebesség; NOS, nitrogén-oxid szintáz. Vad típus: n = 8; endoteliális NOS null (eNOS -/-): n = 8; neuronális NOS null (nNOS -/-): n = 6; indukálható NOS null (iNOS -/-): n = 9.
* P
5. ábra.A különböző NOS izoformák relatív mRNS expressziója vad típusú (n = 7), eNOS -/- (n = 4), nNOS -/- (n = 5), és iNOS -/- (n = 6) a magas fehérjetartalmú étrendben nitrogén-oxid-szintáz kiütési egerek.
4. sorozat.
Az l -NAME-t kapott állatok GFR-je alacsonyabb volt mind alacsony, mind magas fehérjetartalmú étrendben, összehasonlítva a vivőanyaggal kezelt egerekkel. Az l -NAME-vel kezelt állatok hiperszűrést mutattak a magas fehérjetartalmú étrenden (6. ábraA). Bár a GFR abszolút növekedése (GFR magas fehérjetartalmú étrenden-GFR alacsony fehérjetartalmú étrenden) szignifikánsan alacsonyabb volt az l -NAME kezelés alatt, csak azokhoz az állatokhoz képest, amelyek csak vivőanyagot kaptak (1,2 ± 0,6 vs. 3,0 ± 0,7 μl · perc –1 · g test wt −1), a relatív növekedés mindkét csoportban hasonló volt (6. ábraB).
6. ábra.Glomeruláris szűrési sebesség vad típusú egerekben 10 napig alacsony fehérjetartalmú étrendben, majd 10 napig magas fehérjetartalmú étrendben. A: A GFR mérése előtt az állatokat vivőanyaggal előkezeltük (n = 10) vagy 1 -NAME (100 mg/testtömeg-kg; n = 10). B: a magas fehérjetartalmú étrend által kiváltott relatív változás a GFR-ben. *P
A magas fehérjetartalmú bevitel során a proximális tubulusban megnő a nátrium-függő aminosav-felszívódás. Korábbi kísérleteinkben bebizonyítottuk, hogy a magas fehérjetartalmú étrendet tápláló patkányoknak az emelkedett GFR ellenére a nátrium-klorid koncentrációja csökken a korai disztális tubulusokban, ami a makula densa csökkent koncentrációját jelzi (18). Így csökken az afferens arteriolához érkező visszacsatolási jel, amely a GFR növekedését eredményezheti. E magyarázó modell szerint az A1AR -/- TGF mechanizmus nélküli GFR-re ennélfogva az étrendi fehérjebevitel kevésbé várható. Ugyanakkor a jelen tanulmányban, amikor ezeket a kiütéses egereket magas fehérjetartalmú étrenddel kezelték, hasonló mértékű hiperfiltrálást mutattak, mint a vad típusú egerek, jelezve, hogy a hiperszűrés a TGF mechanizmusától függetlenül történik.
A glomeruláris hiperfiltráció a cukorbetegség alatt is megtalálható, és a betegség későbbi szakaszában a mikroalbuminuria és a nephropathia kialakulásának fokozott kockázatával jár (1, 11, 15). A GFR emelését a TGF mechanizmusától is függővé tették (23). Ezen elmélet szerint a glomeruláris hiperfiltráció másodlagos a megnövekedett proximális nátrium-glükóz kotranszport miatt. A makula densa nátrium-klorid-terhelésének ebből eredő csökkenése csökkenti a TGF-választ, következésképpen növeli a GFR-t. A legfrissebb adatok azonban az A1AR -/- két cukorbetegség modelljének konzervált hiperfiltrálását igazolták, jelezve, hogy a TGF mechanizmusra nincs szükség a hiperfiltrációhoz (6, 22). Következésképpen a makula densa csökkent nátriumterhelése hosszú távon nem növeli a GFR-t a TGF-mechanizmus révén, sem cukorbetegség okozta hiperfiltráció, sem magas fehérjebevitel esetén.
A jelenben, valamint a krónikus, magas fehérjetartalmú fogyasztás által kiváltott hiperszűrés számos más modelljében megnövekedett glomeruláris térfogatról számolnak be. Mivel sem a NOS-gátlás, sem a TGF-hiány nem befolyásolta a hiperfiltráció mértékét, lehetséges, hogy a megnövekedett glomeruláris térfogat közvetlenül hozzájárul a megnövekedett GFR-hez. Kimutatták, hogy a vaszkuláris endoteliális növekedési faktor szerepet játszik a glomeruláris hipertrófia kialakulásában krónikus, magas fehérjebevitel alatt (17), és célpontja lehet a glomeruláris növekedéssel és hiperfiltrációval kapcsolatos jövőbeni vizsgálatoknak. Továbbá, mivel ez a tanulmány csak a megnövekedett fehérjebevitel krónikus helyzetével foglalkozik, lehetséges, hogy az NO és a TGF mechanizmus fontos az aminosav infúzióra vagy a fehérjében gazdag étkezésre adott akut hiperszűrő reakcióhoz.
Összefoglalva, a magas fehérjebevitel által kiváltott glomeruláris hiperfiltráció a TGF mechanizmusától és a NOS izoformáktól függetlenül történik. Azonban bazális körülmények között az eNOS-ból és az nNOS-ból származó NO fontos a normális GFR fenntartásához. Mivel a magas fehérje-indukálta glomeruláris hiperfiltráció az említett fontos szabályozó rendszerektől függetlenül történik, valószínű, hogy a glomeruláris növekedés, amely növeli a szűrési területet, közvetlenül hozzájárulhat a megnövekedett GFR-hez.
Perspektívák és jelentőség
Jelen tanulmányt viszonylag új módszertan alkalmazásával végeztük el a GFR mérésekhez, amely egyszerűnek és rendkívül hasznosnak bizonyult az étrendi fehérjetartalom változásaira adott hiperszűrő válasz értékelésére. A vizsgált tényezők egyike (azaz a specifikus NOS izoformák vagy a TGF) egyikének sem találták jelentősen hozzájárulását a magas fehérje által kiváltott hiperfiltrációhoz. A leírt protokoll azonban hasznos lehet a hiperszűrést okozó mechanizmusokat célzó jövőbeli vizsgálatokban.
Ezt a tanulmányt anyagilag támogatta a Svéd Kutatási Tanács (K2009-64X-03522-38-2), a Wallenberg Alapítvány, a Wallenberg Consortium North, a Svéd Szív és Tüdő Alapítvány (20070198), valamint az Ingabritt és Arne Lundberg Alapítvány.
A szerzők nem jelentenek be pénzügyi vagy egyéb összeférhetetlenséget.
- Független áttekintés Fogyás 9 hetes baba legjobb fogyókúrás tabletták DA-Regionális Területi Iroda III
- Az azonnali zabkása nem biztos, hogy olyan egészséges, mint azt a The Independent The Independent reklámozta
- Hogyan lehet megütni egy kekszet, megmondhatja, hogy hány szénhidrátot kell megennie The Independent The Independent
- A kannibál patkányokat szállító Lyubov Orlova Ghost hajó „Nagy-Britannia felé tarthat” The Independent The
- Meddig élhet túl egy ember víz nélkül The Independent The Independent